20-21高二上·江西南昌·期中
解题方法
1 . 已知氢氧化钙和钨酸钙(CaWO4都是微溶电解质,两者的溶解度均随温度升高而减小。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应I: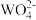 (aq)+Ca(OH)2(s)⇌CaWO4(s)+2OH-(aq),如图为不同温度下Ca(OH)2、CaWO4 的沉淀溶解平衡曲线。试回答下列问题:
(aq)+Ca(OH)2(s)⇌CaWO4(s)+2OH-(aq),如图为不同温度下Ca(OH)2、CaWO4 的沉淀溶解平衡曲线。试回答下列问题:

(1)①计算T1时,Ksp(CaWO4)=
②T1
(2)①反应I平衡常数K的表达式为
②该反应的△H
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值直相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5mol/L]中,加入过量Ca(OH)2,反应达到平衡后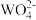 的沉淀率为60%,此时
的沉淀率为60%,此时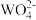 的平衡浓度为
的平衡浓度为
您最近一年使用:0次
名校
解题方法
2 . 从废旧磷酸铁锂电池的正极材料(含LiFePO4、石墨粉和铝箔等)中综合回收锂、铁和磷等的工艺流程如图所示:
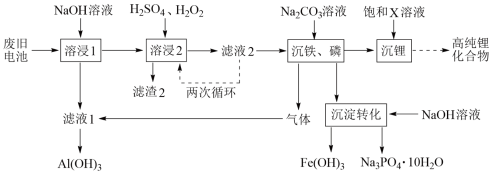
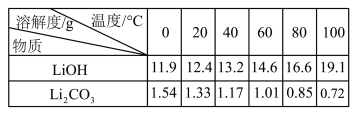
回答下列问题:
(1)“溶浸1”中铝溶解的化学方程式为___________________________ 。
(2)完成“溶浸2”反应的离子方程式___________________________ :
 LiFePO4+
LiFePO4+ H2O2+
H2O2+ =
= Li++
Li++ +
+ H2PO4-+
H2PO4-+ H2O
H2O
(3)“滤渣2”的主要成分是_______________ 。
(4)“滤液2”循环两次的目的是___________________________ 。
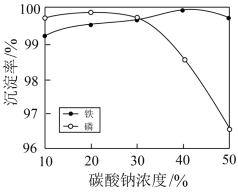
(5)“沉铁、磷”时,析出FePO4沉淀,反应的离子方程式为_______________________ 。实验中,铁、磷的沉淀率结果如图所示。碳酸钠浓度大于30%后,铁沉淀率仍然升高,磷沉淀率明显降低,其可能原因是___________________________ 。
(6)为了充分沉淀,“沉锂”时所用的X和适宜温度是___ (填标号)。
A.NaOH20-40℃B.NaOH80-100℃
C.Na2CO320-40℃D.Na2CO360-80℃


回答下列问题:
(1)“溶浸1”中铝溶解的化学方程式为
(2)完成“溶浸2”反应的离子方程式
 LiFePO4+
LiFePO4+ H2O2+
H2O2+ =
= Li++
Li++ +
+ H2PO4-+
H2PO4-+ H2O
H2O(3)“滤渣2”的主要成分是
(4)“滤液2”循环两次的目的是
(5)“沉铁、磷”时,析出FePO4沉淀,反应的离子方程式为

(6)为了充分沉淀,“沉锂”时所用的X和适宜温度是
A.NaOH20-40℃B.NaOH80-100℃
C.Na2CO320-40℃D.Na2CO360-80℃
您最近一年使用:0次
名校
解题方法
3 . 向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中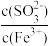 变化的曲线如图所示。
变化的曲线如图所示。

实验发现:
ⅰ.a 点溶液澄清透明,向其中滴加 NaOH 溶液后,立即产生灰白色沉淀,滴入 KSCN 溶液显红色;
ⅱ.c 点和 d 点溶液中产生红褐色沉淀,无气体逸出;取其上层清液滴加NaOH溶液后无明显现象,滴加 KSCN 溶液显红色。
下列分析合理的是
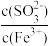 变化的曲线如图所示。
变化的曲线如图所示。
实验发现:
ⅰ.a 点溶液澄清透明,向其中滴加 NaOH 溶液后,立即产生灰白色沉淀,滴入 KSCN 溶液显红色;
ⅱ.c 点和 d 点溶液中产生红褐色沉淀,无气体逸出;取其上层清液滴加NaOH溶液后无明显现象,滴加 KSCN 溶液显红色。
下列分析合理的是
| A.检验a点溶液中反应生成的阴离子所需试剂为:稀硝酸和BaCl2溶液 |
B.c点和d点出现上述现象的主要原因是Fe3+和 发生双水解反应 发生双水解反应 |
C.b点较a点溶液pH升高的主要原因:2Fe3++ +H2O = 2Fe2++ +H2O = 2Fe2++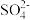 +2H+ +2H+ |
| D.向d点上层清液中滴加 NaOH溶液无明显现象,证明溶液中无Fe3+ |
您最近一年使用:0次
4 . 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。请回答下列问题:
(1)下列说法正确的是__ (填序号)。
A.向BaSO4饱和溶液中加入固体Na2SO4可以由a点变到b点
B.通过蒸发可以由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
(2)将100mL1mol•L-1H2SO4溶液加入100mL含Ba2+0.137g的溶液中充分反应后,过滤,滤液中残留的Ba2+的物质的量浓度约为___ 。
(3)若沉淀分别用100mL纯水和100mL0.01mol•L-1的H2SO4溶液洗涤,两种情况下损失的BaSO4的质量之比为__ 。

(1)下列说法正确的是
A.向BaSO4饱和溶液中加入固体Na2SO4可以由a点变到b点
B.通过蒸发可以由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
(2)将100mL1mol•L-1H2SO4溶液加入100mL含Ba2+0.137g的溶液中充分反应后,过滤,滤液中残留的Ba2+的物质的量浓度约为
(3)若沉淀分别用100mL纯水和100mL0.01mol•L-1的H2SO4溶液洗涤,两种情况下损失的BaSO4的质量之比为
您最近一年使用:0次
2020-06-14更新
|
154次组卷
|
4卷引用:【南昌新东方】江西省九江一中2014-2015学年高二上学期期中化学试卷
(已下线)【南昌新东方】江西省九江一中2014-2015学年高二上学期期中化学试卷2016-2017学年湖北省襄阳五中高二上10月月考化学试卷【全国百强校】黑龙江省双鸭山市第一中学2018-2019学年高二下学期开学考试化学试题(已下线)专题3 溶液中的离子反应 综合评价(1)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)
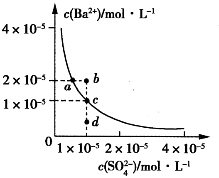
5 . 常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如下图所示(不考虑C2O42-的水解)。下列叙述正确的是

| A.Ksp(Ag2C2O4)的数量级等于10-7 |
| B.n点表示AgCl的不饱和溶液 |
| C.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀 |
| D.Ag2C2O4+2C1-=2AgCl+C2O42-的平衡常数为109.04 |
您最近一年使用:0次
2020-05-27更新
|
509次组卷
|
9卷引用:【南昌新东方】2019 南昌二中 高二上 期末
2018·江西南昌·模拟预测
名校
6 . 下列说法正确的是( )
| A.铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| B.SO3与Ba(NO3)2溶液可得到BaSO4,SO2与Ba(NO3)2溶液可得到BaSO3 |
| C.将Fe(NO3)3样品溶于稀硫酸后,滴加KSCN溶液,变红,不能说明样品变质 |
| D.室温下,SiO2(s)+3C(s) ═ SiC(s)+2CO(g)不能自发进行,则该反应的ΔH<0 |
您最近一年使用:0次
7 . 已知常温下,Ksp(Ag2SO4)=2.0×10-5。取适量Ag2SO4溶于蒸馏水得到200 mL饱和溶液,在该饱和溶液中c(SO42-)=0.017 mol·L-1。向该饱和溶液中加入0.020 mol·L-1 Na2SO4溶液200 mL,得到溶液R。(不考虑混合后溶液体积的变化)下列说法正确的是
| A.R中c(Ag+)=2c(SO42-) |
| B.得到溶液R的过程中会产生沉淀 |
| C.R中c(Ag+)=0.017 mol·L-1 |
| D.加入Na2SO4溶液促进沉淀溶解平衡向左移动 |
您最近一年使用:0次
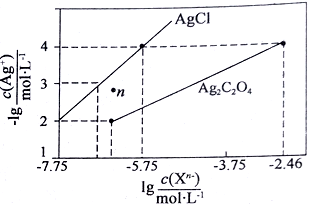
8 . 25℃时,在Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-1g(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。
下列说法正确的是 ( )

下列说法正确的是 ( )
| A.向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液 |
| B.b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1(mol/L)3 |
| C.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中:c(Fe2+):c(Cu2+)=1:104.6 |
| D.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO |
您最近一年使用:0次
2020-04-27更新
|
505次组卷
|
12卷引用:江西省上高县第二中学2018届高三第七次月考理科综合-化学试题
江西省上高县第二中学2018届高三第七次月考理科综合-化学试题黑龙江省哈尔滨市第六中学2017届高三下学期第三次模拟考试理科综合化学试题河南省南阳市第一中学2017-2018学年高二上学期第三次月考化学试题辽宁省大连市旅顺口区2020届高三上学期期中考试化学试题山东省实验中学2020届高三上学期第二次诊断考试化学试题山东省枣庄市2020届高三上学期期末考试化学试题河北省衡水市枣强中学2019-2020学年高二下学期第一次月考化学试题(已下线)考点13 沉淀溶解平衡-2020年高考化学命题预测与模拟试题分类精编河北省张家口宣化一中2021届高三上学期期末考试化学试题黑龙江省大庆铁人中学2021届高三下学期5月第三次模拟考试理综化学试题(已下线)模块十 水溶液中的离子平衡(模块检测)-2022年高考化学一轮复习小题多维练(全国通用)(已下线)课时45 难溶电解质的溶解平衡-2022年高考化学一轮复习小题多维练(全国通用)
9 . 在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )
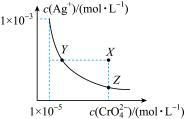

| A.t℃时,Ag2CrO4的Ksp为1×10-8 |
| B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 |
| C.t℃时,Y点和Z点时Ag2CrO4的Ksp相等 |
| D.t℃时,将0.01 mol·L-1AgNO3溶液滴入20 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液中,Cl-先沉淀 |
您最近一年使用:0次
2020-02-06更新
|
1705次组卷
|
29卷引用:江西省南昌市安义中学2019-2020学年高二上学期期中考试化学试题
江西省南昌市安义中学2019-2020学年高二上学期期中考试化学试题江西省上饶中学2019-2020学年高二上学期期中考试(特零班)化学试题(已下线)2014高考化学苏教版总复习 专题8溶液中的离子反应练习卷2015-2016学年广东汕头金山中学高二上12月月考化学卷2015-2016学年山东寿光现代中学高二上12月月考化学卷2017届辽宁省大连市第二十高级中学高三12月月考化学试卷2016-2017学年陕西西安一中高二上月考二化学卷吉林省吉化第一高级中学校2017-2018学年高二上学期期末考试化学试题广东省中山市2017-2018学年高二上学期期末考试化学试题新疆生产建设兵团第二中学2017-2018学年高二上学期第四次月考(期末)化学试题重庆市万州第二高级中学2018-2019学年高二上学期期中考试化学试题吉林省长春市实验中学2018-2019学年高二下学期期末考试化学试题新疆霍城县江苏中学2018-2019学年高二上学期期末考试化学试题新疆自治区生产建设兵团第二中学2018-2019学年高二第一次月考化学试题【全国百强校】甘肃省静宁县第一中学2019-2020学年高二上学期第二次考试化学试题甘肃省甘谷第一中学2019-2020学年高二上学期第二次月考化学试题云南省丽江市华坪县第一中学2019—2020学年高二上学期期末考试化学试题贵州省龙里中学2019-2020学年高二上学期期末考试化学试题山东省济南市章丘区第四中学2019-2020学年高二下学期第一次月考化学试题河北省衡水市枣强中学2019-2020学年高二下学期第一次月考化学试题黑龙江省哈尔滨师范大学青冈实验中学校2018-2019学年高二(实验班)12月月考化学试题山东省枣庄市滕州市第一中学2019-2020高二上学期期末考试化学试题重庆市缙云教育联盟2020-2021学年高二上学期10月月考化学试题河北省石家庄市辛集市第一中学2019-2020学年高二上学期第三次月考化学试题吉林省洮南市第一中学2020-2021学年高二上学期期中考试化学试题山东省济南市济阳区闻韶中学2020-2021学年高三(3班)12月第一次模拟考试化学试题四川省峨眉第二中学校2021-2022学年高二下学期5月月考化学试题宁夏石嘴山第三中学2021-2022学年高二下学期期末考试化学试题辽宁省重点高中沈阳市郊联体2022-2023学年高二上学期期末考试化学试题
10 . 已知在25 ℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36,常温时下列有关说法正确的是
| A.向H2S的饱和溶液中通入少量SO2气体,溶液的酸性增强 |
| B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L |
| C.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
| D.因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生 |
您最近一年使用:0次
2019-12-18更新
|
268次组卷
|
10卷引用:2015-2016学年江西省上高二中高二上12月月考化学试卷
2015-2016学年江西省上高二中高二上12月月考化学试卷(已下线)2011-2012学年辽宁省沈阳四校协作体高二上学期期中考试化学试卷(已下线)2011-2012学年山西省大同一中高二上学期期中考试化学试卷2015-2016学年内蒙古赤峰市宁城县高二上学期期末考试化学试卷2016-2017学年山西省怀仁一中高二上月考四化学卷宁夏育才中学孔德校区2017-2018学年高二12月月考化学试题【全国百强校】河南省南阳市第一中学2018-2019学年高二下学期第四次月考化学试题湖南省邵东县第一中学2019-2020学年高二上学期第三次月考化学试题内蒙古北京八中乌兰察布分校2019-2020学年高二下学期期末考试化学试题吉林省抚松县第一中学2021-2022学年高二上学期第三次月考化学试题



