1 . 工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)制备PbSO4晶体的工艺流程如图:

已知:PbCl2难溶于冷水,易溶于热水;PbCl2(s)+2Cl-(aq) PbCl
PbCl (aq) △H>0;Ksp(PbSO4)=1×10-8,Ksp(PbCl2)=1.6×10-5。下列说法错误的是
(aq) △H>0;Ksp(PbSO4)=1×10-8,Ksp(PbCl2)=1.6×10-5。下列说法错误的是

已知:PbCl2难溶于冷水,易溶于热水;PbCl2(s)+2Cl-(aq)
 PbCl
PbCl (aq) △H>0;Ksp(PbSO4)=1×10-8,Ksp(PbCl2)=1.6×10-5。下列说法错误的是
(aq) △H>0;Ksp(PbSO4)=1×10-8,Ksp(PbCl2)=1.6×10-5。下列说法错误的是| A.“浸取”时的主要离子反应为MnO2+PbS+4H++2Cl-=PbCl2 +S+Mn2++2H2O |
| B.“滤渣2”的主要成分是Fe(OH)3 |
C.“沉降”时加入冰水,PbCl2(s)+2Cl-(aq) PbCl PbCl (aq)平衡左移,有利于PbCl2沉淀更完全 (aq)平衡左移,有利于PbCl2沉淀更完全 |
D.“沉淀转化”过程达平衡时,溶液中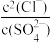 =1.6×103 =1.6×103 |
您最近一年使用:0次
2022-07-19更新
|
729次组卷
|
4卷引用:江西省九校2022-2023学年高二下学期开学联考化学试题
江西省九校2022-2023学年高二下学期开学联考化学试题河北省石家庄市第二中学教育集团2021-2022学年高二下学期期末考试化学试题(已下线)3.4.2 沉淀溶解平衡的应用-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)湖南省长沙麓山国际实验学校2023-2024学年高二下学期第一次学情检测化学试卷
解题方法
2 . 草酸亚铁晶体 FeC2O4·2H2O (其相对分子质量为180)可作为制备电池正极材料磷酸铁锂的原料。以FeSO4溶液制备电池级草酸亚铁晶体的实验流程如图:


(1)仪器A的名称是_______ 。
(2)“沉淀”步骤得到的混合体系不宜在空气中久置,其原因是(用化学方程式表示)_______ 。
(3)“洗涤”步骤的操作方法_______ 。
(4)测定草酸亚铁样品纯度的方法如下:准确称取0.2500g样品,加入适量稀硫酸溶解,用0.05000mol·L-1酸性KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液15.00mL。计算样品中FeC2O4·2H2O的纯度_______ (保留四位有效数字)
(5)实验中烘干后得到的草酸亚铁晶体FeC2O4·2H2O,称取5.40 g该样品在氩气气氛中进行热重法分析,得到剩余固体的质量随温度变化的曲线如图所示:

①上述FeC2O4·2H2O在氩气气氛进行热重法分析的原因是_______ 。
②分析图中数据,根据信息写出B对应的产物为_______ (填化学式)。
③600℃时剩余固体只有一种铁的氧化物, 且生成两种物质的量相等的气体。试写出B至C进程中所发生的化学反应方程式_______ 。


(1)仪器A的名称是
(2)“沉淀”步骤得到的混合体系不宜在空气中久置,其原因是(用化学方程式表示)
(3)“洗涤”步骤的操作方法
(4)测定草酸亚铁样品纯度的方法如下:准确称取0.2500g样品,加入适量稀硫酸溶解,用0.05000mol·L-1酸性KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液15.00mL。计算样品中FeC2O4·2H2O的纯度
(5)实验中烘干后得到的草酸亚铁晶体FeC2O4·2H2O,称取5.40 g该样品在氩气气氛中进行热重法分析,得到剩余固体的质量随温度变化的曲线如图所示:

①上述FeC2O4·2H2O在氩气气氛进行热重法分析的原因是
②分析图中数据,根据信息写出B对应的产物为
③600℃时剩余固体只有一种铁的氧化物, 且生成两种物质的量相等的气体。试写出B至C进程中所发生的化学反应方程式
您最近一年使用:0次
解题方法
3 . 湿法提银工艺中,浸出的Ag+需加入Cl-进行沉淀。Ag+与Cl-可结合生成多种络合物,在水溶液中存在如下平衡:AgCl43-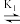 AgCl32-
AgCl32-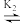 AgCl2-
AgCl2-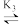 AgCl
AgCl Ag+。25℃时,平衡体系中含Ag微粒的分布系数δ随lgc(Cl-)的变化曲线如图所示。下列说法错误的是
Ag+。25℃时,平衡体系中含Ag微粒的分布系数δ随lgc(Cl-)的变化曲线如图所示。下列说法错误的是

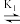 AgCl32-
AgCl32-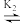 AgCl2-
AgCl2-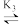 AgCl
AgCl Ag+。25℃时,平衡体系中含Ag微粒的分布系数δ随lgc(Cl-)的变化曲线如图所示。下列说法错误的是
Ag+。25℃时,平衡体系中含Ag微粒的分布系数δ随lgc(Cl-)的变化曲线如图所示。下列说法错误的是
| A.25℃时,Ksp(AgCl)=10-5.08 |
B.曲线c表示AgCl |
C.当c(Cl-)=10-2mol·L-1时,溶液中(AgCl )>c(Ag+)>c(AgCl )>c(Ag+)>c(AgCl ) ) |
| D.25℃时,平衡常数K2=10-0.2 |
您最近一年使用:0次
4 . 根据下列实验操作和现象,得到的结论错误的是
选项 | 实验操作和现象 | 结论 |
A | 向盛 溶液的试管中滴加 溶液的试管中滴加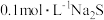 溶液至不再有白色沉淀产生,再向其中滴加 溶液至不再有白色沉淀产生,再向其中滴加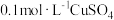 溶液,白色沉淀转化为黑色沉淀 溶液,白色沉淀转化为黑色沉淀 | 证明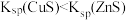 |
B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由CO 水解引起的 水解引起的 |
C | 向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至碱性,再滴加少量碘水,溶液未变蓝 | 淀粉完全水解 |
D | 压缩装有H2、I2(g)和HI混合气体(已平衡)的密闭容器,观察到气体颜色加深 | 无法证明平衡发生了移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
5 . 某温度下,向体积均为20.00mL、浓度均为0.1mol•L-1的NaCl溶液、Na2CrO4溶液中分别滴加0.1mol•L-1的AgNO3溶液,滴定过程中的pX(PX=-lgX,X=Cl-、CrO )与滴加AgNO3溶液体积的关系如图所示。下列说法正确的是
)与滴加AgNO3溶液体积的关系如图所示。下列说法正确的是

 )与滴加AgNO3溶液体积的关系如图所示。下列说法正确的是
)与滴加AgNO3溶液体积的关系如图所示。下列说法正确的是
| A.曲线II表示AgNO3溶液滴定NaCl溶液的过程 |
| B.Ksp(Ag2CrO4)=10-2b |
| C.其他条件不变,如果NaCl溶液浓度改为0.05mol•L-1,则滴定终点向上移动 |
| D.若a=5 b=4,则用AgNO3标准液滴定NaCl时可用K2CrO4溶液做指示剂 |
您最近一年使用:0次
2022-05-09更新
|
620次组卷
|
5卷引用:江西省南昌市第一中学2023-2024学年高二上学期11月期中考试化学试题
名校
6 . 一种从废旧锂电池(主要含 ,及少量Al、Cu中制备钴酸钾(
,及少量Al、Cu中制备钴酸钾( )的工艺流程如下;
)的工艺流程如下;
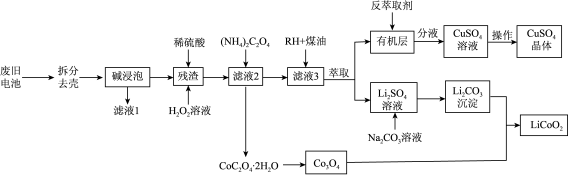
查阅资料: 具有很强的氧化性
具有很强的氧化性
(1)“碱浸泡”用来除去废旧电池中的Al,为提高该物质的去除率可采取的措施有___________ (任写一条)。
(2)向“残渣"中加入稀硫酸和 ,写出
,写出 参与反应的化学方程式
参与反应的化学方程式___________ 。
(3)向“滤液2”中加入沉淀剂时,若不采用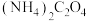 而采用
而采用 ,产物中会混有
,产物中会混有 ,试分析原因
,试分析原因___________ 。
(4)RH蒸取 的原理可表示为:
的原理可表示为: 。实验室进行萃取实验用到的玻璃仪器是
。实验室进行萃取实验用到的玻璃仪器是___________ ;向有机层中加入反萃取剂___________ (填化学式)可将 反萃取至水层。
反萃取至水层。
(5)某 样品中可能含有的杂质为
样品中可能含有的杂质为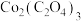 、
、 ,采用
,采用 滴定法测定该样品的组成,实验步骤如下:
滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取m g样品于锥形瓶中,加入稀 溶解,水浴加热至75℃,用c
溶解,水浴加热至75℃,用c  的
的 溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗
溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗 溶液
溶液 mL。
mL。
Ⅱ.向上述溶液中加入适量还原剂将 完全还原为
完全还原为 ,加入稀
,加入稀 后,在75℃继续用c
后,在75℃继续用c 
 溶液滴定至溶液出现粉红色且30s内不褪色,又消耗
溶液滴定至溶液出现粉红色且30s内不褪色,又消耗 溶液
溶液 mL。
mL。
样品中所含 (
( )的质量分数表达式为
)的质量分数表达式为___________ 。若盛装 溶液的滴定管没有润洗,则测得样品中Co元素含量
溶液的滴定管没有润洗,则测得样品中Co元素含量___________ 。(填“偏高”、“偏低”、“无影响”)
 ,及少量Al、Cu中制备钴酸钾(
,及少量Al、Cu中制备钴酸钾( )的工艺流程如下;
)的工艺流程如下;
查阅资料:
 具有很强的氧化性
具有很强的氧化性(1)“碱浸泡”用来除去废旧电池中的Al,为提高该物质的去除率可采取的措施有
(2)向“残渣"中加入稀硫酸和
 ,写出
,写出 参与反应的化学方程式
参与反应的化学方程式(3)向“滤液2”中加入沉淀剂时,若不采用
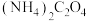 而采用
而采用 ,产物中会混有
,产物中会混有 ,试分析原因
,试分析原因(4)RH蒸取
 的原理可表示为:
的原理可表示为: 。实验室进行萃取实验用到的玻璃仪器是
。实验室进行萃取实验用到的玻璃仪器是 反萃取至水层。
反萃取至水层。(5)某
 样品中可能含有的杂质为
样品中可能含有的杂质为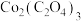 、
、 ,采用
,采用 滴定法测定该样品的组成,实验步骤如下:
滴定法测定该样品的组成,实验步骤如下:Ⅰ.取m g样品于锥形瓶中,加入稀
 溶解,水浴加热至75℃,用c
溶解,水浴加热至75℃,用c  的
的 溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗
溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗 溶液
溶液 mL。
mL。Ⅱ.向上述溶液中加入适量还原剂将
 完全还原为
完全还原为 ,加入稀
,加入稀 后,在75℃继续用c
后,在75℃继续用c 
 溶液滴定至溶液出现粉红色且30s内不褪色,又消耗
溶液滴定至溶液出现粉红色且30s内不褪色,又消耗 溶液
溶液 mL。
mL。样品中所含
 (
( )的质量分数表达式为
)的质量分数表达式为 溶液的滴定管没有润洗,则测得样品中Co元素含量
溶液的滴定管没有润洗,则测得样品中Co元素含量
您最近一年使用:0次
名校
解题方法
7 . 铊(Tl)在工业中的用途非常广泛,其中铊锡合金可作超导材料:铊镉合金是原子能工业中的重要材料。铊主要从铅精矿焙烧产生的富铊灰(主要成分PbO、ZnO、Fe2O3、 FeO、Tl2O等)中提炼,具体工艺流程如图。
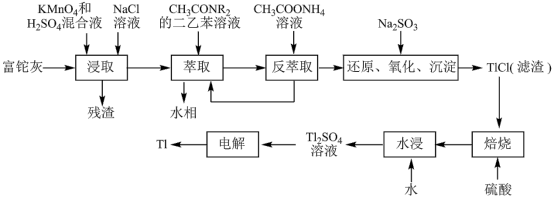
已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl
 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。
回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为_______ 。
(2)在实验室中,“萃取”过程使用的玻璃仪器有_______ ,用平衡移动解释“反萃取”过程的原理和目的_______ 。
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为_______ ,为提高经济效益充分利用原料,该反应的滤液可加入_______ 步骤循环使用最合适。
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:_______ 。
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为_______ 。


已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl

 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为
(2)在实验室中,“萃取”过程使用的玻璃仪器有
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为

您最近一年使用:0次
2022-04-10更新
|
765次组卷
|
2卷引用:江西省八所重点中学2022届高三联考理科综合化学试题
8 . 氨是重要的基础化工原料,工业上常用于制备氨水、亚硝酸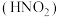 、连二次硝酸
、连二次硝酸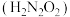 、尿素
、尿素 等多种含氮的化工产品。
等多种含氮的化工产品。
(1)已知: 时,连二次硝酸
时,连二次硝酸 的电离常数为
的电离常数为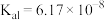 、
、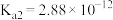 ;往
;往 溶液中滴加氢氧化钠溶液至
溶液中滴加氢氧化钠溶液至 ,
, 、
、 、离子浓度由大到小的顺序为
、离子浓度由大到小的顺序为___________ 。
(2)常温下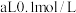 的
的 和
和 的
的 混合,混合后溶液呈中性,
混合,混合后溶液呈中性, 的电离常数为
的电离常数为___________ (用含a、b的式子表示)
(3)向浓度均为 的
的 和
和 混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中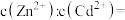
___________ 。[已知: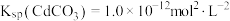 ,
,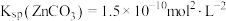 ]
]
可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为 ,沸点高难挥发)有一定关系。
,沸点高难挥发)有一定关系。
(4)羟基磷灰石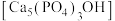 是牙釉质的主要成分,在唾液中存在平衡:
是牙釉质的主要成分,在唾液中存在平衡: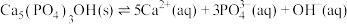 。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:
。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:___________
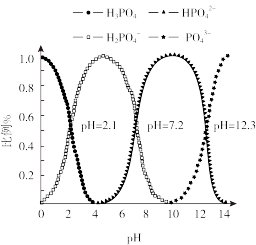
(5)常温下,向磷酸溶液中滴加 溶液,含磷微粒的分布比例与
溶液,含磷微粒的分布比例与 的关系如图所示。
的关系如图所示。 溶液显酸性,下列有关分析正确的是___________。
溶液显酸性,下列有关分析正确的是___________。
(6)联氨(又称联肼, 无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为:
无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为:____________ 平衡常数值为___________ (已知: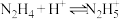 的
的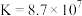 ;
;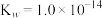 )。
)。
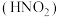 、连二次硝酸
、连二次硝酸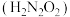 、尿素
、尿素 等多种含氮的化工产品。
等多种含氮的化工产品。(1)已知:
 时,连二次硝酸
时,连二次硝酸 的电离常数为
的电离常数为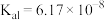 、
、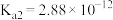 ;往
;往 溶液中滴加氢氧化钠溶液至
溶液中滴加氢氧化钠溶液至 ,
, 、
、 、离子浓度由大到小的顺序为
、离子浓度由大到小的顺序为(2)常温下
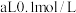 的
的 和
和 的
的 混合,混合后溶液呈中性,
混合,混合后溶液呈中性, 的电离常数为
的电离常数为(3)向浓度均为
 的
的 和
和 混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滴加碳酸铵溶液,当加入碳酸铵溶液至生成两种沉淀,则溶液中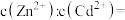
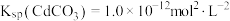 ,
,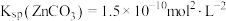 ]
]可乐中的食品添加剂有白砂糖、二氧化碳、焦糖色、磷酸、咖啡因等。可乐的辛辣味与磷酸(化学式为
 ,沸点高难挥发)有一定关系。
,沸点高难挥发)有一定关系。(4)羟基磷灰石
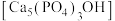 是牙釉质的主要成分,在唾液中存在平衡:
是牙釉质的主要成分,在唾液中存在平衡: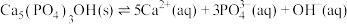 。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:
。长期过量饮用可乐会破坏牙釉质,造成龋齿。结合平衡移动原理解释原因:(5)常温下,向磷酸溶液中滴加
 溶液,含磷微粒的分布比例与
溶液,含磷微粒的分布比例与 的关系如图所示。
的关系如图所示。 溶液显酸性,下列有关分析正确的是___________。
溶液显酸性,下列有关分析正确的是___________。
A.溶液中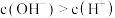 |
B. 的电离程度大于其水解程度 的电离程度大于其水解程度 |
C. c(Na+)+ c(H+)=c(H2PO )+2c(HPO )+2c(HPO )+3c(PO )+3c(PO )+c(OH—) )+c(OH—) |
| D.溶液中水的电离程度比纯水大 |
(6)联氨(又称联肼,
 无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为:
无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离的方程式为: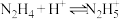 的
的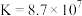 ;
;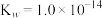 )。
)。
您最近一年使用:0次
解题方法
9 . 钨有“烈火金刚”的美称,以其高熔点、高比重、高硬度的特点,广泛应用于机械加工、冶金、采矿行业、电光源、建筑工业、兵器工业、航天航空等领域,是一种重要的战略资源,可以说没有钨就没有发达的现代工业。含钨的矿物有黑钨矿和白钨矿,白钨矿主要含CaWO4、Fe2O3、SiO2等,从白钨矿提取钨的工艺流程如下图所示。
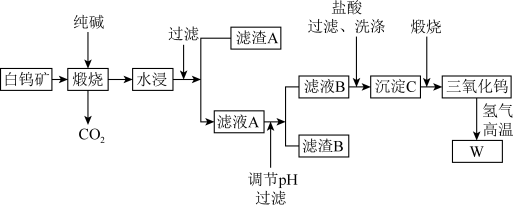
(1)写出CaWO4在煅烧时生成Na2WO4发生反应的化学方程式:_______ 。
(2)在“水浸”时,为加快浸出速率,写出一种可以采取的措施:_______ 。
(3)写出滤渣A的一种用途_______ 。
(4)调节pH的目的:_______ 。
(5)洗涤沉淀C的操作为:_______ 。
(6)为了获取高纯度的金属钨,不宜用碳而必须用氢气做还原剂的原因除了碳和金属钨在高温下会反应生成碳化钨,还存在的原因有_______ (写出一种合理的原因即可)。
(7)钨酸的酸性很弱,难溶于水,写出往滤液B中加入盐酸所发生的反应离子方程式:_______ 。

(1)写出CaWO4在煅烧时生成Na2WO4发生反应的化学方程式:
(2)在“水浸”时,为加快浸出速率,写出一种可以采取的措施:
(3)写出滤渣A的一种用途
(4)调节pH的目的:
(5)洗涤沉淀C的操作为:
(6)为了获取高纯度的金属钨,不宜用碳而必须用氢气做还原剂的原因除了碳和金属钨在高温下会反应生成碳化钨,还存在的原因有
(7)钨酸的酸性很弱,难溶于水,写出往滤液B中加入盐酸所发生的反应离子方程式:
您最近一年使用:0次
名校
解题方法
10 . 下列实验操作、现象和结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 两块相同的未经打磨的铝片,相同温度下分别投入5.0mL等浓度的 溶液和 溶液和 溶液中 溶液中 | 前者无明显现象,后者剧烈反应 |  能加速破坏铝片表面的氧化膜 能加速破坏铝片表面的氧化膜 |
| B | 向 溶液中加入足量NaCl后再加入少量NaI溶液 溶液中加入足量NaCl后再加入少量NaI溶液 | 白色沉淀转化为淡黄色沉淀 | 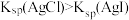 |
| C | 取少量溶液于试管中,先加入KSCN溶液,再滴加过量酸性高锰酸钾溶液 | 溶液变红色 | 溶液中含Fe2+ |
| D | 向铜与浓硫酸反应后的溶液中加入适量水稀释 | 溶液呈蓝色 | 溶液中存在 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-01-21更新
|
895次组卷
|
2卷引用:江西省宜春市丰城市2022-2023学年高二上学期期中考试化学试题



