1 . 常温下,用 溶液分别滴定浓度均为
溶液分别滴定浓度均为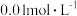 的
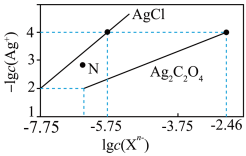
的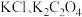 溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O
溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O 的水解)。其中Xn-表示
的水解)。其中Xn-表示 或
或 ,下列叙述错误的是
,下列叙述错误的是
 溶液分别滴定浓度均为
溶液分别滴定浓度均为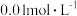 的
的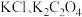 溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O
溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O 的水解)。其中Xn-表示
的水解)。其中Xn-表示 或
或 ,下列叙述错误的是
,下列叙述错误的是 
A.Ksp(Ag2C2O4)的数量级为 |
B. 点表示 点表示 的过饱和溶液 的过饱和溶液 |
C.向c(Cl-)=c(C2O )的混合溶液中滴入 )的混合溶液中滴入 溶液时,先生成 溶液时,先生成 沉淀 沉淀 |
D.常温下,Ag2C2O4(s)+2Cl-(aq) 2AgCl(s)+C2O 2AgCl(s)+C2O 的平衡常数为108.04 的平衡常数为108.04 |
您最近一年使用:0次
2 . 为研究沉淀的生成及转化,进行如下实验。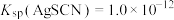
下列关于该实验的分析不正确 的是
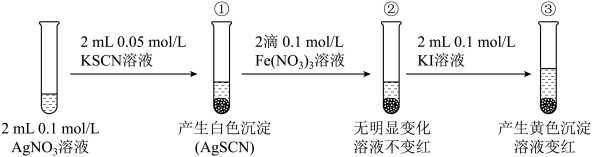
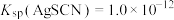
下列关于该实验的分析
A.①中产生白色沉淀的原因是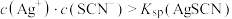 |
B.充分反应后①中 浓度为 浓度为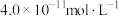 |
C.③中产生黄色沉淀可证明 向 向 沉淀转化 沉淀转化 |
D.②中加入KI溶液后一定发生了反应 |
您最近一年使用:0次
2024-01-01更新
|
303次组卷
|
8卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期1月月考化学试题
江西省宜春市宜丰中学2023-2024学年高三上学期1月月考化学试题江西省宜春市丰城市东煌学校2023-2024学年高二上学期1月期末化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题四川省成都市第七中学2023-2024学年高一上学期12月月考化学试题北京师范大学附属实验中学2023-2024学年高二上学期期中考试化学试题(已下线)专题06 沉淀溶解平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)辽宁省大连市第十二中学2023-2024学年高二上学期12月学情反馈化学试题(已下线)专题07 水溶液中的离子反应与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
名校
解题方法
3 . MnO2是重要化工原料,由软锰矿制备MnO2的一种工艺流程如下:

资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH:
③该工艺条件下,MnO2与H2SO4不反应。
(1)溶出
①溶出前,软锰矿需研磨,目的是___________ 。
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:
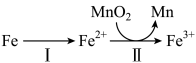
i.II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是___________ 。
ii.若I中Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是___________ 。
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2后加入NH3·H2O,调溶液pH,说明试剂加入顺序及调节pH的原因:___________ 。
(3)电解
Mn2+纯化液经电解得MnO2,生成1molMnO2电子转移的数目为___________ 。
(4)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,如热至充分反应,生成CO2,再滴加cmol/L KMnO4溶液至剩余Na2C2O4恰好完全反应,消耗KMnO4溶液的体积为dL,产品纯度为___________ (用质量分数表示)。[已知:MnO2及 均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]

资料:
①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。
②金属离子沉淀的pH:
| Fe3+ | A13+ | Mn2+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.4 | 5.8 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 7.8 | 8.3 |
(1)溶出
①溶出前,软锰矿需研磨,目的是
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:

i.II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是
ii.若I中Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2,而实际比值(0.9)小于2,原因是
(2)纯化
已知:MnO2的氧化性与溶液pH有关。纯化时先加入MnO2后加入NH3·H2O,调溶液pH,说明试剂加入顺序及调节pH的原因:
(3)电解
Mn2+纯化液经电解得MnO2,生成1molMnO2电子转移的数目为
(4)产品纯度测定
向ag产品中依次加入足量bgNa2C2O4和足量稀H2SO4,如热至充分反应,生成CO2,再滴加cmol/L KMnO4溶液至剩余Na2C2O4恰好完全反应,消耗KMnO4溶液的体积为dL,产品纯度为
 均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
均被还原为Mn2+,M(MnO2)=86.94g/mol、M(Na2C2O4)=134.0g/mo]
您最近一年使用:0次
2023-12-15更新
|
183次组卷
|
3卷引用:江西省上饶市广丰一中2023-2024学年高二上学期12月考试化学试卷
名校
解题方法
4 . 工业生产中利用方铅矿(主要成分为PbS,含有 等杂质)制备
等杂质)制备 晶体的工艺流程如图所示。下列说法错误的是
晶体的工艺流程如图所示。下列说法错误的是 难溶于冷水,易溶于热水。
难溶于冷水,易溶于热水。
②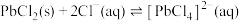
 。
。
③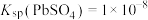 ,
,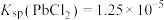 。
。
 等杂质)制备
等杂质)制备 晶体的工艺流程如图所示。下列说法错误的是
晶体的工艺流程如图所示。下列说法错误的是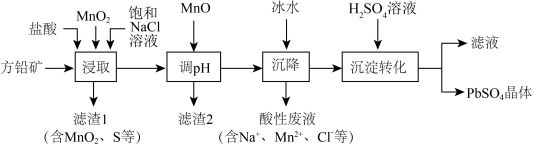
 难溶于冷水,易溶于热水。
难溶于冷水,易溶于热水。②
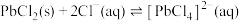
 。
。③
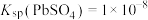 ,
,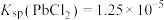 。
。A.“浸取”时加入NaCl的目的是增大 浓度,便于铅元素进入溶液 浓度,便于铅元素进入溶液 |
B.“调pH”时加入MnO,是使平衡 正向移动,除去 正向移动,除去 |
C.“沉降”时加入冰水可使平衡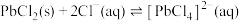 逆向移动 逆向移动 |
D. 经“沉淀转化”后得到 经“沉淀转化”后得到 ,若用 ,若用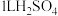 溶液转化 溶液转化 沉淀(忽略溶液体积变化),则 沉淀(忽略溶液体积变化),则 溶液的起始物质的量浓度不得低于 溶液的起始物质的量浓度不得低于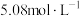 |
您最近一年使用:0次
2023-11-26更新
|
394次组卷
|
4卷引用:2024届江西省吉安市第一中学高三下学期三模化学试题
名校
解题方法
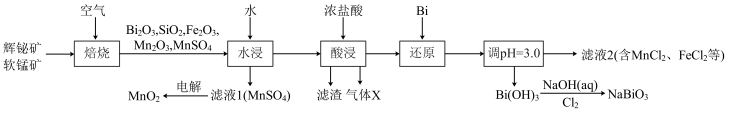
5 . 铋酸钠( )是常用的氧化剂,
)是常用的氧化剂, 是活性电极。以辉铋矿(主要成分为
是活性电极。以辉铋矿(主要成分为 ,含
,含 、
、 杂质)和软锰矿(主要成分是
杂质)和软锰矿(主要成分是 )为原料联合焙烧制备
)为原料联合焙烧制备 和
和 ,流程如下:
,流程如下:
已知:①金属活动性: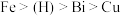 。
。
②几种金属离子的氢氧化物沉淀pH如下:
回答下列问题:
(1) 中Bi的化合价为
中Bi的化合价为___________ 。气体X是___________ (填化学式)。
(2)“焙烧”中 和
和 与空气反应生成
与空气反应生成 和
和 ,写出其反应的化学方程式:
,写出其反应的化学方程式:___________ 。被还原的元素是___________ (填元素符号)。
(3)“还原”中Bi的作用是___________ 。
(4)检验滤液2中是否有 的试剂是
的试剂是___________ (填化学式)。
(5)已知 难溶于水,
难溶于水, 难溶于冷水,写出常温下利用
难溶于冷水,写出常温下利用 制备
制备 的离子方程式:
的离子方程式:___________ 。
(6)为探究 和
和 的氧化性相对强弱,设计如下实验:
的氧化性相对强弱,设计如下实验:

实验中观察到试管B中溶液变蓝色。
由上述实验现象可知,氧化性:
___________  (填“>”或“<”)。与根据第(5)小题得出的
(填“>”或“<”)。与根据第(5)小题得出的 与
与 氧化性强弱关系相反,其主要原因是
氧化性强弱关系相反,其主要原因是___________ 。
 )是常用的氧化剂,
)是常用的氧化剂, 是活性电极。以辉铋矿(主要成分为
是活性电极。以辉铋矿(主要成分为 ,含
,含 、
、 杂质)和软锰矿(主要成分是
杂质)和软锰矿(主要成分是 )为原料联合焙烧制备
)为原料联合焙烧制备 和
和 ,流程如下:
,流程如下:
已知:①金属活动性:
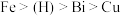 。
。②几种金属离子的氢氧化物沉淀pH如下:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
 | 1.5 | 2.8 |
 | 6.3 | 8.3 |
 | 8.1 | 10.1 |
(1)
 中Bi的化合价为
中Bi的化合价为(2)“焙烧”中
 和
和 与空气反应生成
与空气反应生成 和
和 ,写出其反应的化学方程式:
,写出其反应的化学方程式:(3)“还原”中Bi的作用是
(4)检验滤液2中是否有
 的试剂是
的试剂是(5)已知
 难溶于水,
难溶于水, 难溶于冷水,写出常温下利用
难溶于冷水,写出常温下利用 制备
制备 的离子方程式:
的离子方程式:(6)为探究
 和
和 的氧化性相对强弱,设计如下实验:
的氧化性相对强弱,设计如下实验:
实验中观察到试管B中溶液变蓝色。
由上述实验现象可知,氧化性:

 (填“>”或“<”)。与根据第(5)小题得出的
(填“>”或“<”)。与根据第(5)小题得出的 与
与 氧化性强弱关系相反,其主要原因是
氧化性强弱关系相反,其主要原因是
您最近一年使用:0次
2023-10-19更新
|
198次组卷
|
2卷引用:江西省大余中学2023-2024学年高三上学期10月月考化学试题
名校
6 . 锂离子电池的应用很广泛,某种锂电池的正极材料为钴酸锂,该材料可以由海水(含较大浓度的LiCI及少量MgCl2、CaCl2、MnCl2等)为原料制备,其工艺流程如图所示:
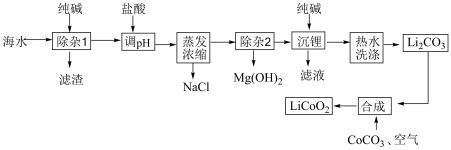
已知:①在常温下几种难溶物质的溶度积常数如表
②Li2CO3微溶于热水,可溶于冷水。回答下列问题:
(1)“除杂1”步骤中除去的杂质离子为Mg2+和_____ 。
(2)“调pH”的目的是_____ 。
(3)金属镁可以通过电解熔融MgC12得到,写出由Mg(OH)2沉淀制MgCl2固体的具体操作_____ 。
(4)20℃时碳酸锂在水中的溶解度为1.295g,饱和溶液密度为1.0148g/cm3,其中Li2CO3的物质的量浓度为_____ 。(结果保留2位有效数字)
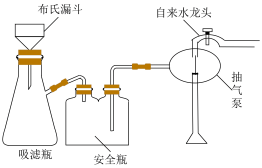
(5)“热水洗涤”的目的是_____ 。在实验室里洗涤Li2CO3时会采用如图所示装置,该装置较于普通过滤装置的优点为_____ 。
(6)“合成”工序需要高温条件,并放出能使澄清石灰水变浑浊的气体,写出该反应的化学方程式_____ 。

已知:①在常温下几种难溶物质的溶度积常数如表
| 物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
| K | 2.5×10-2 | 6.8×10-6 | 3.4×10-9 | 2.3×10-11 | 5.6×10-12 |
(1)“除杂1”步骤中除去的杂质离子为Mg2+和
(2)“调pH”的目的是
(3)金属镁可以通过电解熔融MgC12得到,写出由Mg(OH)2沉淀制MgCl2固体的具体操作
(4)20℃时碳酸锂在水中的溶解度为1.295g,饱和溶液密度为1.0148g/cm3,其中Li2CO3的物质的量浓度为
(5)“热水洗涤”的目的是

(6)“合成”工序需要高温条件,并放出能使澄清石灰水变浑浊的气体,写出该反应的化学方程式
您最近一年使用:0次
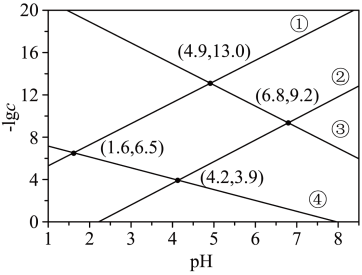
7 . 某废水处理过程中始终保持 饱和,即
饱和,即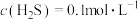 ,通过调节pH使
,通过调节pH使 和
和 形成硫化物而分离,体系中pH与
形成硫化物而分离,体系中pH与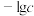 关系如图所示,c为
关系如图所示,c为 、
、 、
、 和
和 的浓度,单位为
的浓度,单位为 。已知
。已知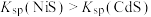 ,下列说法正确的是
,下列说法正确的是
 饱和,即
饱和,即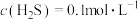 ,通过调节pH使
,通过调节pH使 和
和 形成硫化物而分离,体系中pH与
形成硫化物而分离,体系中pH与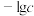 关系如图所示,c为
关系如图所示,c为 、
、 、
、 和
和 的浓度,单位为
的浓度,单位为 。已知
。已知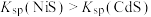 ,下列说法正确的是
,下列说法正确的是
A.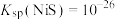 |
B.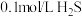 的单一溶液中粒子浓度大小关系为 的单一溶液中粒子浓度大小关系为 |
C.④为pH与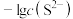 的关系曲线 的关系曲线 |
D.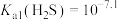 |
您最近一年使用:0次
2023-08-28更新
|
444次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
8 . 利用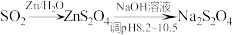 转化制取连二亚硫酸钠(
转化制取连二亚硫酸钠( )的装置如图。下列说法不正确的是
)的装置如图。下列说法不正确的是
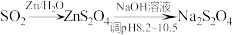 转化制取连二亚硫酸钠(
转化制取连二亚硫酸钠( )的装置如图。下列说法不正确的是
)的装置如图。下列说法不正确的是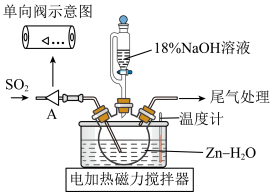
| A.单向阀的作用是防倒吸 |
B.先通入 至悬浊液变澄清,再打开滴液漏斗旋塞 至悬浊液变澄清,再打开滴液漏斗旋塞 |
C.NaOH溶液不宜加入过多的原因是防止 水解 水解 |
| D.上述反应液经过滤,在冷却搅拌下加入一定量NaCl的作用是提高产率 |
您最近一年使用:0次
2023-08-14更新
|
832次组卷
|
4卷引用:江西省赣州地区2023-2024学年十大教学能手选拔赛高中化学试题
名校
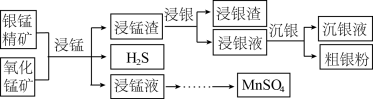
9 . 以银锰精矿(主要含 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下:
)为原料联合提取银和锰的一种流程示意图如下:
已知:Ⅰ.酸性条件下, 的氧化性强于
的氧化性强于 ;
;
Ⅱ.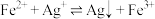 。
。
(1)“浸锰”过程是在 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。
①写出Mn元素基态原子的价层电子排布式:________ 。
②“浸锰”过程中,发生反应: ,则可推断:
,则可推断: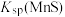
________ (填“>”或“<”)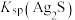 。
。
③在 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有________ 。
(2)“浸银”时,使用过量 、HCl和
、HCl和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 形式浸出。
形式浸出。
①将“浸银”反应的离子方程式补充完整:_____ 。
________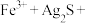 ________
________ ________
________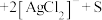
②结合平衡移动原理,解释浸出剂中 、
、 的作用:
的作用:________ 。
(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有 和
和________ 。
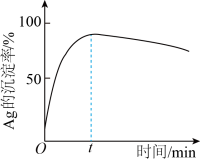
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:________ 。
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析这种联合提取银和锰方法的优势:________ 。
 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下:
)为原料联合提取银和锰的一种流程示意图如下:
已知:Ⅰ.酸性条件下,
 的氧化性强于
的氧化性强于 ;
;Ⅱ.
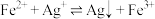 。
。(1)“浸锰”过程是在
 溶液中使矿石中的锰元素浸出,同时去除
溶液中使矿石中的锰元素浸出,同时去除 ,有利于后续银的浸出,矿石中的银以
,有利于后续银的浸出,矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。①写出Mn元素基态原子的价层电子排布式:
②“浸锰”过程中,发生反应:
 ,则可推断:
,则可推断: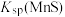
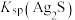 。
。③在
 溶液中,银锰精矿中的
溶液中,银锰精矿中的 和氧化锰矿中的
和氧化锰矿中的 发生反应,则浸锰液中主要的金属阳离子有
发生反应,则浸锰液中主要的金属阳离子有(2)“浸银”时,使用过量
 、HCl和
、HCl和 的混合液作为浸出剂,将
的混合液作为浸出剂,将 中的银以
中的银以 形式浸出。
形式浸出。①将“浸银”反应的离子方程式补充完整:
________
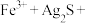 ________
________ ________
________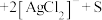
②结合平衡移动原理,解释浸出剂中
 、
、 的作用:
的作用:(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有
 和
和②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:

(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析这种联合提取银和锰方法的优势:
您最近一年使用:0次
2023-07-19更新
|
605次组卷
|
2卷引用:江西省宜春市宜丰中学2023-2024学年高三上学期12月月考化学试题
10 . 下图为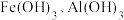 和
和 在水中达沉淀溶解平衡时的
在水中达沉淀溶解平衡时的 关系图(
关系图( ;
; 可认为
可认为 离子沉淀完全)。下列叙述正确的是
离子沉淀完全)。下列叙述正确的是
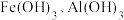 和
和 在水中达沉淀溶解平衡时的
在水中达沉淀溶解平衡时的 关系图(
关系图( ;
; 可认为
可认为 离子沉淀完全)。下列叙述正确的是
离子沉淀完全)。下列叙述正确的是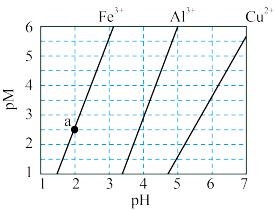
A.由 点可求得 点可求得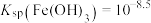 |
B. 时 时 的溶解度为 的溶解度为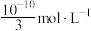 |
C.浓度均为 的 的 和 和 可通过分步沉淀进行分离 可通过分步沉淀进行分离 |
D.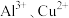 混合溶液中 混合溶液中 时二者不会同时沉淀 时二者不会同时沉淀 |
您最近一年使用:0次
2023-06-09更新
|
16974次组卷
|
33卷引用:江西省南昌市第十九中学2023-2024学年高三上学期11月期中考试化学试卷
江西省南昌市第十九中学2023-2024学年高三上学期11月期中考试化学试卷 2023年高考全国甲卷化学真题(已下线)T13-溶液中的离子平衡(已下线)T13-溶液中的离子平衡(已下线)2023年高考化学真题完全解读(全国甲卷)(ppt+word)(已下线)专题16 水溶液中的离子平衡(已下线)2023年高考山东卷化学真题变式题(不定项选择题)(已下线)专题16 水溶液中的离子平衡(已下线)专题16 水溶液中的离子平衡(已下线)第15练 水溶液中的离子平衡图像分析 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)湖南省长沙市长郡中学2022-2023学年高二下学期期末考试化学试题(已下线)考点29 沉淀溶解平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)海南省海南中学2023-2024学年高三上学期第0次月考化学试题河南省南阳市第一中学校2023-2024学年高三上学期开学考试化学试题四川省遂宁市第二中学校2023-2024学年高三上学期第一次诊断性考试理综试题(已下线)第32讲难溶电解质的溶解平衡(已下线)考点4 沉淀溶解平衡 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)第6讲 沉淀溶解平衡图像分析福建泉州培元中学2023-2024学年上学期高三10月月考化学试题(已下线)选择题11-16福建省福州第四中学2023-2024学年高三上学期期中考试化学试题(已下线)题型03 电解质溶液图像分析-2024年高考化学答题技巧与模板构建(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)安徽省淮北市2023-2024学年高三上学期1月调研化学试题(已下线)选择题11-15河南省南阳市第一中学校2023-2024学年高二上学期12月月考化学试题(已下线)题型14 电解质溶液-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)题型15 沉淀溶解平衡及图像分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)题型18 化学反应原理综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)天津市耀华中学2023-2024学年高二上学期1月期末化学试题天津市耀华中学2023-2024学年高二上学期期末学情调研化学试卷山西省运城市河津中学2023-2024学年高二下学期开学考试化学试题



