1 . 某温度下,难溶物FeR的水溶液中存在平衡 FeR(s)⇌Fe2+(aq)+R2-(aq),其沉淀溶解平衡曲线如图所示。下列说法正确的是
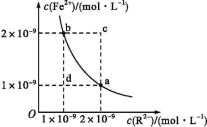

| A.可以仅通过升温实现由d点变到a点 |
| B.c点没有沉淀生成 |
| C.a点对应的 Ksp等于b点对应的Ksp |
| D.该温度下,Ksp=4.0×10-18 |
您最近一年使用:0次
2021-01-14更新
|
311次组卷
|
4卷引用:江西省上饶市横峰中学2020-2021学年高二下学期入学考试(统招班)化学试题
名校
2 . 牙齿的表面有一薄层釉质保护着,釉质层的主要成分是难溶的羟基磷灰石[Ca5(PO4)3OH]。下列行为不利于牙齿保护的是
| A.坚持饭后漱口 | B.在牙膏中添加氟化物 |
| C.大量饮用可乐等碳酸饮料 | D.早晚按时刷牙 |
您最近一年使用:0次
2021-01-14更新
|
222次组卷
|
4卷引用:江西省上饶市横峰中学2020-2021学年高二下学期入学考试(统招班)化学试题
名校
解题方法
3 . 下列实验中的颜色变化,与氧化还原反应无关的是( )
| 选项 | 实验操作 | 现象 |
| A | AgNO3溶液滴入氯水中 | 产生白色沉淀,随后淡黄绿色逐渐褪去 |
| B | FeCl3溶液滴入Mg(OH)2浊液中 | 白色浑浊转化为红褐色沉淀 |
| C | H2C2O4溶液滴入KMnO4酸性溶液中 | 产生气泡,随后紫色褪去 |
| D | Na块放在坩埚里并加热 | 发出黄色火焰,生成淡黄色固体 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-07-09更新
|
246次组卷
|
4卷引用:江西省宁冈中学2021-2022学年高三上学期9月份开学考化学试题
名校
4 . 某温度下,向10 mL 0.1 mol·L-lNaCl溶液和10 mL 0.1 mol·L-lK2CrO4溶液中分别滴加0.1 mol·L-lAgNO3溶液。滴加过程中pM[-lgc(Cl-)或-lgc(CrO42-)]与所加AgNO3溶液体积之间的关系如下图所示。已知Ag2CrO4为红棕色沉淀。下列说法错误的是


| A.该温度下,Ksp(Ag2CrO4)=4×10-12 |
| B.al、b、c三点所示溶液中c(Ag+):al>b>c |
| C.若将上述NaCl溶液浓度改为0.2mol·L-1,则a1点会平移至a2点 |
| D.用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂 |
您最近一年使用:0次
2019-05-28更新
|
2767次组卷
|
8卷引用:江西省宜春市铜鼓中学2021-2022学年高二下学期开学考化学试题
名校
5 . 下列实验中,对应的现象以及解释或结论都正确且具有因果关系的是:
| 选项 | 操作 | 现象 | 解释或结论 |
| A | 测定等浓度的Na2SO3和NaHSO3溶液的pH | Na2SO3溶液的pH较大 | HSO3-结合H+的能力比SO32-的强 |
| B | 向盛有2ml 0.1mol/L AgNO3溶液的试管中滴加一定量0.1mol/L NaCl溶液,再向其中滴加一定量 0.1mol/L KI溶液 | 先有白色沉淀生成,后又产生黄色沉淀 | Ksp(AgCl)> Ksp(AgI) |
| C | 室温下,取相同大小、形状和质量的Zn粒分别投入0.1mol/L的盐酸和1.0mol/L的盐酸中 | Zn粒与1.0mol/L的反应更剧烈 | 探究浓度对化学反应速率的影响 |
| D | 用石墨做电极电解Mg(NO3)2、Cu(NO3)2的混合溶液 | 阴极上先析出铜 | 金属活动性:Cu> Mg |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-01-27更新
|
204次组卷
|
4卷引用:江西省赣州市崇义县崇义中学2020-2021学年高二下学期开学考化学试题
6 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 溴乙烷与氢氧化钠乙醇溶液共热,生成气体通入酸性高锰酸钾溶液中,褪色 | 有乙烯生成 |
| B | 向试管中的浓硫酸加入铜片,盖好胶塞,导管通气入品红溶液,无明显现象 | 铜片未打磨 |
| C | 除去CuSO4溶液中Fe2+:先加足量H2O2,再加Cu(OH)2调溶液pH=4 | Ksp[Cu(OH)2]>Ksp[Fe(OH)2] |
| D | 将有色纸条放入盛满干燥氯气的集气瓶中,盖上玻璃片,无明显现象 | 氯气漂白不是Cl2分子直接作用的结果 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-05-30更新
|
634次组卷
|
3卷引用:【全国校级联考】江西省宜春市五校联考2019届高三上学期开学考试化学试题
7 . 下列说法正确的是
| A.在一定温度下的饱和AgCl水溶液中,Ag+与Cl-的浓度乘积是一个常数 |
| B.已知AgCl的Ksp=1.8×10-10,则在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-),且Ag+与Cl-浓度的乘积等于1.8×10-10mol2·L-2 |
| C.Ksp数值越大的难溶电解质在水中的溶解能力越强 |
| D.难溶电解质的溶解度很小,故外界条件改变,对它的溶解度没有影响 |
您最近一年使用:0次
名校
8 . 某温度下,向10mL 0.1mol/LCuSO4溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中−lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是

[已知:lg2=0.3,Ksp(ZnS)=3×10-25]

[已知:lg2=0.3,Ksp(ZnS)=3×10-25]
A.Na2S溶液呈碱性,是因为S2-离子发生了水解,用离子方程式可表示为:S2-+2H2O H2S+2OH- H2S+2OH- |
| B.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) |
| C.向100mL Zn2+、Cu2+浓度均为10-5mol·L-1的混合溶液中逐滴加入10-4mol·L-1的Na2S溶液,Zn2+先沉淀 |
| D.该温度下Ksp(CuS)=4×10-36 |
您最近一年使用:0次
2018-01-26更新
|
455次组卷
|
2卷引用:江西省井冈山市宁冈中学2021-2022学年高三下学期开学考试化学试题
9 . 软锰矿的主要成分为MnO2,含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。
已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是_________________ (任写一种)。①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式______________________ 。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是_________ 。
(3)步骤③中MnO2的其作用是__________________ ,另外一种物质X可以是__________ 。
A.ZnO B.MgCO3 C.MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式__________ 。
(5)已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,向NaCN溶液中通入少量的H2S气体,反应的离子方程式为__________________ 。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L―1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10―4 mol·L―1时,Mn2+开始沉淀,则a=______ 。[已知:Ksp(MnS)=1.4×10―15]

已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是
(3)步骤③中MnO2的其作用是
A.ZnO B.MgCO3 C.MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式
(5)已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,向NaCN溶液中通入少量的H2S气体,反应的离子方程式为
您最近一年使用:0次
2017-02-26更新
|
306次组卷
|
2卷引用:2017届江西省新余市第四中学、宜春中学高三下学期开学联考理科综合化学试卷



