解题方法
1 . 某小组同学探究盐对Fe3+ +3SCN- Fe(SCN)3平衡体系的影响。
Fe(SCN)3平衡体系的影响。
实验I:探究KCl对Fe3+和SCN-平衡体系的影响
将已用稀盐酸酸化的0.005 mol·L-1 FeCl3溶液和0.01 mol·L-1 KSCN溶液等体积混合,静置至体系平衡,得红色溶液X,分别取3 mL溶液X放入比色皿中,分别滴加0.1 mL的试剂①~④,并测定各溶液的透光率随时间的变化,结果如图所示。
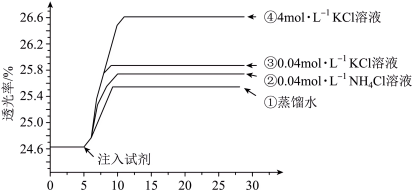
已知:i.Cl-与Fe3+能发生络合反应:Fe3+ +4C1- [FeCl4]-(黄色);
[FeCl4]-(黄色);
ii.Fe3+与NO 不能形成配位化合物;
不能形成配位化合物;
iii.溶液的透光率与溶液颜色深浅有关,颜色越深,透光率越低,忽略[FeCl4]-对透光率的影响。
(1)本实验配制溶液时用到的玻璃仪器除烧杯、量筒、玻璃棒、容量瓶外,还需要___________ ,用稀盐酸酸化FeCl3溶液的目的是___________ 。
(2)注入试剂①后溶液透光率升高,甲同学认为是溶液稀释导致颜色变浅,乙同学认为还可能是稀释的过程中,Fe3+ +3SCN- Fe(SCN)3平衡向
Fe(SCN)3平衡向___________ (填“正”或“逆”)反应方向移动。
(3)注入试剂④后的溶液透光率比注入试剂①后高,结合平衡移动原理分析其原因___________ 。
(4)注入试剂③后的溶液透光率比注入试剂②后高,可能是___________ 导致的(答出一种影响因素即可,不需详细说明理由)。
实验II:探究不同盐对Fe3+和SCN-平衡体系的影响
取2 mL溶液X,分别加入下列试剂进行实验,一段时间后测得各溶液的透光率如下表。
(5)丙同学发现A3>A2>A1,查阅资料认为可能的原因:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。推断盐效应较强的金属阳离子为___________ (填离子符号),试分析该离子盐效应对Fe3+和SCN-平衡体系有影响的原因___________ 。
(6)拓展应用:盐效应对多种平衡体系有影响。
分析c(Na2SO4)在0~0.20 mol·L-1范围内,PbSO4溶解度发生变化的原因:___________ 。
(7)FeCl3用途十分广泛,请写出一种其在生活中的用途___________ 。
 Fe(SCN)3平衡体系的影响。
Fe(SCN)3平衡体系的影响。实验I:探究KCl对Fe3+和SCN-平衡体系的影响
将已用稀盐酸酸化的0.005 mol·L-1 FeCl3溶液和0.01 mol·L-1 KSCN溶液等体积混合,静置至体系平衡,得红色溶液X,分别取3 mL溶液X放入比色皿中,分别滴加0.1 mL的试剂①~④,并测定各溶液的透光率随时间的变化,结果如图所示。

已知:i.Cl-与Fe3+能发生络合反应:Fe3+ +4C1-
 [FeCl4]-(黄色);
[FeCl4]-(黄色);ii.Fe3+与NO
 不能形成配位化合物;
不能形成配位化合物;iii.溶液的透光率与溶液颜色深浅有关,颜色越深,透光率越低,忽略[FeCl4]-对透光率的影响。
(1)本实验配制溶液时用到的玻璃仪器除烧杯、量筒、玻璃棒、容量瓶外,还需要
(2)注入试剂①后溶液透光率升高,甲同学认为是溶液稀释导致颜色变浅,乙同学认为还可能是稀释的过程中,Fe3+ +3SCN-
 Fe(SCN)3平衡向
Fe(SCN)3平衡向(3)注入试剂④后的溶液透光率比注入试剂①后高,结合平衡移动原理分析其原因
(4)注入试剂③后的溶液透光率比注入试剂②后高,可能是
实验II:探究不同盐对Fe3+和SCN-平衡体系的影响
取2 mL溶液X,分别加入下列试剂进行实验,一段时间后测得各溶液的透光率如下表。
| 序号 | 加入试剂 | 溶液透光率 |
| 1 | 1 mL蒸馏水 | A1 |
| 2 | 1 mL 3 mol·L-1 KNO3 | A2 |
| 3 | 1 mL 3 mol·L-1 NaNO3 | A3 |
(5)丙同学发现A3>A2>A1,查阅资料认为可能的原因:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。推断盐效应较强的金属阳离子为
(6)拓展应用:盐效应对多种平衡体系有影响。
| c(Na2SO4)/(mol·L-1) | 0 | 0.01 | 0.02 | 0.04 | 0.10 | 0.20 |
| PbSO4溶解度/mg | 4.5 | 0.48 | 0.42 | 0.39 | 0.48 | 0.69 |
(7)FeCl3用途十分广泛,请写出一种其在生活中的用途
您最近一年使用:0次
名校
解题方法
2 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅等的氧化物,从铬钒渣中分离提取铬和钒的一种流程如图所示。下列说法正确的是
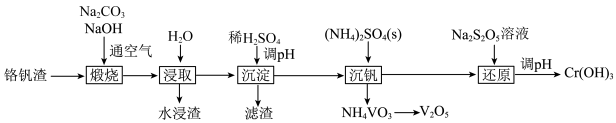
已知:①“煅烧”时铬、铝和硅的氧化物均转化为可溶性钠盐:
② 。
。

已知:①“煅烧”时铬、铝和硅的氧化物均转化为可溶性钠盐:
②
 。
。A.“煅烧”后的含铬化合物是 |
B.“滤渣”中只含有 |
C.“沉钒”时 固体可增大 固体可增大 的浓度,有利于沉淀的生成 的浓度,有利于沉淀的生成 |
D.“还原”工序中氧化剂和还原剂的物质的量之比为 |
您最近一年使用:0次
2023-12-03更新
|
371次组卷
|
2卷引用:辽宁省沈阳市第一二0中学2023-2024学年高三上学期第五次质量监测化学试题
名校
3 . 下列物质的用途或事实与盐类的水解无关的是
A.用 溶液处理锅炉水垢中的 溶液处理锅炉水垢中的 |
B.明矾[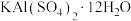 ]用于净水 ]用于净水 |
C.用热饱和 溶液清洗试管壁上附着的植物油 溶液清洗试管壁上附着的植物油 |
D.由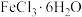 制取无水 制取无水 固体时,需在HCl气流中蒸发 固体时,需在HCl气流中蒸发 |
您最近一年使用:0次
2023-11-29更新
|
312次组卷
|
3卷引用:河北省石家庄市第十五中学2023-2024学年高二上学期12月阶段考试化学试题
4 . 下列物质性质、用途描述正确的是
A.利用 的氧化性,用作植物保鲜剂 的氧化性,用作植物保鲜剂 |
B.利用 的还原性,将废水中的 的还原性,将废水中的 转化为沉淀 转化为沉淀 |
C.利用 的漂白性,除去废水中的色素 的漂白性,除去废水中的色素 |
D.利用 的还原性,用作核反应堆的传热介质 的还原性,用作核反应堆的传热介质 |
您最近一年使用:0次
名校
解题方法
5 . 铬及其化合物在生产生活中具有十分广泛的用途。工业上以铬铁矿[主要成分是 ,Cr元素为+3价,含少量
,Cr元素为+3价,含少量 、
、 、
、 等杂质]为原料制取铬酸钠(
等杂质]为原料制取铬酸钠( )晶体,其工艺流程如图:
)晶体,其工艺流程如图:

已知:+3价Cr在酸性溶液中性质稳定,当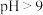 时以
时以 形式存在且易被氧化。
形式存在且易被氧化。
(1)如 可写成
可写成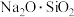 ,则
,则 可写成
可写成_______ 。
(2)若省略“过滤2”步骤,产品中可能混有_______ (写化学式)。
(3)流程中两次使用了 进行氧化,第二次氧化时反应的离子方程式为
进行氧化,第二次氧化时反应的离子方程式为_______ 。
(4)制取铬酸钠后的酸性废水中含有 ,必须经过处理与净化才能排放。在废水中加入焦炭和铁屑,与酸性
,必须经过处理与净化才能排放。在废水中加入焦炭和铁屑,与酸性 溶液形成原电池,使
溶液形成原电池,使 转化为
转化为 ,再用石灰乳对
,再用石灰乳对 进行沉降,该电池的正极反应式为
进行沉降,该电池的正极反应式为_______ ,沉降 的离子方程式为
的离子方程式为_______ 。
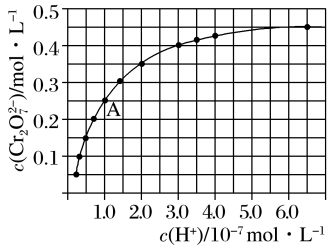
(5)金属铬在溶液中有多种存在形式, 和
和 在溶液中可相互转化。室温下,初始浓度为
在溶液中可相互转化。室温下,初始浓度为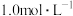 的
的 溶液中
溶液中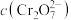 随
随 的变化如图所示,用离子方程式表示
的变化如图所示,用离子方程式表示 溶液中的转化反应
溶液中的转化反应_______ ,根据A点数据计算出该转化反应的平衡常数为_______ ,温度升高,溶液中 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
_______ (填“>”“<”或“=”)0。
 ,Cr元素为+3价,含少量
,Cr元素为+3价,含少量 、
、 、
、 等杂质]为原料制取铬酸钠(
等杂质]为原料制取铬酸钠( )晶体,其工艺流程如图:
)晶体,其工艺流程如图:
已知:+3价Cr在酸性溶液中性质稳定,当
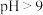 时以
时以 形式存在且易被氧化。
形式存在且易被氧化。(1)如
 可写成
可写成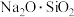 ,则
,则 可写成
可写成(2)若省略“过滤2”步骤,产品中可能混有
(3)流程中两次使用了
 进行氧化,第二次氧化时反应的离子方程式为
进行氧化,第二次氧化时反应的离子方程式为(4)制取铬酸钠后的酸性废水中含有
 ,必须经过处理与净化才能排放。在废水中加入焦炭和铁屑,与酸性
,必须经过处理与净化才能排放。在废水中加入焦炭和铁屑,与酸性 溶液形成原电池,使
溶液形成原电池,使 转化为
转化为 ,再用石灰乳对
,再用石灰乳对 进行沉降,该电池的正极反应式为
进行沉降,该电池的正极反应式为 的离子方程式为
的离子方程式为(5)金属铬在溶液中有多种存在形式,
 和
和 在溶液中可相互转化。室温下,初始浓度为
在溶液中可相互转化。室温下,初始浓度为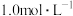 的
的 溶液中
溶液中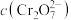 随
随 的变化如图所示,用离子方程式表示
的变化如图所示,用离子方程式表示 溶液中的转化反应
溶液中的转化反应 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的

您最近一年使用:0次
2022-12-16更新
|
272次组卷
|
2卷引用:辽宁省大连市庄河市高级中学2022-2023学年高三上学期12月月考化学(B卷)试题
名校
6 . 下列物质的用途涉及氧化还原反应的是
| A.用NaHCO3作食品膨松剂 |
| B.用暖宝贴(成分:铁粉、水、食盐、活性炭等)供热 |
| C.用饱和Na2CO3溶液和盐酸处理水垢中的CaSO4 |
| D.用可溶性的铁盐、铝盐作净水剂 |
您最近一年使用:0次
2022-04-29更新
|
275次组卷
|
3卷引用:北京师范大学附属中学预科部2023-2024学年高三上学期12月月考化学试题
名校
7 . 四氯化钛(TiCl4)是工业生产重要中间产品的原料,并有着广泛的用途。它为无色或淡黄色液体,熔点为—30℃,沸点为136.4℃,极易水解。在实验室用钛铁矿(FeTiO3)为原料制备TiCl4实验装置如图所示:
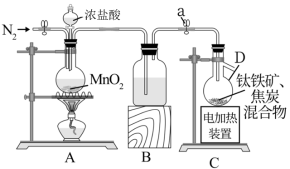
已知:(1)FeCl3熔点为306℃,沸点为316℃,极易水解;
(2)①Ag++SCN—=AgSCN↓;②Ksp(AgCl)>Ksp(AgSCN)。
请回答下列问题:
(1)装置A加热前先通一段时间N2,其目的是___ 。
(2)仪器D的名称是___ ;装置B中盛放的试剂名称是___ 。
(3)装置A中发生反应的离子方程式为___ 。
(4)装置C中发生反应的化学方程式为___ 。
(5)该制备装置不足之处:
①无尾气处理装置,CO与剩余Cl2会污染环境;
②___ 。
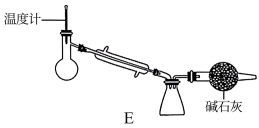
(6)停止滴加浓盐酸并关闭止水夹a,将装置c中所得物质转移到装置E中进行相关操作。装置E的作用是___ 。
(7)测定TiCl4产品的纯度。实验步骤如下:
①E装置相关操作结束后,待锥形瓶中的液体冷却至室温,准确称取14.0gTiCl4产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解,过滤后将水解液配成100.00mL溶液。
②取10.00mL溶液于锥形瓶中,加入10.00mL2.900mol•L-1AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X溶液为指示剂,用0.1000mol•L-1KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00mLKSCN溶液。
根据以上步骤计算产品中TiCl4的质量分数为___ (已知产品中杂质不参与反应);若省去步骤③,所测定TiCl4产品的质量分数将会___ (选填“偏大”“偏小”或“不变”)。


已知:(1)FeCl3熔点为306℃,沸点为316℃,极易水解;
(2)①Ag++SCN—=AgSCN↓;②Ksp(AgCl)>Ksp(AgSCN)。
请回答下列问题:
(1)装置A加热前先通一段时间N2,其目的是
(2)仪器D的名称是
(3)装置A中发生反应的离子方程式为
(4)装置C中发生反应的化学方程式为
(5)该制备装置不足之处:
①无尾气处理装置,CO与剩余Cl2会污染环境;
②
(6)停止滴加浓盐酸并关闭止水夹a,将装置c中所得物质转移到装置E中进行相关操作。装置E的作用是
(7)测定TiCl4产品的纯度。实验步骤如下:
①E装置相关操作结束后,待锥形瓶中的液体冷却至室温,准确称取14.0gTiCl4产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解,过滤后将水解液配成100.00mL溶液。
②取10.00mL溶液于锥形瓶中,加入10.00mL2.900mol•L-1AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X溶液为指示剂,用0.1000mol•L-1KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00mLKSCN溶液。
根据以上步骤计算产品中TiCl4的质量分数为
您最近一年使用:0次
8 . 重铬酸钠是一种用途极广的强氧化剂,工业上可以用铬铁矿[主要成分为Fe(CrO2)2或FeO·Cr2O3,还含有Al2O3、Fe2O3、SiO2等杂质]制备,其主要工艺流程如图所示。请回答下列问题:

(1)①煅烧铬铁矿生成Na2CrO4的化学方程式为____ 。
②煅烧后的浸出液中除了含有NaOH、Na2CO3、Na2CrO4外,还含有___ (写化学式)。
(2)调节溶液的pH所选的试剂为___ (填名称),写出生成Al(OH)3的化学方程式____ 。
(3)Na2CrO4溶液酸化时发生反应2 (黄色)+2H+⇌
(黄色)+2H+⇌ (橙红色)+H2O。
(橙红色)+H2O。
①该反应____ 氧化还原反应(填“是”或“不是”),反应的平衡常数表达式:K=___ 。
②若向Na2Cr2O7溶液(橙红色)中加入足量的NaOH固体,溶液____ (填标号)
A.变黄色 B.颜色不变 C.变红色溶液
③已知:25℃时,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7的Ksp=2×10-7。25℃时,向Na2Cr2O7溶液中加入AgNO3溶液,生成砖红色沉淀,且溶液酸性增强,该沉淀的化学式是___ 。
(4)用重铬酸钠(Na2Cr2O7)结晶后的母液生产重铬酸钾的反应为Na2Cr2O7+2KCl=K2Cr2O7+2NaCl,结合溶解度图回答,冷却结晶析出大量K2Cr2O7的原因是___ 。

(5)加入Na2S溶液反应后,溶液b中硫元素全部以 的形式存在,则该反应的离子方程式为
的形式存在,则该反应的离子方程式为_ 。

(1)①煅烧铬铁矿生成Na2CrO4的化学方程式为
②煅烧后的浸出液中除了含有NaOH、Na2CO3、Na2CrO4外,还含有
(2)调节溶液的pH所选的试剂为
(3)Na2CrO4溶液酸化时发生反应2
 (黄色)+2H+⇌
(黄色)+2H+⇌ (橙红色)+H2O。
(橙红色)+H2O。①该反应
②若向Na2Cr2O7溶液(橙红色)中加入足量的NaOH固体,溶液
A.变黄色 B.颜色不变 C.变红色溶液
③已知:25℃时,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7的Ksp=2×10-7。25℃时,向Na2Cr2O7溶液中加入AgNO3溶液,生成砖红色沉淀,且溶液酸性增强,该沉淀的化学式是
(4)用重铬酸钠(Na2Cr2O7)结晶后的母液生产重铬酸钾的反应为Na2Cr2O7+2KCl=K2Cr2O7+2NaCl,结合溶解度图回答,冷却结晶析出大量K2Cr2O7的原因是

(5)加入Na2S溶液反应后,溶液b中硫元素全部以
 的形式存在,则该反应的离子方程式为
的形式存在,则该反应的离子方程式为
您最近一年使用:0次
9 . 亚磷酸钠(Na2HPO3)用途广泛,也是一种性价比高的催化剂。“NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠(Na2HPO3)的工业流程如图如下:

“合成”过程中主要氧化产物为亚磷酸(H3PO3),相应的化学方程式为:NaH2PO2+I2+H2O=H3PO3+NaI+HI。
已知:亚磷酸(H3PO3)为二元酸,其电离常数K1=3.7×l0-2,K2=2.9×l0-7;180℃分解为PH3和磷酸。请回答:
(1)“除铅”过程中,用FeS固体除去微量Pb2+的离子方程式为_______ 。
(2)采取减压蒸馏的原因是_______ 。
(3)“减压蒸馏”过程,I-的回收率为95%,则剩余固体的主要成分为_______ (填化学式),发生反应的化学方程式为_______ 。
(4)“调pH=11”的作用有两个,一是将Fe3+转化为Fe(OH)3沉淀,二是_______ 。
(5)工业上常用电解法制备亚磷酸,其装置示意图如下。

①b为电源的_______ (填“正极”或“负极”)。
②A膜应选择_______ (填“阴离子”或“阳离子”)交换膜。
③阴极的电极反应式为_______ 。

“合成”过程中主要氧化产物为亚磷酸(H3PO3),相应的化学方程式为:NaH2PO2+I2+H2O=H3PO3+NaI+HI。
已知:亚磷酸(H3PO3)为二元酸,其电离常数K1=3.7×l0-2,K2=2.9×l0-7;180℃分解为PH3和磷酸。请回答:
(1)“除铅”过程中,用FeS固体除去微量Pb2+的离子方程式为
(2)采取减压蒸馏的原因是
(3)“减压蒸馏”过程,I-的回收率为95%,则剩余固体的主要成分为
(4)“调pH=11”的作用有两个,一是将Fe3+转化为Fe(OH)3沉淀,二是
(5)工业上常用电解法制备亚磷酸,其装置示意图如下。

①b为电源的
②A膜应选择
③阴极的电极反应式为
您最近一年使用:0次
2021-03-13更新
|
459次组卷
|
2卷引用:广东省普宁市华美实验学校2020-2021学年高二下学期第一次月考化学试题
名校
10 . 盐类水解在生产、生活中应用广泛,下列物质的用途与盐类水解无关的是
| A.用可溶性铁盐和铝盐作自来水的净水剂 |
| B.用Na2CO3溶液处理锅炉里的CaSO4水垢 |
| C.用饱和NaHCO3溶液与Al2(SO4)3溶液作泡沫灭火剂原料 |
| D.利用加热TiCl4溶液的方法制取TiO2·xH2O,进而制备纳米级TiO2 |
您最近一年使用:0次
2021-02-03更新
|
504次组卷
|
8卷引用:江苏省灌云高级中学2021-2022学年高二上学期12月阶段考试化学试题
江苏省灌云高级中学2021-2022学年高二上学期12月阶段考试化学试题江苏省启东市、通州区2020-2021学年高二上学期期末学业质量监测化学试题江苏省扬州市邗江中学2020-2021学年高二下学期期中考试化学试题江苏省响水中学2021-2022学年高二下学期期中考试化学试题江苏省南通市海安市2022-2023学年高二上学期1月期末考试化学试题江苏省常熟市2022-2023学年高二下学期期中考试化学试题(已下线)专题09 水溶液中的离子平衡-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(江苏专用)江苏省扬州中学2023-2024学年高二下学期4月期中考试化学试题



