解题方法
1 . 某小组同学探究盐对Fe3+ +3SCN- Fe(SCN)3平衡体系的影响。
Fe(SCN)3平衡体系的影响。
实验I:探究KCl对Fe3+和SCN-平衡体系的影响
将已用稀盐酸酸化的0.005 mol·L-1 FeCl3溶液和0.01 mol·L-1 KSCN溶液等体积混合,静置至体系平衡,得红色溶液X,分别取3 mL溶液X放入比色皿中,分别滴加0.1 mL的试剂①~④,并测定各溶液的透光率随时间的变化,结果如图所示。
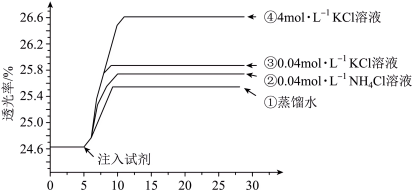
已知:i.Cl-与Fe3+能发生络合反应:Fe3+ +4C1- [FeCl4]-(黄色);
[FeCl4]-(黄色);
ii.Fe3+与NO 不能形成配位化合物;
不能形成配位化合物;
iii.溶液的透光率与溶液颜色深浅有关,颜色越深,透光率越低,忽略[FeCl4]-对透光率的影响。
(1)本实验配制溶液时用到的玻璃仪器除烧杯、量筒、玻璃棒、容量瓶外,还需要___________ ,用稀盐酸酸化FeCl3溶液的目的是___________ 。
(2)注入试剂①后溶液透光率升高,甲同学认为是溶液稀释导致颜色变浅,乙同学认为还可能是稀释的过程中,Fe3+ +3SCN- Fe(SCN)3平衡向
Fe(SCN)3平衡向___________ (填“正”或“逆”)反应方向移动。
(3)注入试剂④后的溶液透光率比注入试剂①后高,结合平衡移动原理分析其原因___________ 。
(4)注入试剂③后的溶液透光率比注入试剂②后高,可能是___________ 导致的(答出一种影响因素即可,不需详细说明理由)。
实验II:探究不同盐对Fe3+和SCN-平衡体系的影响
取2 mL溶液X,分别加入下列试剂进行实验,一段时间后测得各溶液的透光率如下表。
(5)丙同学发现A3>A2>A1,查阅资料认为可能的原因:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。推断盐效应较强的金属阳离子为___________ (填离子符号),试分析该离子盐效应对Fe3+和SCN-平衡体系有影响的原因___________ 。
(6)拓展应用:盐效应对多种平衡体系有影响。
分析c(Na2SO4)在0~0.20 mol·L-1范围内,PbSO4溶解度发生变化的原因:___________ 。
(7)FeCl3用途十分广泛,请写出一种其在生活中的用途___________ 。
 Fe(SCN)3平衡体系的影响。
Fe(SCN)3平衡体系的影响。实验I:探究KCl对Fe3+和SCN-平衡体系的影响
将已用稀盐酸酸化的0.005 mol·L-1 FeCl3溶液和0.01 mol·L-1 KSCN溶液等体积混合,静置至体系平衡,得红色溶液X,分别取3 mL溶液X放入比色皿中,分别滴加0.1 mL的试剂①~④,并测定各溶液的透光率随时间的变化,结果如图所示。

已知:i.Cl-与Fe3+能发生络合反应:Fe3+ +4C1-
 [FeCl4]-(黄色);
[FeCl4]-(黄色);ii.Fe3+与NO
 不能形成配位化合物;
不能形成配位化合物;iii.溶液的透光率与溶液颜色深浅有关,颜色越深,透光率越低,忽略[FeCl4]-对透光率的影响。
(1)本实验配制溶液时用到的玻璃仪器除烧杯、量筒、玻璃棒、容量瓶外,还需要
(2)注入试剂①后溶液透光率升高,甲同学认为是溶液稀释导致颜色变浅,乙同学认为还可能是稀释的过程中,Fe3+ +3SCN-
 Fe(SCN)3平衡向
Fe(SCN)3平衡向(3)注入试剂④后的溶液透光率比注入试剂①后高,结合平衡移动原理分析其原因
(4)注入试剂③后的溶液透光率比注入试剂②后高,可能是
实验II:探究不同盐对Fe3+和SCN-平衡体系的影响
取2 mL溶液X,分别加入下列试剂进行实验,一段时间后测得各溶液的透光率如下表。
| 序号 | 加入试剂 | 溶液透光率 |
| 1 | 1 mL蒸馏水 | A1 |
| 2 | 1 mL 3 mol·L-1 KNO3 | A2 |
| 3 | 1 mL 3 mol·L-1 NaNO3 | A3 |
(5)丙同学发现A3>A2>A1,查阅资料认为可能的原因:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。推断盐效应较强的金属阳离子为
(6)拓展应用:盐效应对多种平衡体系有影响。
| c(Na2SO4)/(mol·L-1) | 0 | 0.01 | 0.02 | 0.04 | 0.10 | 0.20 |
| PbSO4溶解度/mg | 4.5 | 0.48 | 0.42 | 0.39 | 0.48 | 0.69 |
(7)FeCl3用途十分广泛,请写出一种其在生活中的用途
您最近一年使用:0次
2 . 陈述I和Ⅱ均正确且具有因果关系的是
| 选项 | 陈述I | 陈述Ⅱ |
| A | 硝酸铵与水合碳酸钠可用于制作冰敷袋 | 该反应的反应物总能量高于生成物总能量 |
| B | 不锈钢性质比较稳定、不易生锈、用途广泛 | 不锈钢硬度、熔点均比纯铁大 |
| C | 原生铜的硫化物经氧化、淋滤渗透与 可生成 可生成 |  具有氧化性 具有氧化性 |
| D | 成熟苹果的汁液能与银氨溶液反应 | 成熟的苹果汁液中含有葡萄糖 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 化学与人类生产、生活密切相关。下列有关物质用途的说法错误的是
| A.三聚氰胺可用作食品添加剂 |
| B.使用聚四氟乙烯活塞的滴定管可以装碱性溶液 |
| C.可以向牙膏中添加Na2PO3F、NaF和SrF2等预防龋齿 |
| D.运输水果的过程中,可以在包装盒内加入浸泡过高锰酸钾溶液的硅藻土 |
您最近一年使用:0次
解题方法
4 . 废旧铅蓄电池拆解获得铅膏(主要由PbSO4、PbO2、PbO形成的悬浊液),对其回收利用可减少环境污染。流程如下:

(1)“还原”步骤为了加快速率可采取的一项措施是_________________ 。该步骤PbO2发生反应的化学方程式为_________________ 。
(2)已知25℃ ,
, ,
,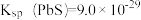 ,“脱硫”步骤选择最合适的试剂为
,“脱硫”步骤选择最合适的试剂为_________________ 。
a.(NH4)2CO3b.(NH4)2S c.NH4NO3
利用选出的脱硫试剂写出“脱硫”步骤的离子方程式________________ ;指出该步骤获得滤液的一种农业生产上的用途________________ 。
(3)“酸浸”步骤HBF4是一种强酸,试解释其酸性强于HF的原因________________ ,该步骤PbO发生反应的离子方程式为________________ 。
(4)电解时,酸度不宜过大的原因是________________ ;若电解时阳极有微量PbO2生成,写出生成PbO2的电极反应式________________ 。

(1)“还原”步骤为了加快速率可采取的一项措施是
(2)已知25℃
 ,
, ,
,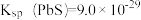 ,“脱硫”步骤选择最合适的试剂为
,“脱硫”步骤选择最合适的试剂为a.(NH4)2CO3b.(NH4)2S c.NH4NO3
利用选出的脱硫试剂写出“脱硫”步骤的离子方程式
(3)“酸浸”步骤HBF4是一种强酸,试解释其酸性强于HF的原因
(4)电解时,酸度不宜过大的原因是
您最近一年使用:0次
5 . 下列物质性质、用途描述正确的是
A.利用 的氧化性,用作植物保鲜剂 的氧化性,用作植物保鲜剂 |
B.利用 的还原性,将废水中的 的还原性,将废水中的 转化为沉淀 转化为沉淀 |
C.利用 的漂白性,除去废水中的色素 的漂白性,除去废水中的色素 |
D.利用 的还原性,用作核反应堆的传热介质 的还原性,用作核反应堆的传热介质 |
您最近一年使用:0次
6 . 下列物质用途的描述正确的是
| A.明矾溶液用作铜绿去除剂,利用了其水解显酸性 |
| B.淀粉溶液用作碘量法滴定的指示剂,利用了其不饱和性 |
| C.FeS用作除去含Cu2+废水的沉淀剂,利用了其还原性 |
| D.SO2用作海水提溴的吸收剂,利用了其漂白性 |
您最近一年使用:0次
名校
7 . 下列物质的用途涉及氧化还原反应的是
| A.用NaHCO3作食品膨松剂 |
| B.用暖宝贴(成分:铁粉、水、食盐、活性炭等)供热 |
| C.用饱和Na2CO3溶液和盐酸处理水垢中的CaSO4 |
| D.用可溶性的铁盐、铝盐作净水剂 |
您最近一年使用:0次
2022-04-29更新
|
276次组卷
|
3卷引用:北京师范大学附属中学预科部2023-2024学年高三上学期12月月考化学试题
8 . 银及其化合物在制造钱币、电子工业、医药等方面具有广泛用途。
Ⅰ.银的冶炼及性质
(1)热分解法是金属冶炼方法之一。以Ag2O为原料冶炼银的化学方程式为__ 。
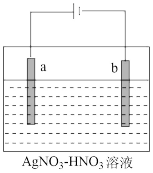
(2)电解精炼银的工作原理如图所示,___ (填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为___ 。
Ⅱ.银的化合物的性质
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式__ 。
(4)在光照条件下,AgNO3可分解为Ag、O2和某种氮的氧化物。称取34g AgNO3固体,充分光照使其完全分解,测得反应后生成O2的体积(折合成标准状况)为2.24L,反应过程中转移电子的物质的量为__ 。
(5)纳米硫化(Ag2S)应用广泛。Ag2S溶于浓HNO3后,产生淡黄色固体及无色气体,该气体遇空气迅速变为红棕色。写出反应的化学方程式__ 。
Ⅰ.银的冶炼及性质
(1)热分解法是金属冶炼方法之一。以Ag2O为原料冶炼银的化学方程式为
(2)电解精炼银的工作原理如图所示,

Ⅱ.银的化合物的性质
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式
(4)在光照条件下,AgNO3可分解为Ag、O2和某种氮的氧化物。称取34g AgNO3固体,充分光照使其完全分解,测得反应后生成O2的体积(折合成标准状况)为2.24L,反应过程中转移电子的物质的量为
(5)纳米硫化(Ag2S)应用广泛。Ag2S溶于浓HNO3后,产生淡黄色固体及无色气体,该气体遇空气迅速变为红棕色。写出反应的化学方程式
您最近一年使用:0次
2021-05-03更新
|
598次组卷
|
4卷引用:北京市第三中学2021-2022学年高三上学期期中考试化学试题
北京市第三中学2021-2022学年高三上学期期中考试化学试题北京市丰台区2021届高三第二次模拟考试化学试题(已下线)第二章能力提升检测卷-2022年高考化学一轮复习讲练测(已下线)第二章 化学物质及其变化(测)-2023年高考化学一轮复习讲练测(全国通用)



