1 . 资料显示, 可以将
可以将 氧化为
氧化为 。某小组同学设计实验探究
。某小组同学设计实验探究 被
被 氧化的产物及铜元素的价态。
氧化的产物及铜元素的价态。
已知: 易溶于
易溶于 溶液,发生反应
溶液,发生反应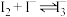 (红棕色);
(红棕色); 和
和 氧化性几乎相同。
氧化性几乎相同。
I.将等体积的 溶液加入到
溶液加入到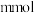 铜粉和
铜粉和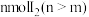 的固体混合物中,振荡。
的固体混合物中,振荡。
实验记录如下:
(1)初始阶段, 被氧化的反应速率:实验Ⅰ
被氧化的反应速率:实验Ⅰ__________ (填“>”“<”或“=”)实验Ⅱ。
(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有 (蓝色)或
(蓝色)或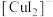 (无色),进行以下实验探究:
(无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入 ,多次萃取、分液。
,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
ⅰ.步骤a的目的是_____________________ 。
ⅱ.查阅资料, ,
, (无色)容易被空气氧化。用离子方程式解释步骤
(无色)容易被空气氧化。用离子方程式解释步骤 的溶液中发生的变化:
的溶液中发生的变化:______________ 。
(3)结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是 ,实验Ⅰ中铜被氧化的化学方程式是
,实验Ⅰ中铜被氧化的化学方程式是____________________ 。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓 溶液,
溶液,__________ (填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是____________________ 。
(4)上述实验结果, 仅将
仅将 氧化为
氧化为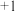 价。在隔绝空气的条件下进行电化学实验,证实了
价。在隔绝空气的条件下进行电化学实验,证实了 能将
能将 氧化为
氧化为 。装置如图所示,
。装置如图所示, 分别是
分别是_____________ 。 被
被 氧化的产物中价态不同的原因:
氧化的产物中价态不同的原因:_________ 。
 可以将
可以将 氧化为
氧化为 。某小组同学设计实验探究
。某小组同学设计实验探究 被
被 氧化的产物及铜元素的价态。
氧化的产物及铜元素的价态。已知:
 易溶于
易溶于 溶液,发生反应
溶液,发生反应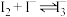 (红棕色);
(红棕色); 和
和 氧化性几乎相同。
氧化性几乎相同。I.将等体积的
 溶液加入到
溶液加入到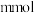 铜粉和
铜粉和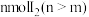 的固体混合物中,振荡。
的固体混合物中,振荡。实验记录如下:
| 实验现象 | |
实验Ⅰ |
| 极少量 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 |
实验Ⅱ |
| 部分 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 |
实验Ⅲ |
|  完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 |
 被氧化的反应速率:实验Ⅰ
被氧化的反应速率:实验Ⅰ(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有
 (蓝色)或
(蓝色)或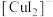 (无色),进行以下实验探究:
(无色),进行以下实验探究:步骤a.取实验Ⅲ的深红棕色溶液,加入
 ,多次萃取、分液。
,多次萃取、分液。步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
ⅰ.步骤a的目的是
ⅱ.查阅资料,
 ,
, (无色)容易被空气氧化。用离子方程式解释步骤
(无色)容易被空气氧化。用离子方程式解释步骤 的溶液中发生的变化:
的溶液中发生的变化:(3)结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是
 ,实验Ⅰ中铜被氧化的化学方程式是
,实验Ⅰ中铜被氧化的化学方程式是 溶液,
溶液,(4)上述实验结果,
 仅将
仅将 氧化为
氧化为 价。在隔绝空气的条件下进行电化学实验,证实了
价。在隔绝空气的条件下进行电化学实验,证实了 能将
能将 氧化为
氧化为 。装置如图所示,
。装置如图所示, 分别是
分别是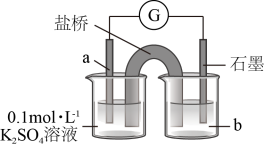
 被
被 氧化的产物中价态不同的原因:
氧化的产物中价态不同的原因:
您最近一年使用:0次
2023-06-28更新
|
9215次组卷
|
15卷引用:湖北省黄冈市重点校2022-2023学年高一下学期期末综合选拔性联考化学试题
湖北省黄冈市重点校2022-2023学年高一下学期期末综合选拔性联考化学试题2023年高考北京卷化学真题(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)2023年北京卷高考真题变式题(实验探究题)(已下线)T28-实验探究题(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)第17讲实验方案的设计与评价(已下线)考点12 金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)北京市第一七一中学2023-2024学年高三上学期12月月考化学试题 北京师范大学附属中学2023-2024学年高三上学期12月月考化学(2)试题宁夏回族自治区银川一中2024届高三下学期考前热身训练化学试卷2
2 . 某班同学想要设计实验验证元素性质变化规律,
I.第一组同学拟利用原电池反应检测金属的活动性顺序,设计如图甲所示原电池装置,用铝片和铜片作电极,电解质为H2SO4溶液,

(1)写出甲中负极的电极反应式:___________ 。此电池工作时导线中电流方向为:___________ (选填“铜→铝”或“铝→铜”)。
(2)乙同学将铜电极换成镁电极,如图乙所示,实验发现也可组成原电池,此时铝片上有气体产生,则此原电池中负极是___________ 。(填“镁片”或“铝片”)。
(3)由以上实验推断,当把A、B两种金属用导线连接后同时浸入稀硫酸溶液中,若B上发生还原反应,则A、B金属的活泼性可能是___________ (填“A>B”或“A<B”)。
II.为了验证元素周期律相关的结论,另一组同学也设计了一套实验方案,并记录了有关实验现象。
(4)方案①相关反应的离子方程式为___________ 。
(5)方案④相关反应的化学方程式为___________ ,由以上方案可知S、Cl、Br、I的非金属性由强到弱的顺序为___________ (用化学符号表示)。
(6)实验结论:周期表中元素的非金属性变化规律为___________ 。
I.第一组同学拟利用原电池反应检测金属的活动性顺序,设计如图甲所示原电池装置,用铝片和铜片作电极,电解质为H2SO4溶液,

(1)写出甲中负极的电极反应式:
(2)乙同学将铜电极换成镁电极,如图乙所示,实验发现也可组成原电池,此时铝片上有气体产生,则此原电池中负极是
(3)由以上实验推断,当把A、B两种金属用导线连接后同时浸入稀硫酸溶液中,若B上发生还原反应,则A、B金属的活泼性可能是
II.为了验证元素周期律相关的结论,另一组同学也设计了一套实验方案,并记录了有关实验现象。
| 实验方案 | 实验现象 |
| ①将新制氯水滴入NaBr溶液中,振荡后加入适量CCl4溶液,振荡,静置 | 分层,上层无色,下层橙红色 |
| ②将溴水滴入NaI溶液中,振荡后加入适量CCl4溶液,振荡,静置 | 分层,上层无色,下层紫红色 |
| ③将少量I2固体加入NaCl溶液中,振荡后加入适量淀粉溶液,振荡,静置 | 溶液变蓝色 |
| ④将少量I2固体加入Na2S溶液,振荡后静置 | 溶液变浑浊,出现淡黄色沉淀 |
(5)方案④相关反应的化学方程式为
(6)实验结论:周期表中元素的非金属性变化规律为
您最近一年使用:0次
2022-05-11更新
|
188次组卷
|
2卷引用:湖北省竹山县第二中学2021-2022学年高一下学期6月月考化学试题
名校
3 . 习近平总书记在浙江湖州市安吉县考察时提出了一个科学论断“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。请回答下列问题:
(1)硫酸工业排出的尾气(主要含 )可用软锰矿浆(
)可用软锰矿浆( )吸收,写出如图所示“反应”的化学方程式为
)吸收,写出如图所示“反应”的化学方程式为________ 。 和CO的方法之一是在汽车的排气管上装一个催化转化装置,使
和CO的方法之一是在汽车的排气管上装一个催化转化装置,使 和CO在催化剂作用下转化为无毒物质,发生反应
和CO在催化剂作用下转化为无毒物质,发生反应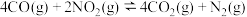 .一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和
.一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和 ,
, 的物质的量随时间的变化曲线如图所示。
的物质的量随时间的变化曲线如图所示。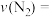
________ 。
②从11min起其他条件不变,压缩容器的容积变为1L,则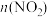 的变化曲线可能为图中的
的变化曲线可能为图中的________ (填字母)。
③恒温恒容条件下,不能说明该反应已经达到平衡状态的是________ (填标号)。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.容器内混合气体密度保持不变
D.容器内混合气体平均相对分子质量保持不变
(3)利用反应 构成原电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能,回答下列问题:
构成原电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能,回答下列问题:________ (填“正极”或“负极”),发生________ (填“氧化反应”或“还原反应”),电极B上发生的电极反应为________ 。
(1)硫酸工业排出的尾气(主要含
 )可用软锰矿浆(
)可用软锰矿浆( )吸收,写出如图所示“反应”的化学方程式为
)吸收,写出如图所示“反应”的化学方程式为
 和CO的方法之一是在汽车的排气管上装一个催化转化装置,使
和CO的方法之一是在汽车的排气管上装一个催化转化装置,使 和CO在催化剂作用下转化为无毒物质,发生反应
和CO在催化剂作用下转化为无毒物质,发生反应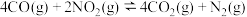 .一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和
.一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和 ,
, 的物质的量随时间的变化曲线如图所示。
的物质的量随时间的变化曲线如图所示。
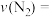
②从11min起其他条件不变,压缩容器的容积变为1L,则
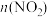 的变化曲线可能为图中的
的变化曲线可能为图中的③恒温恒容条件下,不能说明该反应已经达到平衡状态的是
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.容器内混合气体密度保持不变
D.容器内混合气体平均相对分子质量保持不变
(3)利用反应
 构成原电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能,回答下列问题:
构成原电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能,回答下列问题: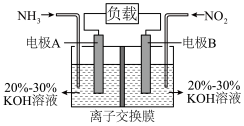
您最近一年使用:0次
解题方法
4 . 甲醇是一种重要的工业品,也可作燃料电池的原料。回答下列问题:
(1)CH3OH的电子式为___ ;Sn与C位于同一主族,核电荷数为50,其在元素周期表中的位置为___ 。
(2)微型直接甲醇燃料电池是通过MEMS工艺制作的一种微型能源装置,具有结构简单、体积小、质量轻、比能量密度高、环境污染小等优点,其装置如图所示:
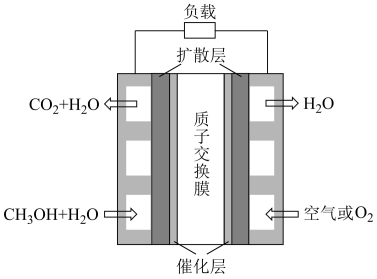
①通入CH3OH和H2O的电极为该电池的___ (填“正极”或“负极”),该电极上的电极反应式为___ 。
②电解质溶液可能为____ (填“稀H2SO4”或“KOH溶液”)。
(3)T℃时,将0.75molCO2和2.25molH2的混合气体通入体积为1L的恒容密闭容器中,在一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),5min后反应达到平衡,此时容器压强为起始压强的
CH3OH(g)+H2O(g),5min后反应达到平衡,此时容器压强为起始压强的 。
。
①平衡时,CH3OH的物质的量为___ mol。
②0~5min内,v(H2)=__ mol·L-1·min-1。
③CO2的转化率为___ 。(保留3位有效数字)
(1)CH3OH的电子式为
(2)微型直接甲醇燃料电池是通过MEMS工艺制作的一种微型能源装置,具有结构简单、体积小、质量轻、比能量密度高、环境污染小等优点,其装置如图所示:

①通入CH3OH和H2O的电极为该电池的
②电解质溶液可能为
(3)T℃时,将0.75molCO2和2.25molH2的混合气体通入体积为1L的恒容密闭容器中,在一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),5min后反应达到平衡,此时容器压强为起始压强的
CH3OH(g)+H2O(g),5min后反应达到平衡,此时容器压强为起始压强的 。
。①平衡时,CH3OH的物质的量为
②0~5min内,v(H2)=
③CO2的转化率为
您最近一年使用:0次
2021-10-15更新
|
245次组卷
|
3卷引用:湖北省京山市、安陆市等百校联考2022届高三月考化学试题
5 . 能源、材料、环境和健康等领域与化学息息相关。
(1)甲醇(CH3OH)和 O2 在下列装置中反应可以形成为原电池,其结构示意图如下:
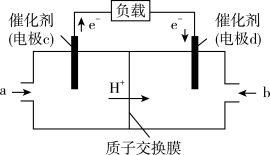
电池总反应为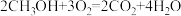 ,则电极 d 是
,则电极 d 是___________ (填“正极”或“负极"),电极 c 的反应式为___________ ,若线路中转移 1mol 电子,则上述 CH3OH 燃料电池消耗的 O2 在标准状况下的体积为___________ 。
(2)A、B、C、D 四种物质之间有如图所示的转化关系。
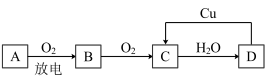
已知:A 是空气中的主要成分之一,B、C、D 均为化合物,且 C 为一种红棕色气体。写出 D→C 的化学方程式:___________ ;其中 D 表现出___________ 性。
(3)一种在恒温、恒定气流流速下,催化氧化 HCl 生产 Cl2 工艺的主要反应机理如图所示。
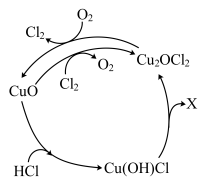
①X 为___________ 。
②总反应化学方程式式为___________ 。
(1)甲醇(CH3OH)和 O2 在下列装置中反应可以形成为原电池,其结构示意图如下:

电池总反应为
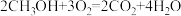 ,则电极 d 是
,则电极 d 是(2)A、B、C、D 四种物质之间有如图所示的转化关系。

已知:A 是空气中的主要成分之一,B、C、D 均为化合物,且 C 为一种红棕色气体。写出 D→C 的化学方程式:
(3)一种在恒温、恒定气流流速下,催化氧化 HCl 生产 Cl2 工艺的主要反应机理如图所示。

①X 为
②总反应化学方程式式为
您最近一年使用:0次
6 . 实验室现有如下几种药品:
A.乙醇 B.浓硫酸 C.品红溶液 D.NaOH溶液 E.溴水
甲同学利用A与B在一定条件下反应制取 气体,发现其中还含有
气体,发现其中还含有 。他设计了下图的实验装置,以检验这两种气体的存在。
。他设计了下图的实验装置,以检验这两种气体的存在。
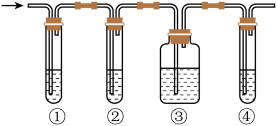
Ⅰ.试回答下列问题:
(1)写出图中①②③④装置盛放试剂的顺序为(填上述药品的标号,药品可重复使用或不使用)___________ 。
(2)能确定混合气体中存在乙烯的现象是___________ ,在这一检验过程中反应产生的无色液体有机物名称为___________ 。
Ⅱ.以乙烯为原料制备一种工业增塑剂的合成路线如图:
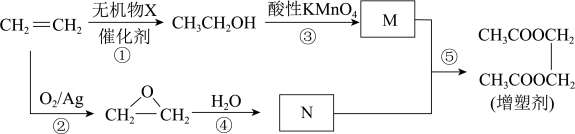
(3)有机物M的官能团的名称是___________ 。
(4)0.5 mol有机物N与足量金属钠反应产生 分子的数目为
分子的数目为___________
(5)合成增塑剂的化学方程式为___________ ,反应类型是___________
Ⅲ.上述气体中的另一成分 在一定的天气条件下会造成酸雨等污染现象。
在一定的天气条件下会造成酸雨等污染现象。
(6)我国酸雨的形成主要是由于___________(填标号)。
(7)科学家设计了一种以石墨为电极、稀硫酸为电解质溶液处理废气 的电池,其工作原理如图所示,下列说法中正确的有
的电池,其工作原理如图所示,下列说法中正确的有___________ (填标号)。
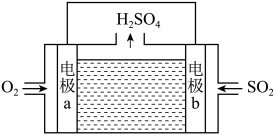
A.电流流向为:a→硫酸溶液→b→导线→a
B.电子流向为:a→硫酸溶液→b→导线→a
C.一段时间后,电解质溶液的pH减小
D.理论上每处理44.8 L ,可产生196 g
,可产生196 g 
E.电极b的电极反应式:
A.乙醇 B.浓硫酸 C.品红溶液 D.NaOH溶液 E.溴水
甲同学利用A与B在一定条件下反应制取
 气体,发现其中还含有
气体,发现其中还含有 。他设计了下图的实验装置,以检验这两种气体的存在。
。他设计了下图的实验装置,以检验这两种气体的存在。
Ⅰ.试回答下列问题:
(1)写出图中①②③④装置盛放试剂的顺序为(填上述药品的标号,药品可重复使用或不使用)
(2)能确定混合气体中存在乙烯的现象是
Ⅱ.以乙烯为原料制备一种工业增塑剂的合成路线如图:

(3)有机物M的官能团的名称是
(4)0.5 mol有机物N与足量金属钠反应产生
 分子的数目为
分子的数目为(5)合成增塑剂的化学方程式为
Ⅲ.上述气体中的另一成分
 在一定的天气条件下会造成酸雨等污染现象。
在一定的天气条件下会造成酸雨等污染现象。(6)我国酸雨的形成主要是由于___________(填标号)。
| A.汽车排除大量尾气 | B.大量燃烧含硫化石燃料 |
| C.大气中二氧化碳的含量增大 | D.森林遭到乱砍滥伐,破坏了生态环境 |
 的电池,其工作原理如图所示,下列说法中正确的有
的电池,其工作原理如图所示,下列说法中正确的有
A.电流流向为:a→硫酸溶液→b→导线→a
B.电子流向为:a→硫酸溶液→b→导线→a
C.一段时间后,电解质溶液的pH减小
D.理论上每处理44.8 L
 ,可产生196 g
,可产生196 g 
E.电极b的电极反应式:

您最近一年使用:0次
7 . 能源是人类生存和发展的重要支柱,甲醇作为一种能源用途广泛。
I.已知由甲醇制得新型能源二甲醚( )为放热反应:
)为放热反应: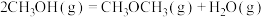

(1)

___ 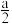 kJ/mol(填“>”“=”或“<”)
kJ/mol(填“>”“=”或“<”)
II.甲醇也可用来制作甲醇燃料电池,完成下面填空。
(2)若电解质溶液为酸性介质
①负极电极反应式为___________ 。
②总反应式为___________ 。
③电解质溶液的pH___________ (填“增大”“减小”或“不变”)。
(3)生产甲醇的原料CO和 来源于:
来源于:
 。一定条件下
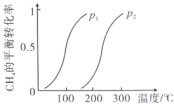
。一定条件下 的平衡转化率与温度、压强的关系如图a。则
的平衡转化率与温度、压强的关系如图a。则
______ 0,p2_____ p1(填“<”“>”或“=”)
(4)某实验小组设计如图b所示的甲醇燃料电池装置,工作一段时间后,正极区pH______ (填“增大”“减小”或“不变”)。 向U形管
向U形管_____ 端(填“左”或“右”)移动。

III.甲醇( )-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如下图:
)-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如下图:
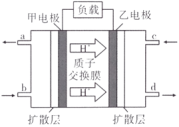
(5)图中右侧电极为电源____ 极,该电极的电极反应式为______ 。
(6)当电池消耗甲醇6.4g时,理论。上提供电子的物质的量为_____ mol。
I.已知由甲醇制得新型能源二甲醚(
 )为放热反应:
)为放热反应: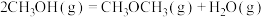

(1)


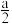 kJ/mol(填“>”“=”或“<”)
kJ/mol(填“>”“=”或“<”) II.甲醇也可用来制作甲醇燃料电池,完成下面填空。
(2)若电解质溶液为酸性介质
①负极电极反应式为
②总反应式为
③电解质溶液的pH
(3)生产甲醇的原料CO和
 来源于:
来源于:
 。一定条件下
。一定条件下 的平衡转化率与温度、压强的关系如图a。则
的平衡转化率与温度、压强的关系如图a。则

(4)某实验小组设计如图b所示的甲醇燃料电池装置,工作一段时间后,正极区pH
 向U形管
向U形管
III.甲醇(
 )-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如下图:
)-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如下图:
(5)图中右侧电极为电源
(6)当电池消耗甲醇6.4g时,理论。上提供电子的物质的量为
您最近一年使用:0次
8 . 研究CO、CO2的转化既可减少碳排放,又可获得许多实用的含碳物质。回答下列问题:
(1)以CO2、H2为原料,在铜基催化剂作用下可合成甲醇,反应如下(不考虑副反应):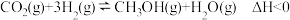 ,反应在恒容密闭容器中进行。反应时间一定,甲醇的产率随温度的变化如图所示(不考虑此过程中催化剂活性的变化)。
,反应在恒容密闭容器中进行。反应时间一定,甲醇的产率随温度的变化如图所示(不考虑此过程中催化剂活性的变化)。
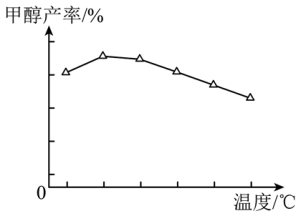
①该反应自发进行的条件是___________ (填“高温”“低温”或“任意温度”)。
②甲醇产率随温度升高先增大后减小的原因是___________ 。
(2)以CO、H2为原料在一定条件下也可合成甲醇,发生的反应如下:
主反应:
副反应:
一定条件下,向体积为V L的恒容密闭容器中投入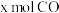 和
和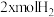 ,发生上述反应,平衡时容器内CH3OH的物质的量为
,发生上述反应,平衡时容器内CH3OH的物质的量为 ,C的物质的量为
,C的物质的量为 。则主反应的平衡常数K=
。则主反应的平衡常数K=___________ 。
(3)我国科学家设计 熔盐捕获与转化装置如图所示:
熔盐捕获与转化装置如图所示:
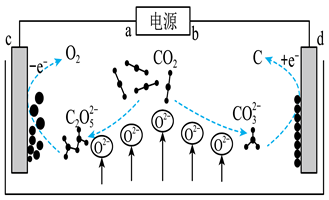
①d极的电极反应式为___________ 。
②若电源使用铅蓄电池,当电路中转移2 mol电子时,Pb电极的质量理论上___________ (填“增加”或“减少”)了____ g。
(4)水煤气变换是重要的化工过程,反应为: 。已知该反应的平衡常数K与热力学温度T的关系为
。已知该反应的平衡常数K与热力学温度T的关系为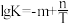 (m、n均为正数)。
(m、n均为正数)。
①水煤气变换是____ (填“吸热”或“放热”)反应。
②热力学温度为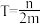 时,在恒温密闭容器中将等物质的量的CO和H2O(g)混合,选择适当的催化剂进行反应。平衡时体系中H2的物质的量分数为
时,在恒温密闭容器中将等物质的量的CO和H2O(g)混合,选择适当的催化剂进行反应。平衡时体系中H2的物质的量分数为 ,则
,则____ (填标号)。
A.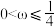 B.
B.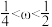 C.
C.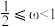
(1)以CO2、H2为原料,在铜基催化剂作用下可合成甲醇,反应如下(不考虑副反应):
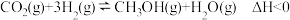 ,反应在恒容密闭容器中进行。反应时间一定,甲醇的产率随温度的变化如图所示(不考虑此过程中催化剂活性的变化)。
,反应在恒容密闭容器中进行。反应时间一定,甲醇的产率随温度的变化如图所示(不考虑此过程中催化剂活性的变化)。
①该反应自发进行的条件是
②甲醇产率随温度升高先增大后减小的原因是
(2)以CO、H2为原料在一定条件下也可合成甲醇,发生的反应如下:
主反应:

副反应:

一定条件下,向体积为V L的恒容密闭容器中投入
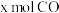 和
和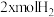 ,发生上述反应,平衡时容器内CH3OH的物质的量为
,发生上述反应,平衡时容器内CH3OH的物质的量为 ,C的物质的量为
,C的物质的量为 。则主反应的平衡常数K=
。则主反应的平衡常数K=(3)我国科学家设计
 熔盐捕获与转化装置如图所示:
熔盐捕获与转化装置如图所示:
①d极的电极反应式为
②若电源使用铅蓄电池,当电路中转移2 mol电子时,Pb电极的质量理论上
(4)水煤气变换是重要的化工过程,反应为:
 。已知该反应的平衡常数K与热力学温度T的关系为
。已知该反应的平衡常数K与热力学温度T的关系为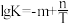 (m、n均为正数)。
(m、n均为正数)。①水煤气变换是
②热力学温度为
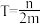 时,在恒温密闭容器中将等物质的量的CO和H2O(g)混合,选择适当的催化剂进行反应。平衡时体系中H2的物质的量分数为
时,在恒温密闭容器中将等物质的量的CO和H2O(g)混合,选择适当的催化剂进行反应。平衡时体系中H2的物质的量分数为 ,则
,则A.
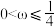 B.
B.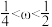 C.
C.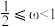
您最近一年使用:0次
9 . 减少氮的氧化物在大气中的排放是环境保护的重要内容。合理应用和处理氮及其化合物,在生产生活中有重要意义。
Ⅰ.雾霾严重影响人们的生活,雾霾的形成与汽车排放的NOx等有毒气体有关。
(1)在催化转化器中,汽车尾气中 CO和NO可发生反应2CO(g)+2NO(g)
CO和NO可发生反应2CO(g)+2NO(g) 2CO2(g)+N2(g),若在容积为10L的密闭容器中进行该反应,起始时充入0.4molCO、0.2molNO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
2CO2(g)+N2(g),若在容积为10L的密闭容器中进行该反应,起始时充入0.4molCO、0.2molNO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。

①实验b从开始至平衡时的反应速率v(CO)=_____ ;
②实验a中NO的平衡转化率为_____ 。
③与实验b相比,实验c改变的条件是_____ 。
Ⅱ.为减少汽车尾气的污染,逐步向着新能源汽车发展。肼—空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景,其工作原理如图所示,
(2)回答下列问题:

①该燃料电池中正极通入的物质是_____ ,负极发生的反应式为_____ 。
②电池工作时,OH-移向_____ 电极(填“a”或“b”)。
③当电池放电转移10mol电子时,至少消耗燃料肼_____ g。
(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向_____ (填“从a到b”或“从b到a”),负极发生的电极反应式为_____ 。

Ⅰ.雾霾严重影响人们的生活,雾霾的形成与汽车排放的NOx等有毒气体有关。
(1)在催化转化器中,汽车尾气中
 CO和NO可发生反应2CO(g)+2NO(g)
CO和NO可发生反应2CO(g)+2NO(g) 2CO2(g)+N2(g),若在容积为10L的密闭容器中进行该反应,起始时充入0.4molCO、0.2molNO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
2CO2(g)+N2(g),若在容积为10L的密闭容器中进行该反应,起始时充入0.4molCO、0.2molNO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
①实验b从开始至平衡时的反应速率v(CO)=
②实验a中NO的平衡转化率为
③与实验b相比,实验c改变的条件是
Ⅱ.为减少汽车尾气的污染,逐步向着新能源汽车发展。肼—空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景,其工作原理如图所示,
(2)回答下列问题:

①该燃料电池中正极通入的物质是
②电池工作时,OH-移向
③当电池放电转移10mol电子时,至少消耗燃料肼
(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向

您最近一年使用:0次
解题方法
10 . 硫氧化物易引起环境行染,需要悉心研究。
(1)二氧化硫可用于催化氧化制硫酸。硫酸工业中,作为催化剂的V2O5对反应I的催化循环过程经历了Ⅱ、Ⅲ两个反应阶段,如图所示:

下列分子中1mol化学键断裂时需要吸收的能量数据如下:
反应Ⅰ的△H=-98 kJ ·mol-1,则 a=____________ 。反应Ⅲ的化学方程式为______________ 。将2molSO2和1molO2充入密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) 2SO3(g)。平衡时SO3的体积分数(% )随温度和压强的变化如表所示:下列判断正确的是(
2SO3(g)。平衡时SO3的体积分数(% )随温度和压强的变化如表所示:下列判断正确的是(_____________ )
A.b >e
B.415℃、2.0MPa时O2的转化率为60%
C.在一定温度和压强下,加入V2O5作催化剂能加快反应速率,提高SO3的体积分数
D.平衡常数K(550℃)>K(350℃)
(2)较纯的SO2,可用于原电池法生产硫酸。图中离子交换膜是________ 离子交换膜(填“阴”、“阳”)。

(3)研究发现,含碱式硫酸铝的溶液与SO2结合的方式有2种:其一是与溶液中的水结合。其二是与碱式硫酸铝中的活性Al2O3结合,通过酸度计测定吸收液的pH变化,结果如右图所示:
请解释曲线如图变化的原因_______________________________ 。
(4)取五等份SO3,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:3SO3(g) (SO3)3(g) △H<0,反应相同时间后,分别测定体系中SO3的百分含量,并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是(
(SO3)3(g) △H<0,反应相同时间后,分别测定体系中SO3的百分含量,并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是(_____ )

(5)用Na2SO3溶液作为吸收液吸收SO2时,产物为NaHSO3,已知亚硫酸的两级电离平衡常数分别为Ka1、Ka2。则常温下NaHSO3溶液显酸性的充要条件为_____________ 。(用含为Ka1、Ka2的代数式表示)
(1)二氧化硫可用于催化氧化制硫酸。硫酸工业中,作为催化剂的V2O5对反应I的催化循环过程经历了Ⅱ、Ⅲ两个反应阶段,如图所示:

下列分子中1mol化学键断裂时需要吸收的能量数据如下:
| 化学键 | S=O(SO2) | S=O(SO3) | O=O(O2) |
| 能量/kJ | 535 | a | 496 |
 2SO3(g)。平衡时SO3的体积分数(% )随温度和压强的变化如表所示:下列判断正确的是(
2SO3(g)。平衡时SO3的体积分数(% )随温度和压强的变化如表所示:下列判断正确的是(| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 350 | 5.0 | a | b |
| 415 | c | 40.0 | d |
| 550 | e | f | 36.0 |
B.415℃、2.0MPa时O2的转化率为60%
C.在一定温度和压强下,加入V2O5作催化剂能加快反应速率,提高SO3的体积分数
D.平衡常数K(550℃)>K(350℃)
(2)较纯的SO2,可用于原电池法生产硫酸。图中离子交换膜是

(3)研究发现,含碱式硫酸铝的溶液与SO2结合的方式有2种:其一是与溶液中的水结合。其二是与碱式硫酸铝中的活性Al2O3结合,通过酸度计测定吸收液的pH变化,结果如右图所示:

请解释曲线如图变化的原因
(4)取五等份SO3,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:3SO3(g)
 (SO3)3(g) △H<0,反应相同时间后,分别测定体系中SO3的百分含量,并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是(
(SO3)3(g) △H<0,反应相同时间后,分别测定体系中SO3的百分含量,并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是(
(5)用Na2SO3溶液作为吸收液吸收SO2时,产物为NaHSO3,已知亚硫酸的两级电离平衡常数分别为Ka1、Ka2。则常温下NaHSO3溶液显酸性的充要条件为
您最近一年使用:0次
2018-04-22更新
|
317次组卷
|
2卷引用:湖北省武汉市第六中学2019届高三上学期12月月考理科综合化学试题







