名校
解题方法
1 . 人造地球卫星用到的一种高能电池——银锌蓄电池,其电池的总反应为:Zn+Ag2O=ZnO+2Ag。据此判断氧化银是
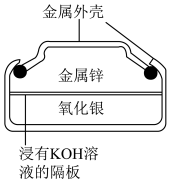
| A.负极,被氧化 | B.正极,被还原 |
| C.负极,被还原 | D.正极,被氧化 |
您最近一年使用:0次
2023-08-04更新
|
268次组卷
|
3卷引用:陕西省宝鸡市金台区2022-2023学年高一下学期期末考试化学试题
解题方法
2 . I.把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应: ,经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算:
,经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算:
(1)B的转化率___________ 。
(2)恒温达平衡时容器内的压强与开始时压强比___________ 。
Ⅱ.化学电池在通讯,交通及日常生活中有着广泛的应用。
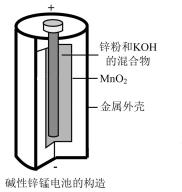
(3)碱性锌锰干电池(如图所示)是应用最普遍的电池之一,电池总反应为 ,碱性锌锰干电池的负极材料是
,碱性锌锰干电池的负极材料是___________ (填名称),负极上发生的电极反应为___________ 。若反应消耗13g负极材料,则电池中转移电子的物质的量为___________ mol。
(4)铅蓄电池是典型的可充电电池,它的正、负极格板都是惰性材料,电池总反应式为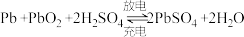 。下列说法正确的是___________(填标号)。
。下列说法正确的是___________(填标号)。
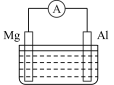
(5)镁铝电池的构造如图所示,当电解质溶液为NaOH溶液时,可知电池的负极材料为_______ (填“Mg”或“Al”),正极上的电极反应式为___________ 。
 ,经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算:
,经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算:(1)B的转化率
(2)恒温达平衡时容器内的压强与开始时压强比
Ⅱ.化学电池在通讯,交通及日常生活中有着广泛的应用。
(3)碱性锌锰干电池(如图所示)是应用最普遍的电池之一,电池总反应为
 ,碱性锌锰干电池的负极材料是
,碱性锌锰干电池的负极材料是
(4)铅蓄电池是典型的可充电电池,它的正、负极格板都是惰性材料,电池总反应式为
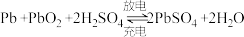 。下列说法正确的是___________(填标号)。
。下列说法正确的是___________(填标号)。| A.电解液中H2SO4的浓度始终保持不变 |
B.放电时正极上的电极反应式为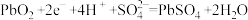 |
| C.放电时,当外电路通过1mol电子时,理论上负极质量增加48g |
D.放电时,溶液中的 向正极移动 向正极移动 |

您最近一年使用:0次
名校
解题方法
3 . 人们常常利用化学反应中的能量变化为人类服务。
(1)下列化学反应在理论上可以设计成原电池的是___________(填字母)。
(2)如图是某兴趣小组设计的原电池示意图,实验结束后,在实验报告上记录信息如下。
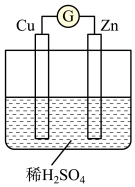
①实验报告中记录合理的是___________ (填字母)。
②请写出该电池的负极反应式:___________ 。
③将稀 换成
换成 溶液,电极质量增加的是
溶液,电极质量增加的是___________ (填“锌极”或“铜极”,下同),溶液中 移向
移向___________ 。
(1)下列化学反应在理论上可以设计成原电池的是___________(填字母)。
A.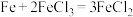 | B.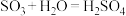 |
C.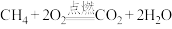 | D.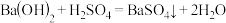 |

| a.电流计指针偏转 |
b.Cu极有 产生 产生 |
c. 向负极移动 向负极移动 |
| d.电流由Zn经导线流向Cu |
②请写出该电池的负极反应式:
③将稀
 换成
换成 溶液,电极质量增加的是
溶液,电极质量增加的是 移向
移向
您最近一年使用:0次
2023-07-12更新
|
313次组卷
|
2卷引用:陕西省安康市汉滨区七校2022-2023学年高一下学期期末考试化学试题
解题方法
4 . 关于原电池,下列叙述中正确的是
| A.原电池的正极和负极必须是两种活动性不同的金属 |
| B.活泼金属电极一定作负极 |
| C.电子流出的一极为负极 |
| D.正极上发生还原反应,一定产生气体 |
您最近一年使用:0次
5 . 习近平总书记提出我国要在2030年实现“碳达峰”,2060年前实现“碳中和”。某科研小组用电化学方法将 转化为
转化为 实现再利用,转化的基本原理如图所示。下列说法不正确的是
实现再利用,转化的基本原理如图所示。下列说法不正确的是
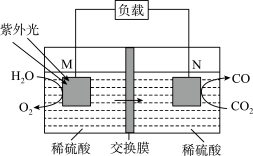
 转化为
转化为 实现再利用,转化的基本原理如图所示。下列说法不正确的是
实现再利用,转化的基本原理如图所示。下列说法不正确的是
| A.该装置能将化学能转化为电能 |
B. 上的电极反应方程式为 上的电极反应方程式为 |
C.工作一段时间后, 电极室中的溶液 电极室中的溶液 减小 减小 |
D.当转化 时,外电路中转移的电子数为 时,外电路中转移的电子数为 |
您最近一年使用:0次
名校
解题方法
6 . 锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:

(1)外电路的电流方向是由_________ 极流向_________ 极.(填字母)
(2)电池正极反应式为_________ 。

(1)外电路的电流方向是由
(2)电池正极反应式为
您最近一年使用:0次
名校
7 . 某原电池装置如图所示,装置中盐桥的作用是使整个装置形成一个闭合回路,电解质溶液足量,闭合开关,观察到电流计指针发生偏转,回答下列问题。
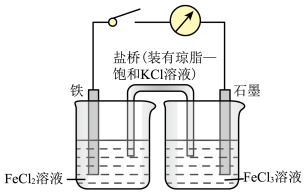
(1)该原电池工作过程中,电池的负极上的电极反应式为___________ ,石墨电极上发生了___________ (填“氧化”或“还原”)反应。
(2)该原电池工作时,下列说法正确的是___________(填标号)。
(3)当铁电极减少 时,外电路中转移的电子数目为
时,外电路中转移的电子数目为___________  ,右侧烧杯中
,右侧烧杯中 的物质的量改变了
的物质的量改变了___________  。
。
(4)原电池工作时能量转化形式为_______ ,根据原电池形成条件,下列反应理论上可以设计成原电池的是_______ (填标号)。
A. 与
与 的反应 B.
的反应 B. 和
和 的反应
的反应
C. 和
和 的反应 D.
的反应 D. 和
和 的反应
的反应
(5)以 为原理设计燃枓电池,其利用率高,装置如图所示。
为原理设计燃枓电池,其利用率高,装置如图所示。
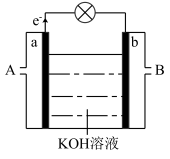
①A处加入的是___________ ,a处的电极反应式是_______ 。
②当消耗标准状况下3.36L 时,导线上转移的电子的物质的量是
时,导线上转移的电子的物质的量是___________ mol。

(1)该原电池工作过程中,电池的负极上的电极反应式为
(2)该原电池工作时,下列说法正确的是___________(填标号)。
A.电子移动的方向:石墨 铁 铁 |
B.盐桥中的 会向右侧烧杯移动 会向右侧烧杯移动 |
C. 溶液的颜色会逐渐变浅 溶液的颜色会逐渐变浅 |
D.将 盐桥换成 盐桥换成 盐桥,该装置不能长时间正常工作 盐桥,该装置不能长时间正常工作 |
 时,外电路中转移的电子数目为
时,外电路中转移的电子数目为 ,右侧烧杯中
,右侧烧杯中 的物质的量改变了
的物质的量改变了 。
。(4)原电池工作时能量转化形式为
A.
 与
与 的反应 B.
的反应 B. 和
和 的反应
的反应C.
 和
和 的反应 D.
的反应 D. 和
和 的反应
的反应(5)以
 为原理设计燃枓电池,其利用率高,装置如图所示。
为原理设计燃枓电池,其利用率高,装置如图所示。
①A处加入的是
②当消耗标准状况下3.36L
 时,导线上转移的电子的物质的量是
时,导线上转移的电子的物质的量是
您最近一年使用:0次
名校
解题方法
8 . 化学电源在生活中有广泛的应用,各种电池的示意图如下,下列有关说法正确的是
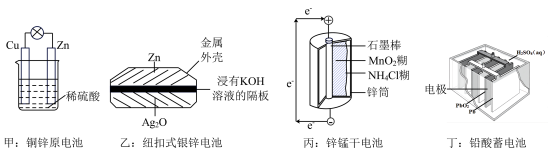
| A.甲:电子由铜片经导线流向锌片 |
B.乙:负极的电极反应式为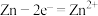 |
| C.丙:锌筒作负极,发生氧化反应,使用一段时间锌筒会变薄 |
| D.丁:使用一段时间后电解质溶液的酸性增强,导电能力增大 |
您最近一年使用:0次
2023-05-31更新
|
162次组卷
|
4卷引用:陕西西安三中2022-2023学年高一下学期第二次月考化学试题
陕西西安三中2022-2023学年高一下学期第二次月考化学试题贵州省贵阳市三新改革联盟校2022-2023学年高一下学期5月联考化学试题吉林省四平市第一高级中学2023-2024学年高一下学期第一次月考化学试题(已下线)2019年高考浙江卷化学试题变式题(单选题11-15)
名校
9 . 铁镍蓄电池又称爱迪生电池,放电时的总反应为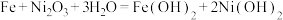 。下列有关该电池的说法不正确的是
。下列有关该电池的说法不正确的是
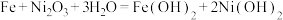 。下列有关该电池的说法不正确的是
。下列有关该电池的说法不正确的是A.电池的电解液为碱性溶液,正极为 、负极为Fe 、负极为Fe |
B.电池放电时,负极反应为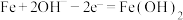 |
C.电池放电时,电子经电解质溶液流入 一极 一极 |
D.电池放电时, 在正极上被还原 在正极上被还原 |
您最近一年使用:0次
2023-05-25更新
|
244次组卷
|
3卷引用:陕西省商洛市洛南中学2022-2023学年高一下学期4月期中考试化学试题
名校
10 . 按要求回答问题:
(1)由SiO2制备高纯度硅的工业流程如图所示:
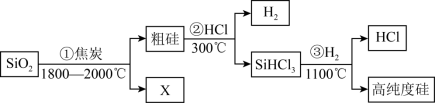
①写出SiO2转化为Si(粗)的化学方程式:____________________________________________ 。
②可以循环使用的物质为_________________________ 。
(2)为了有效实现NO和NO2的相互转化,设计如图实验:按图组装好实验装置,并检查装置气密性,实验前用排水法收集半瓶NO气体。
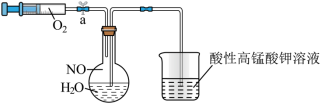
①打开止水夹,推动针筒活塞,使氧气进入烧瓶,首先观察到烧瓶中的现象是____________ ,产生此现象的化学方程式为______________________________________________ 。
②关上止水夹,轻轻摇动烧瓶,写出发生的化学方程式________________________________ 。
(3)以 Fe 和 Cu 为电极,稀 H2SO4 为电解质溶液形成的原电池中:
①H+向________ 极移动(填“正”或“负”)。
②若有 1 mol e- 流过导线,则理论上负极质量减少________ g。
③若将稀硫酸换成浓硝酸,正极电极方程式为:______________________ 。
(1)由SiO2制备高纯度硅的工业流程如图所示:

①写出SiO2转化为Si(粗)的化学方程式:
②可以循环使用的物质为
(2)为了有效实现NO和NO2的相互转化,设计如图实验:按图组装好实验装置,并检查装置气密性,实验前用排水法收集半瓶NO气体。

①打开止水夹,推动针筒活塞,使氧气进入烧瓶,首先观察到烧瓶中的现象是
②关上止水夹,轻轻摇动烧瓶,写出发生的化学方程式
(3)以 Fe 和 Cu 为电极,稀 H2SO4 为电解质溶液形成的原电池中:
①H+向
②若有 1 mol e- 流过导线,则理论上负极质量减少
③若将稀硫酸换成浓硝酸,正极电极方程式为:
您最近一年使用:0次
2023-05-18更新
|
326次组卷
|
2卷引用:陕西延安中学2022-2023学年高一下学期期中考试化学试题



