1 . 原电池是直接把化学能转化为电能的装置。
(1)如图所示:按照构成原电池的基本要素来看,Zn的作用是(填字母,下同)____ ;稀硫酸的作用是________ 。
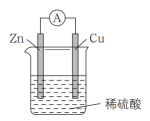
a.负极反应物 b.负极材料 c.正极反应物
d.正极材料 e.离子导体 f.电子导体
(2) ①在Cu-Zn原电池中,Zn片上发生________ 反应(填“氧化”或“还原”)。Cu片上发生的电极反应为________ 。
②外电路中电子流向_____ 极;内电路溶液中SO 移向
移向___ 极。
③能证明化学能转化为电能的实验现象为________ 。
(3)某原电池的总反应为Zn+Cu2+=Cu+Zn2+,该原电池正确的组成是__ 。

(4)从化学的角度分析,原电池装置产生电流的原因是:原电池可将________ ,并通过能导电的物质形成闭合回路,产生电流。
(1)如图所示:按照构成原电池的基本要素来看,Zn的作用是(填字母,下同)

a.负极反应物 b.负极材料 c.正极反应物
d.正极材料 e.离子导体 f.电子导体
(2) ①在Cu-Zn原电池中,Zn片上发生
②外电路中电子流向
 移向
移向③能证明化学能转化为电能的实验现象为
(3)某原电池的总反应为Zn+Cu2+=Cu+Zn2+,该原电池正确的组成是

(4)从化学的角度分析,原电池装置产生电流的原因是:原电池可将
您最近一年使用:0次
解题方法
2 . 实验小组的同学们将三种金属按照下表的装置进行实验。回答问题:
(1)装置甲中铁极的电极反应式是____________ ,溶液中H+向_____ 极移动(填“正”或“负”)。
(2)装置乙中铜极发生____________ (填“氧化”或“还原”)反应。
(3)装置丙中M极为______ (填“正极”或“负极”),一段时间后溶液的酸性_____________ (填“增强”“减弱”或“不变”)。
(4)Fe、Cu、M中金属活动性最强的是_____________ 。
| 序号 | 甲 | 乙 | 丙 |
| 装置 |  | 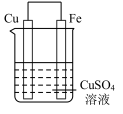 | 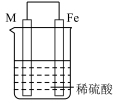 |
| 现象 | 溶液变为浅绿色,Cu极产生大量气泡 | Cu极的质量增加 | M极的质量减少 |
(1)装置甲中铁极的电极反应式是
(2)装置乙中铜极发生
(3)装置丙中M极为
(4)Fe、Cu、M中金属活动性最强的是
您最近一年使用:0次
2020-08-08更新
|
115次组卷
|
3卷引用:青海省西宁市2019-2020学年高一下学期期末调研测试化学试题
名校
解题方法
3 . (1)我国是世界上最早使用湿法炼铜的国家。湿法炼铜的原理是Fe+CuSO4=FeSO4+Cu,其中铁被__________ (填“氧化”或“还原”),CuSO4作________ (填“氧化”或“还原”)剂。在该反应中,若生成了1 mol Cu,消耗Fe的物质的量是_________ 。
(2)某学习小组设计下图所示装置观察氧化还原反应中电子的转移。
①实验Ⅰ中,Fe与CuSO4溶液反应的离子方程式是______________ 。
②根据实验Ⅰ的原理,推测实验Ⅱ中:锌片上发生_________ (填“氧化”或“还原”)反应;铜片上的实验现象是__________ 。
(2)某学习小组设计下图所示装置观察氧化还原反应中电子的转移。
| 实验Ⅰ | 实验Ⅱ | |
| 装置 | 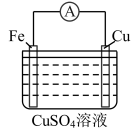 | 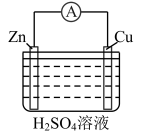 |
| 现象 | 电流计指针向右偏转;铁片溶解; 铜片上有红色物质(铜)析出,铜片质量增加 | 电流计指针向右偏转;…… |
①实验Ⅰ中,Fe与CuSO4溶液反应的离子方程式是
②根据实验Ⅰ的原理,推测实验Ⅱ中:锌片上发生
您最近一年使用:0次
4 . (1)下列装置属于原电池的是___________ ;
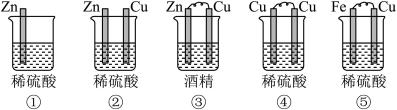
(2)在选出的原电池中,______ 是负极,发生______ (氧化、还原) 反应 ,______ 是正极 ,该极的现象___________________________ ;
(3)在该原电池的内电路中,硫酸根离子移向_________ (正、负)极。
(4)此原电池反应的化学方程式为___________________________ 。

(2)在选出的原电池中,
(3)在该原电池的内电路中,硫酸根离子移向
(4)此原电池反应的化学方程式为
您最近一年使用:0次
5 . 锌铜——稀硫酸原电池的装置如图所示,下列叙述错误的是
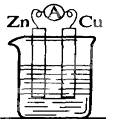

| A.电流从锌片经导线流向铜片 | B.锌是负极,其质量逐渐减小 |
| C.氢离子在铜表面被还原,产生气泡 | D.依据该实验现象可判断锌比铜活泼 |
您最近一年使用:0次
2018-07-04更新
|
114次组卷
|
2卷引用:【全国市级联考】湖北省襄阳市2017-2018学年高一下学期期末调研统一考试化学试题
名校
6 . 如图所示,下图是原电池的装置图。请回答:___________ ;溶液中的阴离子移向___________ (填“A”或“B”),反应进行一段时间后溶液C的pH___________ (填“升高”“降低”或“基本不变”)。
(2)若需将反应Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A极(负极)材料为___________ ,B极电极反应式为___________ 。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:___________ ,写出电极d的电极反应为___________ 。

(2)若需将反应Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A极(负极)材料为
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:

您最近一年使用:0次
名校
7 . 化学反应同时伴随着能量变化,是人类获取能量的重要途径。以下是常见的化学反应,回答(1)和(2)。 晶体与
晶体与 晶体反应
晶体反应
c.氢氧化钠与盐酸反应 d.盐酸与碳酸氢钠反应
(1)以上化学反应中能用上图表示其能量变化的是______ (填字母),此类反应中有能量变化的原因是:断开反应物的化学键吸收的总能量______ (填“>”或“<”)形成生成物的化学键释放的总能量。
(2)从以上反应中选择一个反应设计原电池。
①将如图原电池装置补充完整______ 。
②证实化学能转化为电能的实验现象是______ .
③正极的电极反应式是______ .______ .
(4) 还原
还原 电化学法制备
电化学法制备 (甲醇)的工作原理如图所示。通入
(甲醇)的工作原理如图所示。通入 的一端是电池的
的一端是电池的______ 极(填“正”或“负”),通入 的一端发生的电极反应式为
的一端发生的电极反应式为______ 。生成 甲醇时,转移
甲醇时,转移______  电子。
电子。
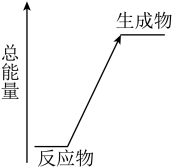
 晶体与
晶体与 晶体反应
晶体反应c.氢氧化钠与盐酸反应 d.盐酸与碳酸氢钠反应
(1)以上化学反应中能用上图表示其能量变化的是
(2)从以上反应中选择一个反应设计原电池。
①将如图原电池装置补充完整
②证实化学能转化为电能的实验现象是
③正极的电极反应式是
(4)
 还原
还原 电化学法制备
电化学法制备 (甲醇)的工作原理如图所示。通入
(甲醇)的工作原理如图所示。通入 的一端是电池的
的一端是电池的 的一端发生的电极反应式为
的一端发生的电极反应式为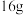 甲醇时,转移
甲醇时,转移 电子。
电子。
您最近一年使用:0次
名校
解题方法
8 . I.由A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________ 。
(2)装置乙中正极的电极反应式是________________________________________ 。
(3)四种金属活泼性由强到弱的顺序是______________________ 。
II.分别按图所示甲、乙装置进行实验,图中两个烧杯中的溶液为相同浓度的稀硫酸,甲中A为电流表。
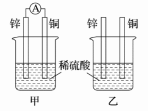
(1)下列叙述正确的是________ 。
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片作正极,乙中铜片作负极
C.两烧杯中溶液中的H+浓度均减小 D.产生气泡的速率甲中的比乙中的慢
(2)甲装置中,某同学发现不仅铜片上有气泡产生,锌片上也产生了气体,原因可能是________________________________________________________________________ 。
(3)甲装置中,若把稀硫酸换成CuSO4溶液,试写出铜电极的电极反应________________________ 。
| 装置 |  | 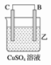 | 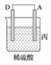 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是
(2)装置乙中正极的电极反应式是
(3)四种金属活泼性由强到弱的顺序是
II.分别按图所示甲、乙装置进行实验,图中两个烧杯中的溶液为相同浓度的稀硫酸,甲中A为电流表。

(1)下列叙述正确的是
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片作正极,乙中铜片作负极
C.两烧杯中溶液中的H+浓度均减小 D.产生气泡的速率甲中的比乙中的慢
(2)甲装置中,某同学发现不仅铜片上有气泡产生,锌片上也产生了气体,原因可能是
(3)甲装置中,若把稀硫酸换成CuSO4溶液,试写出铜电极的电极反应
您最近一年使用:0次
2018-07-17更新
|
615次组卷
|
4卷引用:【全国百强校】黑龙江省哈尔滨市第六中学2017-2018学年高一下学期期末考试化学试题
名校
解题方法
9 . 人们应用原电池原理制作了多种电池,以满足不同的需要。请回答下列问题。
(1)请你利用下列反应 设计一个化学电池,该电池的负极材料是
设计一个化学电池,该电池的负极材料是_______ ,电解质溶液是_______ 。
(2)“神舟九号”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。在紧急状况下,应急电池会自动启动,工作原理为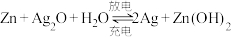 ,其正极的电极反应式为
,其正极的电极反应式为_______ 。
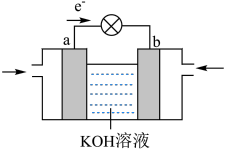
(3)目前正在研发的高能量密度燃料电池车,是以肼( )燃料电池作为动力来源,电池结构如图所示。
)燃料电池作为动力来源,电池结构如图所示。 溶液浓度相同,工作一段时间后,
溶液浓度相同,工作一段时间后, 浓度较大的是
浓度较大的是_______ (填“正”或“负”)极区。
②该电池负极的电极反应式为_______ 。
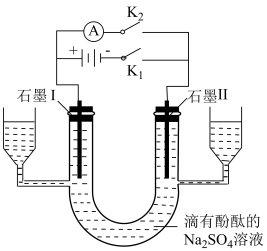
(4)利用如图所示装置探究氢氧燃料电池的工作原理。 、
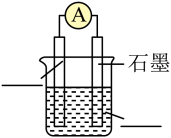
、 :打开
:打开 ,闭合
,闭合 ,连接电池负极的石墨Ⅱ为
,连接电池负极的石墨Ⅱ为_______ (填“阳极”或“阴极”),阳极的电极反应式为_______ ;_______ (填“石墨Ⅰ”或“石墨Ⅱ”)附近的溶液变红。
②探究燃料电池的工作原理:在上述实验①结束后,立即打开 ,闭合
,闭合 ,可以观察到电流表指针偏转,则外电路中电子的流动方向是
,可以观察到电流表指针偏转,则外电路中电子的流动方向是_______ (填“石墨Ⅱ流向石墨Ⅰ”或“石墨Ⅰ流向石墨Ⅱ”);负极的电极反应式是_______ 。
(1)请你利用下列反应
 设计一个化学电池,该电池的负极材料是
设计一个化学电池,该电池的负极材料是(2)“神舟九号”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。在紧急状况下,应急电池会自动启动,工作原理为
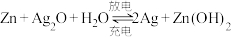 ,其正极的电极反应式为
,其正极的电极反应式为(3)目前正在研发的高能量密度燃料电池车,是以肼(
 )燃料电池作为动力来源,电池结构如图所示。
)燃料电池作为动力来源,电池结构如图所示。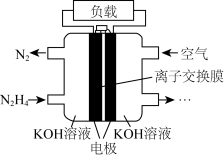
 溶液浓度相同,工作一段时间后,
溶液浓度相同,工作一段时间后, 浓度较大的是
浓度较大的是②该电池负极的电极反应式为
(4)利用如图所示装置探究氢氧燃料电池的工作原理。
 、
、 :打开
:打开 ,闭合
,闭合 ,连接电池负极的石墨Ⅱ为
,连接电池负极的石墨Ⅱ为②探究燃料电池的工作原理:在上述实验①结束后,立即打开
 ,闭合
,闭合 ,可以观察到电流表指针偏转,则外电路中电子的流动方向是
,可以观察到电流表指针偏转,则外电路中电子的流动方向是
您最近一年使用:0次
名校
解题方法
10 . 某化学研究性学习小组针对原电池形成条件,设计了实验方案,进行如下探究。
(1)请填写有关实验现象并得出相关结论。
①通过实验2和3,可得出原电池的形成条件是______________________________ 。
②通过实验1和3,可得出原电池的形成条件是______________________________ 。
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是___________________ 。
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:______________________________ 。
Cu棒:______________________________ 。
(3)实验3的电流是从________ 棒流出(填“Zn”或“Cu”),反应过程中若有0.4mol电子发生了转移,则Zn电极质量减轻___________ g。
(1)请填写有关实验现象并得出相关结论。
| 编号 | 实验装置 | 实验现象 |
| 1 | 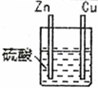 | 锌棒逐渐溶解,表面有气体生成;铜棒表面无现象 |
| 2 | 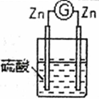 | 两锌棒逐渐溶解,表面均有气体生成;电流计指针不偏转 |
| 3 | 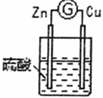 | 铜棒表面的现象是 |
①通过实验2和3,可得出原电池的形成条件是
②通过实验1和3,可得出原电池的形成条件是
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:
Cu棒:
(3)实验3的电流是从
您最近一年使用:0次
2018-07-16更新
|
645次组卷
|
6卷引用:【全国市级联考】河北省唐山市2017-2018学年高一下学期期末考试(A)化学试题



