23-24高一下·全国·课前预习
解题方法
1 . 化学能
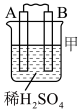
(1)如图所示,请写出锌与稀硫酸反应的化学方程式___________ 。
(2)装置中锌片上发生___________ (“氧化”或“还原”)反应,能证明化学能转化为电能的实验现象为___________ 。装置中锌片表面如何变化___________ ?电流表是否偏转___________ ?
(3)Cu的作用是___________ 。
a.离子导体 b.电子导体

(1)如图所示,请写出锌与稀硫酸反应的化学方程式
(2)装置中锌片上发生
(3)Cu的作用是
a.离子导体 b.电子导体
您最近半年使用:0次
2 . 能源是现代文明的原动力,电池与我们的生活和生产密切相关。
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的_____(填字母)。
(2)下图为原电池装置示意图:
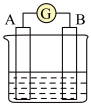
①若A为 片,B为石墨棒,电解质溶液为稀硫酸,写出负极的电极反应式:
片,B为石墨棒,电解质溶液为稀硫酸,写出负极的电极反应式:_____ ,反应过程中溶液的酸性_____ (填“增强”、“减弱”或“不变”)。一段时间后,当电池中放出2.24L(标准状况)气体时,电路中有_____ 个电子通过了导线(用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
②若A为镁片,B为铝片,电解质为 溶液,则铝片为
溶液,则铝片为_____ (填“正极”或“负极”);写出该电极的电极反应式:_____ 。
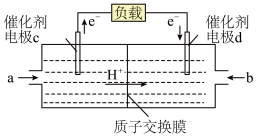
(3)燃料电池是一种具有应用前景的绿色电源, 和
和 组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许
组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许 通过)。则电极d是
通过)。则电极d是_____ (填“正极”或“负极”),则该燃料电池如下:
(4)为证明铁的金属活动性比铜强,某同学设计了如下一些方案。其中能证明铁的金属活动性比铜强的方案是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的_____(填字母)。
A. |
B.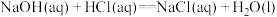 |
C.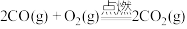 |
D. |

①若A为
 片,B为石墨棒,电解质溶液为稀硫酸,写出负极的电极反应式:
片,B为石墨棒,电解质溶液为稀硫酸,写出负极的电极反应式: 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。②若A为镁片,B为铝片,电解质为
 溶液,则铝片为
溶液,则铝片为(3)燃料电池是一种具有应用前景的绿色电源,
 和
和 组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许
组合形成的燃料电池的结构如图(电解质溶液是稀硫酸,质子交换膜只允许 通过)。则电极d是
通过)。则电极d是
(4)为证明铁的金属活动性比铜强,某同学设计了如下一些方案。其中能证明铁的金属活动性比铜强的方案是
| 方案 | 现象或产物 |
A.将铁片置于 溶液中 溶液中 | 铁片上有亮红色物质析出 |
| B.将铁丝和铜丝分别在氯气燃烧 | 产物分别为 和 和 |
| C.将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡产生,铜片上无气泡产生 |
| D.将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连 | 铁片溶解,铜片上有气泡产生 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
3 . 人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用。请根据题中提供的信息,回答下列问题:
(1)直接提供电能的反应一般是放热反应,下列反应能设计成原电池的是_______(填字母,下同)。
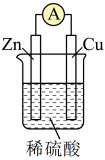
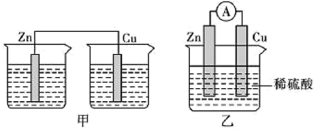
(2)为了探究原电池的工作原理,某研究性学习小组进行了如下实验。分别按图1中甲、乙所示装置进行实验,甲中两个烧杯中的溶液为同浓度的稀硫酸。_______ (填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两装置中铜片表面均有气泡产生
C.乙的外电路中电流方向Cu→Zn
D.如果将装置乙中锌片换成铁片,则电路中的电流方向不变
②在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是_______ 。
③在乙实验中,如果把硫酸换成硫酸铜溶液,可观察到正极_______ (填实验现象),其对应的电极反应式为_______ 。
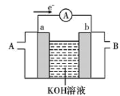
(3)某氢氧燃料电池装置如图所示,a、b均为惰性电极。_______ (填“A”或“B”)口通入。
②负极上的电极反应式为_______ ,当电路中转移 电子时,理论上负极通入的气体在标准状况下的体积为
电子时,理论上负极通入的气体在标准状况下的体积为_______ L。
(1)直接提供电能的反应一般是放热反应,下列反应能设计成原电池的是_______(填字母,下同)。
A. 与 与 反应 反应 | B.氢氧化钠与稀盐酸反应 |
C.灼热的炭与 反应 反应 | D. 与 与 燃烧反应 燃烧反应 |
A.甲中锌片是负极,乙中铜片是正极
B.两装置中铜片表面均有气泡产生
C.乙的外电路中电流方向Cu→Zn
D.如果将装置乙中锌片换成铁片,则电路中的电流方向不变
②在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是
③在乙实验中,如果把硫酸换成硫酸铜溶液,可观察到正极
(3)某氢氧燃料电池装置如图所示,a、b均为惰性电极。
②负极上的电极反应式为
 电子时,理论上负极通入的气体在标准状况下的体积为
电子时,理论上负极通入的气体在标准状况下的体积为
您最近半年使用:0次
名校
4 . 由A、B、C、D四种金属按下表中装置进行实验。
根据实验现象判断下列说法错误 的是
| 装置 |
|
|
|
| 现象 | A上有气体产生 | B的质量增加 | 二价金属A不断溶解 |
A.装置甲中正极的电极反应式是: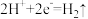 |
| B.装置乙中B为负极 |
| C.四种金属的活泼性强弱顺序为:C>B>A>D |
D.装置丙中负极电极反应式为: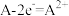 |
您最近半年使用:0次
解题方法
5 . 电能是现代社会应用最广泛的能源之一。
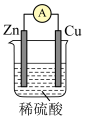
(1)某原电池装置如图所示。其中, 电极为原电池的
电极为原电池的_____ 极(填“正”或“负”),电解质溶液中的阴离子向_____ 极(填“铜”或“锌”)移动,铜极上的现象_____ 。
(2) 电极的电极反应式是
电极的电极反应式是_____ 。
(3) 电极上发生的反应属于
电极上发生的反应属于_____ (填“氧化”或“还原”)反应。
(4)当铜表面析出 氢气(标准状况)时,导线中通过了
氢气(标准状况)时,导线中通过了_____  电子。
电子。
(5)下列反应通过原电池装置,不能实现化学能直接转化为电能的是_____ (填序号)。
①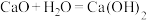 ②
② ③
③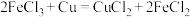

(1)某原电池装置如图所示。其中,
 电极为原电池的
电极为原电池的(2)
 电极的电极反应式是
电极的电极反应式是(3)
 电极上发生的反应属于
电极上发生的反应属于(4)当铜表面析出
 氢气(标准状况)时,导线中通过了
氢气(标准状况)时,导线中通过了 电子。
电子。(5)下列反应通过原电池装置,不能实现化学能直接转化为电能的是
①
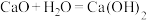 ②
② ③
③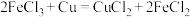
您最近半年使用:0次
2023高二上·全国·专题练习
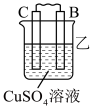
6 . 锌铜原电池的工作原理
(1)ZnZnSO4半电池:在ZnSO4溶液中,锌片逐渐溶解,即Zn被_______ ,锌原子失去电子,形成Zn2+进入溶液,即Zn-2e-=Zn2+;从锌片上释放出的_______ ,经过导线流向铜片。
(2)CuCuSO4半电池:CuSO4溶液中的Cu2+从铜片上得到_______ ,_______ 为铜单质并沉积在铜片上,即Cu2++2e-=Cu。
(3)盐桥的作用:电池工作时,盐桥中的_______ 会移向ZnSO4溶液,_______ 移向CuSO4溶液,使两溶液均保持电中性。当取出盐桥后,形成断路,反应停止。
| 装置示意图 | 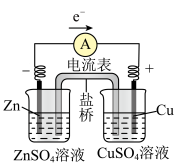 注:盐桥中装有含KCl饱和溶液的琼胶 |
| 现象 | 锌片 |
| 能量转换 | |
| 微观探析 | 在硫酸锌溶液中,负极一端的 在硫酸铜溶液中,正极一端的 |
| 电子或离子移动方向 | 电子: 盐桥: |
| 工作原理,电极反应式 | 负极:Zn-2e-=Zn2+( 正极:Cu2++2e-=Cu( |
| 总反应:Zn+Cu2+=Zn2++Cu |
(2)CuCuSO4半电池:CuSO4溶液中的Cu2+从铜片上得到
(3)盐桥的作用:电池工作时,盐桥中的
您最近半年使用:0次
名校
解题方法
7 . 化学能在一定条件下可转化为电能。
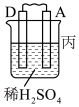
(1)如图所示为“锌-铜-稀硫酸”原电池,请写出锌与稀硫酸反应的离子方程式是___________ 。
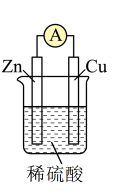
(2)装置中锌片上发生___________ (“氧化”或“还原”)反应,电极反应式是___________ ,铜片上发生反应的电极反应式是________ ,能证明化学能转化为电能的实验现象为_________ 。
(3)按照电化学装置的四个构成要素来看,Cu的作用是________ ,稀硫酸的作用是___________ 。
a.电极反应物 b.电极材料 c.离子导体 d.电子导体
(1)如图所示为“锌-铜-稀硫酸”原电池,请写出锌与稀硫酸反应的离子方程式是

(2)装置中锌片上发生
(3)按照电化学装置的四个构成要素来看,Cu的作用是
a.电极反应物 b.电极材料 c.离子导体 d.电子导体
您最近半年使用:0次
8 . Ⅰ.由A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是_______ 。
(2)装置乙中正极的电极反应式是_______ 。
(3)装置丙中溶液的pH变化是_______ 。
(4)四种金属活动性由强到弱的顺序是_______ 。
Ⅱ.今有下列物质:
①甲烷 ②乙烷 ③乙烯 ④苯 ⑤苯乙烯 ⑥分馏汽油
(5)常温下呈气态的是_______ 。
(6)属于芳香烃的是_______ 。
(7)能与溴水反应而使溴水褪色的是_______ ,由于萃取作用而使溴水褪色的是_______ 。
(8)能使酸性高锰酸钾溶液褪色的是_______ 。
| 装置 | 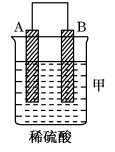 | 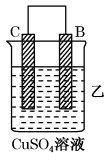 | 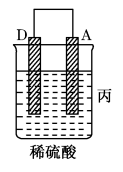 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是
(2)装置乙中正极的电极反应式是
(3)装置丙中溶液的pH变化是
(4)四种金属活动性由强到弱的顺序是
Ⅱ.今有下列物质:
①甲烷 ②乙烷 ③乙烯 ④苯 ⑤苯乙烯 ⑥分馏汽油
(5)常温下呈气态的是
(6)属于芳香烃的是
(7)能与溴水反应而使溴水褪色的是
(8)能使酸性高锰酸钾溶液褪色的是
您最近半年使用:0次
解题方法
9 . Ⅰ.某实验小组同学进行如图1实验,以检验化学反应中的能量变化。请回答下列问题:
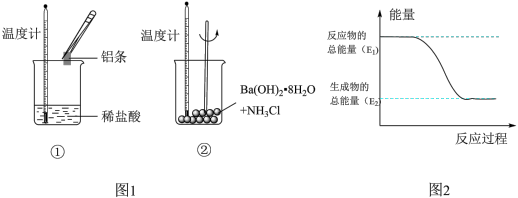
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是________ 热反应。反应过程________ (填“①”或“②”)的能量变化可用图2表示。
Ⅱ.A、B、C、D四种金属按下表中装置进行实验。
(2)根据实验现象回答下列问题:
①装置甲中溶液中的阴离子移向________ 极(填“A”或“B”)。
②装置乙中正极的电极反应式为________ 。
③装置丙中溶液的pH________ (填“变大”“变小”或“不变”)。
④四种金属活动性由强到弱的顺序是________ 。
⑤实验后同学们经过充分讨论,观察原电池反应特点,认真符合某些要求的化学反应都可以通过原电池来实现。下列化学反应在理论上可以设计成原电池的是________ 。
A.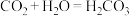 B.
B.
C. D.
D.

(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是
Ⅱ.A、B、C、D四种金属按下表中装置进行实验。
| 装置 | 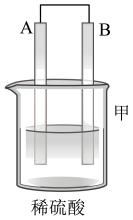 | 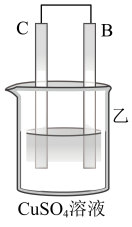 |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置甲中溶液中的阴离子移向
②装置乙中正极的电极反应式为
③装置丙中溶液的pH
④四种金属活动性由强到弱的顺序是
⑤实验后同学们经过充分讨论,观察原电池反应特点,认真符合某些要求的化学反应都可以通过原电池来实现。下列化学反应在理论上可以设计成原电池的是
A.
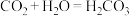 B.
B.
C.
 D.
D.
您最近半年使用:0次
10 . 回答下列问题
I:
(1) 的燃烧热为
的燃烧热为 ,则表示液态甲醇燃烧热的热化学方程式为
,则表示液态甲醇燃烧热的热化学方程式为___________ 。
II.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
(2)利用反应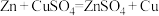 设计成原电池,该原电池的电解质溶液为
设计成原电池,该原电池的电解质溶液为___________ ,若开始时两电极质量相等,当电路中转移0.2mol电子后,两电极的质量差___________ g。
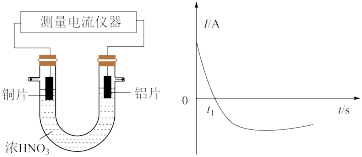
(3)某同学探究原电池原理时,认为“构成原电池的负极总是较活泼的金属材料”。该同学利用打磨过的铜片和铝片设计了下图所示的原电池装置(硝酸过量),并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转)。图中 时刻之前,正极反应式为
时刻之前,正极反应式为___________ , 时刻之后,Cu电极是
时刻之后,Cu电极是___________ (填“正极”或“负极”)。据以上现象,最终得出结论:在原电池中,构成原电池的负极不一定是较活泼的金属材料。
III.现在容积为2L的恒温密闭容器中,充入 和
和 ,一定条件下发生反应
,一定条件下发生反应 ,测得
,测得 和
和 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。
(4)下列说法正确的是___________ 。
A.使用催化剂可以增大反应速率,提高生产效率
B.反应达到平衡后,反应不再进行
C.通过改变反应条件,能改变该反应进行的限度,使 全部转化为
全部转化为
(5)达平衡时, 的转化率为
的转化率为___________ 。
I:
(1)
 的燃烧热为
的燃烧热为 ,则表示液态甲醇燃烧热的热化学方程式为
,则表示液态甲醇燃烧热的热化学方程式为II.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:

(2)利用反应
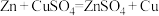 设计成原电池,该原电池的电解质溶液为
设计成原电池,该原电池的电解质溶液为(3)某同学探究原电池原理时,认为“构成原电池的负极总是较活泼的金属材料”。该同学利用打磨过的铜片和铝片设计了下图所示的原电池装置(硝酸过量),并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转)。图中
 时刻之前,正极反应式为
时刻之前,正极反应式为 时刻之后,Cu电极是
时刻之后,Cu电极是III.现在容积为2L的恒温密闭容器中,充入
 和
和 ,一定条件下发生反应
,一定条件下发生反应 ,测得
,测得 和
和 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。| 时间 | 0min | 3min | 6min | 9min | 12min |
 | 0 | 0.50 | 0.65 | 0.75 | 0.75 |
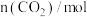 | 1 | 0.50 | 0.35 | A | 0.25 |
A.使用催化剂可以增大反应速率,提高生产效率
B.反应达到平衡后,反应不再进行
C.通过改变反应条件,能改变该反应进行的限度,使
 全部转化为
全部转化为
(5)达平衡时,
 的转化率为
的转化率为
您最近半年使用:0次