解题方法
1 . ORP传感器(如下图)测定物质的氧化性的原理:将Pt电极插入待测溶液中,Pt电极、Ag/AgCl电极与待测溶液组成原电池,测得的电压越高,溶液的氧化性越强。向NaIO3溶液、FeCl3溶液中分别滴加2滴H2SO4溶液,测得前者的电压增大,后者的几乎不变。
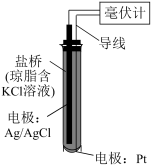
下列说法不正确 的是

下列说法
| A.盐桥中的Cl-移向Ag/AgCl电极 |
| B.Ag/AgCl电极反应是Ag-e-+Cl-=AgCl |
C.酸性越强, 的氧化性越强 的氧化性越强 |
| D.向FeCl3溶液中滴加浓NaOH溶液至碱性,测得电压几乎不变 |
您最近一年使用:0次
2023高三·全国·专题练习
名校
解题方法
2 . 为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
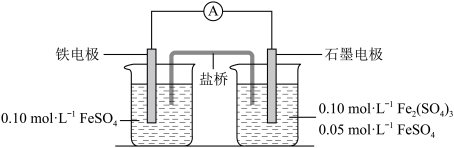
回答下列问题:
(1)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入________ 电极溶液中。
(2)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=________ 。
(3)根据(1)、(2)实验结果,可知石墨电极的电极反应式为___________________ ,铁电极的电极反应式为_______________________________ 。因此,验证了Fe2+氧化性小于________ 、还原性小于________ 。

回答下列问题:
(1)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入
(2)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=
(3)根据(1)、(2)实验结果,可知石墨电极的电极反应式为
您最近一年使用:0次
名校
解题方法
3 . 羟基自由基( )是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为
)是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为 和
和 的原电池—电解池的组合装置,实现了发电、环保两位一体。下列说法错误的是
的原电池—电解池的组合装置,实现了发电、环保两位一体。下列说法错误的是

 )是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为
)是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为 和
和 的原电池—电解池的组合装置,实现了发电、环保两位一体。下列说法错误的是
的原电池—电解池的组合装置,实现了发电、环保两位一体。下列说法错误的是
A.a极每 参与反应,有 参与反应,有 移向氯化钠溶液 移向氯化钠溶液 |
| B.相同条件下,电极b与c产生气体的体积比为7:3 |
| C.电极c为阴极,发生还原反应 |
D.d极区苯酚被氧化的化学方程式为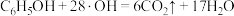 |
您最近一年使用:0次
名校
解题方法
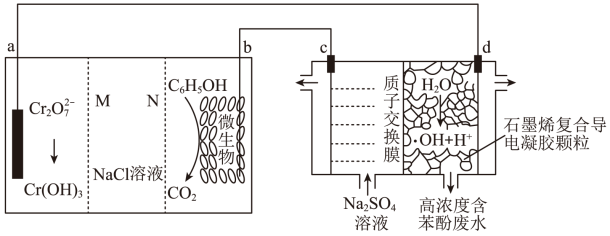
4 . 我国科学家设计了一种利用废水中的 将苯酚氧化为
将苯酚氧化为 和
和 的原电池—电解池组合装置(如图),实现了发电、环保二位一体。已知:羟基自由基(
的原电池—电解池组合装置(如图),实现了发电、环保二位一体。已知:羟基自由基( )的氧化性仅次于氟气。下列说法正确的是
)的氧化性仅次于氟气。下列说法正确的是
 将苯酚氧化为
将苯酚氧化为 和
和 的原电池—电解池组合装置(如图),实现了发电、环保二位一体。已知:羟基自由基(
的原电池—电解池组合装置(如图),实现了发电、环保二位一体。已知:羟基自由基( )的氧化性仅次于氟气。下列说法正确的是
)的氧化性仅次于氟气。下列说法正确的是
| A.电子转移方向:c电极→导线→b电极 |
B.d电极的电极反应为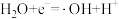 |
C.右侧装置中,c、d两电极产生气体的体积比(相同条件下)为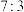 |
D.若a电极上有 参与反应,理论上 参与反应,理论上 溶液中有 溶液中有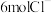 通过阴离子膜进入a电极区溶液 通过阴离子膜进入a电极区溶液 |
您最近一年使用:0次
2023-05-04更新
|
299次组卷
|
2卷引用:河北省石家庄部分重点高中2022-2023学年高三下学期3月月考化学试题
名校
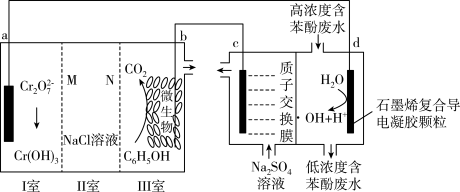
5 . 羟基自由基( )是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为
)是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为 和
和 的原电池-电解池组合装置(如图所示),该装置能实现发电、环保二位一体。下列说法错误的是
的原电池-电解池组合装置(如图所示),该装置能实现发电、环保二位一体。下列说法错误的是
 )是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为
)是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为 和
和 的原电池-电解池组合装置(如图所示),该装置能实现发电、环保二位一体。下列说法错误的是
的原电池-电解池组合装置(如图所示),该装置能实现发电、环保二位一体。下列说法错误的是
| A.a极为正极,c极为阴极 |
B.a极区每产生1mol ,c极区溶液质量减轻3g ,c极区溶液质量减轻3g |
C.d极的电极反应式为 |
D.工作时,如果II室中 、 、 数目都减小,则N为阴离子交换膜 数目都减小,则N为阴离子交换膜 |
您最近一年使用:0次
2022-12-24更新
|
698次组卷
|
4卷引用:广东省部分学校2022-2023学年高三上学期12月大联考化学试题
广东省部分学校2022-2023学年高三上学期12月大联考化学试题河北省衡水市2022-2023学年高三上学期12月份大联考化学试卷辽宁省沈阳市第二中学2022-2023学年高三上学期期末考试化学试题 (已下线)专题一 原电池的工作原理及其应用(练习)
2021高二·全国·专题练习
解题方法
6 . 设计原电池装置证明Fe3+的氧化性比Cu2+强。
(1)写出能说明氧化性Fe3+大于Cu2+的离子方程式:___________ 。
(2)若要将上述反应设计成原电池,电极反应式分别是:
①负极:___________
②正极:___________ 。
(3)画出装置图,指出电极材料和电解质溶液:
(1)写出能说明氧化性Fe3+大于Cu2+的离子方程式:
(2)若要将上述反应设计成原电池,电极反应式分别是:
①负极:
②正极:
(3)画出装置图,指出电极材料和电解质溶液:
| ①不含盐桥 | ②含盐桥 |
您最近一年使用:0次
2021-08-27更新
|
537次组卷
|
7卷引用:第六章 化学反应与能量 第35讲 原电池 化学电源
(已下线)第六章 化学反应与能量 第35讲 原电池 化学电源(已下线)第3讲 原电池 化学电源(已下线)1.2.2 化学电源(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)(已下线)高中化学《新教材变化解读与考法剖析》第四章 化学反应与电能(人教版2019选择性必修1)(已下线)4.1 原电池-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第11讲 原电池的工作原理(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)(已下线)第24讲 原电池的工作原理(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)
解题方法
7 . 原电池是化学对人类的一项重大贡献。
(1)某兴趣小组为研究原电池原理,设计如图装置。

①a和b不连接时,烧杯中发生反应的离子方程式是_______ 。
②a和b用导线连接,Cu极为原电池_______ 极(填“正”或“负”),该电极反应式是_______ ,溶液中的H+移向_______ (填“Cu”或“Zn”)极。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.2 mol电子,则理论上Zn片质量减轻_______ g。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是_______ (填“a”或“b”)电极,该极的电极反应式为:_______ 。
②电池工作一段时间后电解质溶液的pH_______ (填“增大”“减小”或“不变”)。
(3)现有下列三个氧化还原反应:
A.2FeCl3+2KI=2FeCl2+2KCl+I2
B.2FeCl2+Cl2=2FeCl3
C.2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑
Fe3+、I2、Cl2、MnO 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_______
(1)某兴趣小组为研究原电池原理,设计如图装置。

①a和b不连接时,烧杯中发生反应的离子方程式是
②a和b用导线连接,Cu极为原电池
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.2 mol电子,则理论上Zn片质量减轻
(2)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是
②电池工作一段时间后电解质溶液的pH
(3)现有下列三个氧化还原反应:
A.2FeCl3+2KI=2FeCl2+2KCl+I2
B.2FeCl2+Cl2=2FeCl3
C.2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑
Fe3+、I2、Cl2、MnO
 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为
您最近一年使用:0次
解题方法
8 . 下列因果关系说法合理的是
| A.Mg的金属活动性强于Al,所以Mg、Al作电极的原电池中,Mg为负极,Al为正极 |
| B.浓硫酸能氧化Cu单质而稀硫酸不能,说明稀硫酸没有氧化性 |
| C.HCl的酸性强于H2S的,原因是Cl的非金属性强于S的 |
| D.过氧乙酸(CH3COOOH)与H2O2都包含“-O-O-”结构,所以两者均具有较强的氧化性 |
您最近一年使用:0次
解题方法
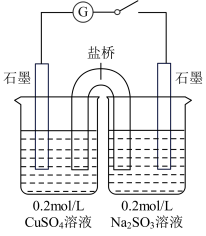
9 . 某实验小组为探究CuSO4与Na2SO3反应后的产物,做如下探究实验。
【查阅资料】
①Cu2O为砖红色固体,不溶于水;
②Cu2SO3为黄色固体,不溶于水;
③[Cu(SO3)2]3-为无色配合离子、[Cu(NH3)2]+为无色配合离子、[Cu(NH3)4]2+为深蓝色配合离子。
【实验探究】
实验1:①向2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,开始出现黄色沉淀,但无气体产生。
②继续加入Na2SO3溶液,最终沉淀消失。经检验,溶液中生成[Cu(SO3)2]3-离子。
实验2:向90℃ 2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,直接生成砖红色沉淀。
实验3:向2mL0.2mol∙L-1的Na2SO3溶液中滴加0.2mol∙L-1的CuSO4溶液,开始阶段有蓝色沉淀出现。
(1)S元素在元素周期表中的位置为_______ 。N、O、S三种元素原子的简单离子半径由大到小的顺序为_______ (用离子符号表示)。
(2)某同学认为实验1黄色沉淀中有少量Cu(OH)2,该同学认为是CuSO4、Na2SO3相互促进水解产生的,用离子方程式表示生成Cu(OH)2沉淀的过程:_______ 。
(3)经检验,实验2所得溶液中有大量 、
、 生成。该实验中Cu2+表现
生成。该实验中Cu2+表现_______ 性,写出该实验中反应的离子方程式:_______ 。
(4)某同学设计了如图所示的电化学装置,探究CuSO4与Na2SO3的反应。该装置中左侧烧杯中的石墨电极做_______ (填“正”或“负”)极,右侧烧杯中发生反应的电极反应式为_______ 。设计实验检验右侧烧杯中生成的阴离子,写出具体操作、现象和结论:_______ 。
【查阅资料】
①Cu2O为砖红色固体,不溶于水;
②Cu2SO3为黄色固体,不溶于水;
③[Cu(SO3)2]3-为无色配合离子、[Cu(NH3)2]+为无色配合离子、[Cu(NH3)4]2+为深蓝色配合离子。
【实验探究】
实验1:①向2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,开始出现黄色沉淀,但无气体产生。
②继续加入Na2SO3溶液,最终沉淀消失。经检验,溶液中生成[Cu(SO3)2]3-离子。
实验2:向90℃ 2mL0.2mol∙L-1的CuSO4溶液中滴加0.2mol∙L-1的Na2SO3溶液,直接生成砖红色沉淀。
实验3:向2mL0.2mol∙L-1的Na2SO3溶液中滴加0.2mol∙L-1的CuSO4溶液,开始阶段有蓝色沉淀出现。
(1)S元素在元素周期表中的位置为
(2)某同学认为实验1黄色沉淀中有少量Cu(OH)2,该同学认为是CuSO4、Na2SO3相互促进水解产生的,用离子方程式表示生成Cu(OH)2沉淀的过程:
(3)经检验,实验2所得溶液中有大量
 、
、 生成。该实验中Cu2+表现
生成。该实验中Cu2+表现(4)某同学设计了如图所示的电化学装置,探究CuSO4与Na2SO3的反应。该装置中左侧烧杯中的石墨电极做

您最近一年使用:0次
10 . 如图所示,某化学兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:

(1)通入氧气的电极为_____ (填“正极”或“负极”),通氢气一极的电极反应式为_________________ ;
(2)铁电极为_______ (填“阳极”或“阴极”),乙装置中电解反应的化学方程式为_________________ 。
(3)若在标准状况下,有1.12 L氧气参加反应,丙装置中阴极增重的质量为______ g;
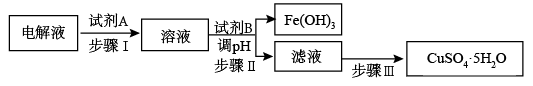
(4)某粗铜中含有铁、金、银和铂等杂质,通过电解精制后,为从电解液中制得硫酸铜晶体(CuSO4·5H2O),设计了如下工艺流程:
已知:几种金属阳离子开始沉淀和沉淀完全的pH:
①步骤I中加入试剂A的目的是_____________________________ ,试剂A应选择______ (填序号);
a.氯气 b.过氧化氢 C.酸性高锰酸钾溶液
选择该试剂的原因_____________________________________________________ ;
②步骤II中试剂B为_________ ,调节pH的范围是___________ ;
③步骤III的操作是加热浓缩、_______ 、___________ 。

(1)通入氧气的电极为
(2)铁电极为
(3)若在标准状况下,有1.12 L氧气参加反应,丙装置中阴极增重的质量为
(4)某粗铜中含有铁、金、银和铂等杂质,通过电解精制后,为从电解液中制得硫酸铜晶体(CuSO4·5H2O),设计了如下工艺流程:

已知:几种金属阳离子开始沉淀和沉淀完全的pH:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
a.氯气 b.过氧化氢 C.酸性高锰酸钾溶液
选择该试剂的原因
②步骤II中试剂B为
③步骤III的操作是加热浓缩、
您最近一年使用:0次
2018-01-27更新
|
689次组卷
|
4卷引用:2020届高三化学大二轮增分强化练——无机化工流程专练



