名校
解题方法
1 . 在第十三届阿布扎比国际防务展上,采用先进的氢氧燃料电池系统的无人机,创造了该级别270分钟续航的新世界记录。下列有关氢氧燃料电池的说法正确的是
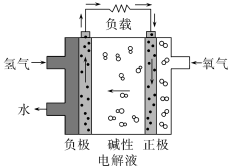

| A.通入氧气的电极发生氧化反应 |
| B.碱性电解液中阳离子向通入氢气的方向移动 |
C.正极的电极反应式为: |
D.该电池工作时,每消耗22.4L 转移4mol电子 转移4mol电子 |
您最近一年使用:0次
2021-07-31更新
|
478次组卷
|
3卷引用:题型17 燃料电池的应用
名校
解题方法
2 . 已知Ag+的氧化性强于Co2+的氧化性,则关于下图所示原电池装置的说法中,正确的是
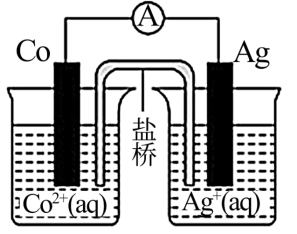

| A.Co电极是原电池的正极 |
| B.盐桥中可填充KCl饱和溶液与琼脂的混合物 |
| C.该原电池的正极反应式为Ag++e-=Ag |
| D.盐桥中的电解质阴离子向右侧烧杯移动 |
您最近一年使用:0次
2022-02-15更新
|
1155次组卷
|
7卷引用:专题16 新型电化学装置分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
(已下线)专题16 新型电化学装置分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题一 原电池的工作原理及其应用(练习)河北省沧州市第一中学2021-2022学年高三上学期12月月考化学试题湖北省新高考联考协作体2021-2022学年高二3月考试化学试题云南省昭通市永善、绥江县2021-2022学年高二3月月考化学试题(已下线)押新高考卷12题 电化学基础-备战2022年高考化学临考题号押题(新高考通版)云南省昭通市永善、绥江县2021-2022学年高二下学期3月月考化学试题
名校
解题方法
3 . 设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成 ,将废旧锂离子电池的正极材料
,将废旧锂离子电池的正极材料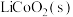 转化为
转化为 ,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是
,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是
 ,将废旧锂离子电池的正极材料
,将废旧锂离子电池的正极材料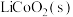 转化为
转化为 ,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是
,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是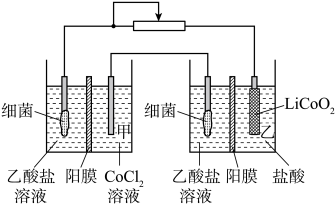
| A.装置工作一段时间后,乙室应补充盐酸 |
| B.装置工作时,甲室溶液pH逐渐增大 |
C.乙室电极反应式为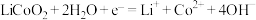 |
D.若甲室 减少200mg,乙室 减少200mg,乙室 增加400mg,则此时已进行过溶液转移 增加400mg,则此时已进行过溶液转移 |
您最近一年使用:0次
2023-12-19更新
|
349次组卷
|
2卷引用:福建省厦门第一中学2023-2024学年高二上学期12月月考化学试卷
2023高二上·全国·专题练习
名校
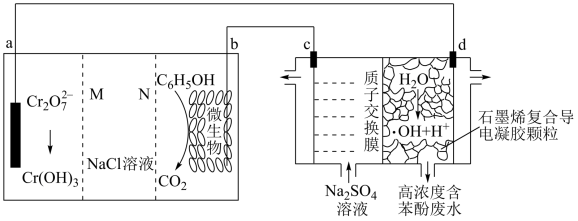
4 . 科学家设计了一种能产生羟基自由基(·OH)的原电池—电解池组合装置,·OH能将苯酚氧化为CO2和H2O,实现发电、环保二位一体,原理如图所示。下列说法错误的是
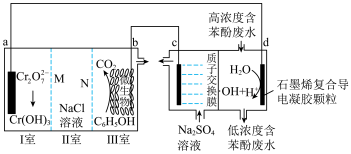

| A.a极为正极,N为阴离子交换膜 |
| B.d极的电极反应式为H2O-e-=·OH +H+ |
| C.a极区每产生1 mol Cr(OH)3,C 极区溶液质量减轻3g |
| D.b极区消耗1 mol C6H5OH,理论上电路中转移电子28 mol |
您最近一年使用:0次
2023-12-11更新
|
222次组卷
|
5卷引用:【知识图鉴】单元讲练测选择性必修1第4单元02基础练
(已下线)【知识图鉴】单元讲练测选择性必修1第4单元02基础练山东省聊城市2023届高三下学期一模考试化学试题(已下线)专题07 电化学及其应用-2023年高考化学真题题源解密(新高考专用)福建省福州第一中学2023-2024学年高三上学期开学考试化学试题山东省济宁市第一中学2023-2024学年高三上学期2月期末化学试题
名校
解题方法
5 . “水”电池是一种利用淡水与海水之间含盐量差别进行发电的电池,其总反应为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,如图以“水”电池为电源电解酸性FeCl2溶液,X电极附近溶液先变黄,下列有关分析不正确的是( )
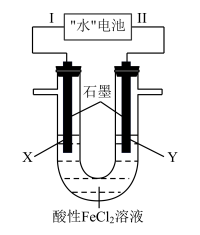

| A.该装置只涉及两种能量之间的转化 |
| B.在线路中安装电压调节装置,可通过现象判断Fe2+和Cl-的还原性强弱 |
| C.“水”电池内Na+不断向正极移动 |
| D.Ⅱ为负极,其电极反应式为Ag+Cl--e-=AgCl |
您最近一年使用:0次
2020-07-08更新
|
73次组卷
|
3卷引用:山东省鄄城县第一中学2022-2023学年高一下学期5月月考化学试题
解题方法
6 . 能源与人类的生存和发展息息相关,化学反应在人类利用能源的历史过程中充当重要的角色。回答下列问题:
(1)原电池是直接把化学能转化为电能的装置。据如下装置图,回答下列问题:

①若X为Ag,Y为 溶液,溶液中的
溶液,溶液中的 移向
移向______ (填“Cu”或“X”)电极,当电路中转移0.2 mol 时,电解质溶液质量减少
时,电解质溶液质量减少______ g
②若用如图装置,依据反应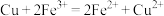 设计原电池,则电极X可以用
设计原电池,则电极X可以用______ (填电极材料)做电极材料,电解质溶液Y的溶质为______ (填化学式),铜极的电极反应式为__________________ 。
(2)航天技术上使用的氢-氧燃料电池具有高能、轻便和不污染环境等优点。如图是氢-氧燃料电池的装置图,则:
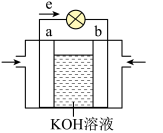
①a电极发生________ (填“氧化”或“还原”)反应。
②b电极附近pH________ 。(填增大、减小或不变)
③负极反应式为:________________________________ 。
(1)原电池是直接把化学能转化为电能的装置。据如下装置图,回答下列问题:

①若X为Ag,Y为
 溶液,溶液中的
溶液,溶液中的 移向
移向 时,电解质溶液质量减少
时,电解质溶液质量减少②若用如图装置,依据反应
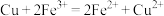 设计原电池,则电极X可以用
设计原电池,则电极X可以用(2)航天技术上使用的氢-氧燃料电池具有高能、轻便和不污染环境等优点。如图是氢-氧燃料电池的装置图,则:

①a电极发生
②b电极附近pH
③负极反应式为:
您最近一年使用:0次
7 . 物质有自发地从浓度大的区域向浓度小的区域扩散的趋势,利用该趋势可设计浓差电池。如图所示装置可测定氧气的含量,参比侧通入纯氧,测量侧气压调节到与参比测相同,接通电路,通过电势差大小可测出测量侧气体的含氧量。下列说法不正确的是


| A.测量侧为电池的负极 |
| B.参比侧的电极反应:O2+4e-=2O2- |
| C.测量侧处于封闭环境时,初期的读数比较准确 |
| D.相同压强下,电势差越大,测量侧气体中含氧量越高 |
您最近一年使用:0次
8 . 科学家设计了一种能产生羟基自由基( )的原电池—电解池组合装置,
)的原电池—电解池组合装置, 能将苯酚氧化为
能将苯酚氧化为 和
和 ,实现发电、环保二位一体,如图所示。下列说法错误的是
,实现发电、环保二位一体,如图所示。下列说法错误的是
 )的原电池—电解池组合装置,
)的原电池—电解池组合装置, 能将苯酚氧化为
能将苯酚氧化为 和
和 ,实现发电、环保二位一体,如图所示。下列说法错误的是
,实现发电、环保二位一体,如图所示。下列说法错误的是
| A.a极为正极,N为阳离子交换膜 |
B.d极的电极反应式为 |
C.a极区每产生1mol ,c极区溶液质量减轻3g ,c极区溶液质量减轻3g |
D.b极区消耗1mol ,理论上电路中转移电子28mol ,理论上电路中转移电子28mol |
您最近一年使用:0次
解题方法
9 . 如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

根据要求回答相关问题:
(1)通入氧气的电极为_______ (填“正极”或“负极”),负极的电极反应式为_______ 。
(2)铁电极为_______ (填“阳极”或“阴极”),石墨电极(C)的电极反应式为_______ 。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将_______ (填“增大”“减小”或“不变”)
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为_______ (用 为阿伏加德罗常数的值表示)。
为阿伏加德罗常数的值表示)。
(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。
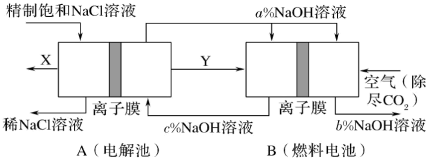
分析图可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为_______ 。

根据要求回答相关问题:
(1)通入氧气的电极为
(2)铁电极为
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为
 为阿伏加德罗常数的值表示)。
为阿伏加德罗常数的值表示)。(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。

分析图可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为
您最近一年使用:0次
10 . 氧化还原反应可拆分为氧化和还原两个“半反应”,某小组同学从“半反应”的角度探究反应规律。
(1)已知: 的转化在酸性条件下才能发生。
的转化在酸性条件下才能发生。
①该转化的还原半反应是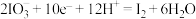 ,则相应的氧化半反应是
,则相应的氧化半反应是___________ 。
②分析上述还原半反应可知:增大 可促进
可促进 得到电子,使其
得到电子,使其___________ 性增强,进而与 发生反应。
发生反应。
(2)探究 与浓盐酸能否发生反应。
与浓盐酸能否发生反应。
①有同学认为 与浓盐酸不能发生反应产生氢气,其依据是
与浓盐酸不能发生反应产生氢气,其依据是___________ 。
用如下装置进行实验【硫酸与浓盐酸中 接近】。
接近】。
②甲实验的目的是___________ 。
③a.丙中气球变鼓是因为生成了___________ 气体(填化学式)。
b.经检测,丙中反应后溶液中存在 。从物质性质角度分析丙中反应能够发生的原因:
。从物质性质角度分析丙中反应能够发生的原因:___________ 。
(3)探究以下原电池的工作原理。
实验结果:产生电流,左侧 电极表面有
电极表面有 析出。
析出。
①该装置中左侧  电极作
电极作___________ (填“正”或“负”)极。
②写出该装置右侧 烧杯中的电极反应式___________ 。
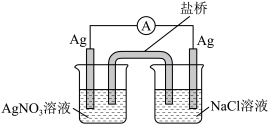
对该原电池的电极反应和总反应的反应类型进行分析,发现两极上分别发生氧化和还原反应,而总反应不一定是氧化还原反应。
③结合上述实验思考,仅由以下实验用品能否设计成原电池__________ 。
 片、
片、 浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
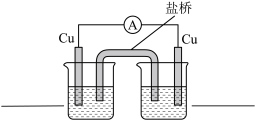
a.若能,在右装置图中填写烧杯中的试剂,并标出电子的移动方向 。
b.若不能,说明原因。
(1)已知:
 的转化在酸性条件下才能发生。
的转化在酸性条件下才能发生。①该转化的还原半反应是
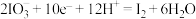 ,则相应的氧化半反应是
,则相应的氧化半反应是②分析上述还原半反应可知:增大
 可促进
可促进 得到电子,使其
得到电子,使其 发生反应。
发生反应。(2)探究
 与浓盐酸能否发生反应。
与浓盐酸能否发生反应。①有同学认为
 与浓盐酸不能发生反应产生氢气,其依据是
与浓盐酸不能发生反应产生氢气,其依据是用如下装置进行实验【硫酸与浓盐酸中
 接近】。
接近】。| 装置 | 序号 | 试管内药品 | 现象 |
 | 甲 | 浓盐酸 | 24小时后仍无明显变化 |
| 乙 |  粉+硫酸 粉+硫酸 | 24小时后仍无明显变化 | |
| 丙 |  粉+浓盐酸 粉+浓盐酸 | 24小时后气球变鼓 |
③a.丙中气球变鼓是因为生成了
b.经检测,丙中反应后溶液中存在
 。从物质性质角度分析丙中反应能够发生的原因:
。从物质性质角度分析丙中反应能够发生的原因:(3)探究以下原电池的工作原理。
实验结果:产生电流,左侧
 电极表面有
电极表面有 析出。
析出。①该装置中
 电极作
电极作②写出该装置

对该原电池的电极反应和总反应的反应类型进行分析,发现两极上分别发生氧化和还原反应,而总反应不一定是氧化还原反应。
③结合上述实验思考,仅由以下实验用品能否设计成原电池
 片、
片、 浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
浓溶液、蒸馏水、烧杯、盐桥、导线、电流表(选做下列a或b,若两个都作答,按a计分)
a.若能,在右装置图中填写烧杯中的试剂,
b.若不能,说明原因。
您最近一年使用:0次



