1 . 我国科学家设计了一种利用废水中的 将苯酚氧化为CO2和H2O的原电池一电解池组合装置(如图所示)。已知:羟基自由基(·OH)的氧化性仅次于氟气。下列说法错误的是
将苯酚氧化为CO2和H2O的原电池一电解池组合装置(如图所示)。已知:羟基自由基(·OH)的氧化性仅次于氟气。下列说法错误的是
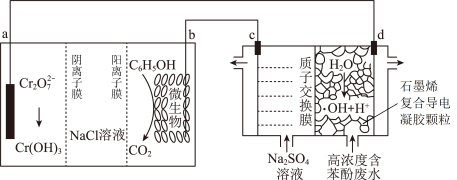
 将苯酚氧化为CO2和H2O的原电池一电解池组合装置(如图所示)。已知:羟基自由基(·OH)的氧化性仅次于氟气。下列说法错误的是
将苯酚氧化为CO2和H2O的原电池一电解池组合装置(如图所示)。已知:羟基自由基(·OH)的氧化性仅次于氟气。下列说法错误的是
| A.电子转移方向:b电极→导线→c电极 |
| B.d电极的电极反应为H2O-e-=·OH+ H+ |
| C.右侧装置中,c、d两电极产生气体的体积比(相同条件下)为7∶3 |
D.若a电极上有1 mol  参与反应,理论上NaCl溶液中有6 mol Cl-通过阴离子膜进入a电极区溶液 参与反应,理论上NaCl溶液中有6 mol Cl-通过阴离子膜进入a电极区溶液 |
您最近一年使用:0次
2023-11-30更新
|
296次组卷
|
2卷引用:河北衡水中学2023-2024学年高三上学期三调考试化学试题
名校
解题方法
2 . 羟基自由基( )是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为
)是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为 和
和 的原电池—电解池的组合装置,实现了发电、环保两位一体。下列说法错误的是
的原电池—电解池的组合装置,实现了发电、环保两位一体。下列说法错误的是

 )是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为
)是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为 和
和 的原电池—电解池的组合装置,实现了发电、环保两位一体。下列说法错误的是
的原电池—电解池的组合装置,实现了发电、环保两位一体。下列说法错误的是
A.a极每 参与反应,有 参与反应,有 移向氯化钠溶液 移向氯化钠溶液 |
| B.相同条件下,电极b与c产生气体的体积比为7:3 |
| C.电极c为阴极,发生还原反应 |
D.d极区苯酚被氧化的化学方程式为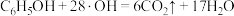 |
您最近一年使用:0次
3 . 电解工作原理的实际应用非常广泛。
(1)电解精炼银时,粗银作___________ ,阴极反应为___________ 。
(2)工业上为了处理含有Cr2O 的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量可低于排放标准。关于上述方法,下列说法错误的是___________(填字母)。
的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量可低于排放标准。关于上述方法,下列说法错误的是___________(填字母)。
(3)某同学设计了如图装置进行以下电化学实验。
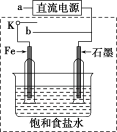
①当开关K与a连接时,两极均有气泡产生,则阴极为___________ 电极。
②一段时间后,使开关K与a断开,与b连接时,虚线框内的装置可称为___________ 。请写出此时Fe电极上的电极反应___________ 。
(4)1 L某溶液中含有的离子如下表:
用惰性电极电解该溶液,当电路中有3 mol e-通过时(忽略电解时溶液体积变化及电极产物可能存在的溶解现象),下列说法正确的是___________(填字母)。
(1)电解精炼银时,粗银作
(2)工业上为了处理含有Cr2O
 的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量可低于排放标准。关于上述方法,下列说法错误的是___________(填字母)。
的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量可低于排放标准。关于上述方法,下列说法错误的是___________(填字母)。| A.阳极反应:Fe-2e-=Fe2+ | B.阴极反应:2H++2e-=H2↑ |
| C.在电解过程中工业废水由酸性变为碱性 | D.可以将铁电极改为石墨电极 |

①当开关K与a连接时,两极均有气泡产生,则阴极为
②一段时间后,使开关K与a断开,与b连接时,虚线框内的装置可称为
(4)1 L某溶液中含有的离子如下表:
| 离子 | Cu2+ | Al3+ | NO | Cl- |
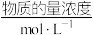 | 1 | 1 | a | 1 |
| A.电解后溶液呈酸性 | B.a=3 |
| C.阳极生成1.5 mol Cl2 | D.阴极析出的金属是铜与铝 |
您最近一年使用:0次
名校
4 . 某探究性学习小组认为 与KI溶液反应时,能发生以下反应:①
与KI溶液反应时,能发生以下反应:①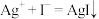
 ,②
,②
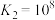 。设计如下装置进行验证,一段时间后,石墨Ⅱ电极上有光亮的物质生成。
。设计如下装置进行验证,一段时间后,石墨Ⅱ电极上有光亮的物质生成。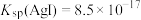 ,氧化性
,氧化性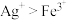 ,下列有关叙述正确的是
,下列有关叙述正确的是
 与KI溶液反应时,能发生以下反应:①
与KI溶液反应时,能发生以下反应:①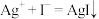
 ,②
,②
 。设计如下装置进行验证,一段时间后,石墨Ⅱ电极上有光亮的物质生成。
。设计如下装置进行验证,一段时间后,石墨Ⅱ电极上有光亮的物质生成。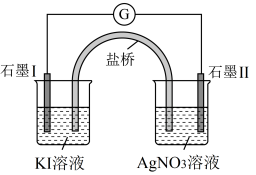
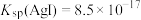 ,氧化性
,氧化性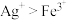 ,下列有关叙述正确的是
,下列有关叙述正确的是| A.石墨Ⅰ为正极,盐桥内溶质为KCl |
B.石墨Ⅱ的电极反应式为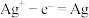 |
| C.往KI溶液中加入淀粉可检验生成的产物 |
D.平衡常数 : : ;反应活化能:①>② ;反应活化能:①>② |
您最近一年使用:0次
2023-05-19更新
|
71次组卷
|
2卷引用:四川省成都市树德中学2022-2023学年高二下学期5月月考化学试题
名校
解题方法
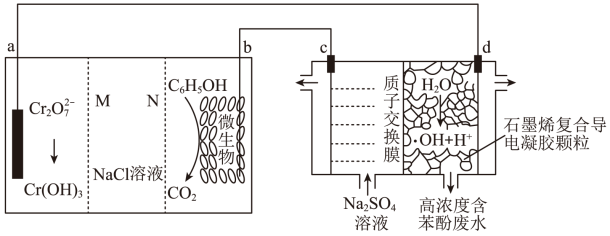
5 . 我国科学家设计了一种利用废水中的 将苯酚氧化为
将苯酚氧化为 和
和 的原电池—电解池组合装置(如图),实现了发电、环保二位一体。已知:羟基自由基(
的原电池—电解池组合装置(如图),实现了发电、环保二位一体。已知:羟基自由基( )的氧化性仅次于氟气。下列说法正确的是
)的氧化性仅次于氟气。下列说法正确的是
 将苯酚氧化为
将苯酚氧化为 和
和 的原电池—电解池组合装置(如图),实现了发电、环保二位一体。已知:羟基自由基(
的原电池—电解池组合装置(如图),实现了发电、环保二位一体。已知:羟基自由基( )的氧化性仅次于氟气。下列说法正确的是
)的氧化性仅次于氟气。下列说法正确的是
| A.电子转移方向:c电极→导线→b电极 |
B.d电极的电极反应为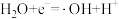 |
C.右侧装置中,c、d两电极产生气体的体积比(相同条件下)为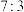 |
D.若a电极上有 参与反应,理论上 参与反应,理论上 溶液中有 溶液中有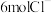 通过阴离子膜进入a电极区溶液 通过阴离子膜进入a电极区溶液 |
您最近一年使用:0次
2023-05-04更新
|
305次组卷
|
2卷引用:河北省石家庄部分重点高中2022-2023学年高三下学期3月月考化学试题
6 . 砷酸钠(Na3AsO4)可用于设计成可逆电池,其反应原理为AsO +2H++2I-
+2H++2I- AsO
AsO +I2+H2O,设计的原电池如图I所示,探究pH对AsO
+I2+H2O,设计的原电池如图I所示,探究pH对AsO 氧化性的影响。测得输出电压与pH的关系如图II所示。
氧化性的影响。测得输出电压与pH的关系如图II所示。
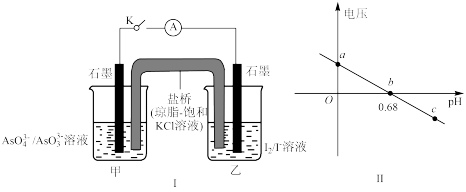
下列说法错误的是
 +2H++2I-
+2H++2I- AsO
AsO +I2+H2O,设计的原电池如图I所示,探究pH对AsO
+I2+H2O,设计的原电池如图I所示,探究pH对AsO 氧化性的影响。测得输出电压与pH的关系如图II所示。
氧化性的影响。测得输出电压与pH的关系如图II所示。
下列说法错误的是
A.AsO 的氧化性大于I2的氧化性 的氧化性大于I2的氧化性 |
| B.a点时,烧杯乙中发生氧化反应 |
| C.b点时,电路中电流为0,反应达到平衡状态 |
| D.c点时,正极的电极反应为I2+2e-=2I- |
您最近一年使用:0次
名校
7 . 羟基自由基( )是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为
)是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为 和
和 的原电池-电解池组合装置(如图所示),该装置能实现发电、环保二位一体。下列说法错误的是
的原电池-电解池组合装置(如图所示),该装置能实现发电、环保二位一体。下列说法错误的是
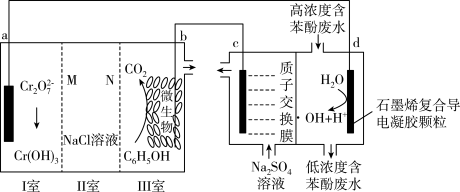
 )是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为
)是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为 和
和 的原电池-电解池组合装置(如图所示),该装置能实现发电、环保二位一体。下列说法错误的是
的原电池-电解池组合装置(如图所示),该装置能实现发电、环保二位一体。下列说法错误的是
| A.a极为正极,c极为阴极 |
B.a极区每产生1mol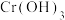 ,c极区溶液质量减轻3g ,c极区溶液质量减轻3g |
C.d极的电极反应式为 |
D.工作时,如果II室中 、 、 数目都减小,则N为阴离子交换膜 数目都减小,则N为阴离子交换膜 |
您最近一年使用:0次
2022-12-24更新
|
701次组卷
|
4卷引用:辽宁省沈阳市第二中学2022-2023学年高三上学期期末考试化学试题
辽宁省沈阳市第二中学2022-2023学年高三上学期期末考试化学试题 (已下线)专题一 原电池的工作原理及其应用(练习)广东省部分学校2022-2023学年高三上学期12月大联考化学试题河北省衡水市2022-2023学年高三上学期12月份大联考化学试卷
名校
8 . 电池的应用给我们的生活带来了很多便利,请根据原电池工作原理回答下列问题:
(1)现有如下两个反应:①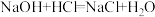 ②
② 。根据两反应本质,判断能设计成原电池的反应是
。根据两反应本质,判断能设计成原电池的反应是_______ (填序号)。该电池的正极材料是_______ 。
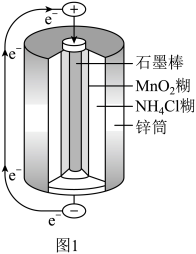
(2)锌锰干电池是最早使用的化学电池,其基本构造如图1所示:电路中每通过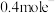 ,负极质量减少
,负极质量减少_______ g;工作时 在正极放电产生两种气体,其中一种气体分子是
在正极放电产生两种气体,其中一种气体分子是 的微粒,正极的电极反应式是
的微粒,正极的电极反应式是_______ 。
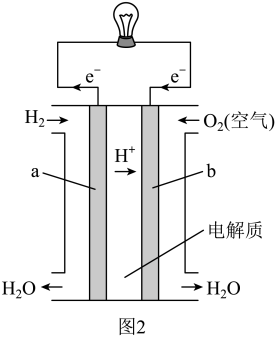
(3)图2为氢氧燃料电池原理示意图。该燃料电池正极的电极反应式_______ 。若导线中通过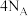 个电子,负极消耗气体的体积为
个电子,负极消耗气体的体积为_______ (标况下)。
(4)直接乙醇燃料电池( )具有很多优点。现有以下三种乙醇燃料电池。
)具有很多优点。现有以下三种乙醇燃料电池。
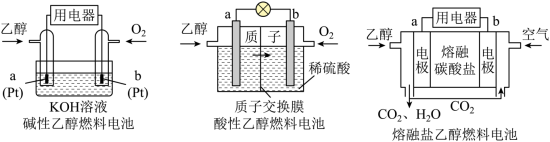
①碱性乙醇燃料电池中,电极a上发生的电极反应式为_______ 。
②酸性乙醇燃料电池中,电极a上发生的电极反应式为_______ 。
③熔融碳酸盐乙醇燃料电池中,电极a上发生的电极反应式为_______ 。
(1)现有如下两个反应:①
 ②
② 。根据两反应本质,判断能设计成原电池的反应是
。根据两反应本质,判断能设计成原电池的反应是(2)锌锰干电池是最早使用的化学电池,其基本构造如图1所示:电路中每通过
 ,负极质量减少
,负极质量减少 在正极放电产生两种气体,其中一种气体分子是
在正极放电产生两种气体,其中一种气体分子是 的微粒,正极的电极反应式是
的微粒,正极的电极反应式是
(3)图2为氢氧燃料电池原理示意图。该燃料电池正极的电极反应式
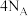 个电子,负极消耗气体的体积为
个电子,负极消耗气体的体积为
(4)直接乙醇燃料电池(
 )具有很多优点。现有以下三种乙醇燃料电池。
)具有很多优点。现有以下三种乙醇燃料电池。
①碱性乙醇燃料电池中,电极a上发生的电极反应式为
②酸性乙醇燃料电池中,电极a上发生的电极反应式为
③熔融碳酸盐乙醇燃料电池中,电极a上发生的电极反应式为
您最近一年使用:0次
名校
解题方法
9 . 为研究碘的化合物氧化性强弱设计如图实验,①、②实验左侧烧杯中溶液颜色都变蓝,下列说法中错误的是
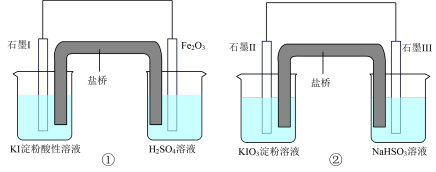

| A.①中Fe2O3极的电极反应式为Fe2O3+2e- + 6H+=2Fe2+ +3H2O |
| B.碘元素在装置①中被氧化,在装置②中被还原 |
| C.两装置的盐桥中阳离子都向含碘化合物烧杯中移动 |
| D.装置①、②中生成等量的I2时,导线上通过的电子数之比为1∶5 |
您最近一年使用:0次
2022-02-20更新
|
166次组卷
|
3卷引用:山西省实验中学2022-2023学年高一下学期期中考试化学试题
2021高二·全国·专题练习
解题方法
10 . 设计原电池装置证明Fe3+的氧化性比Cu2+强。
(1)写出能说明氧化性Fe3+大于Cu2+的离子方程式:___________ 。
(2)若要将上述反应设计成原电池,电极反应式分别是:
①负极:___________
②正极:___________ 。
(3)画出装置图,指出电极材料和电解质溶液:
(1)写出能说明氧化性Fe3+大于Cu2+的离子方程式:
(2)若要将上述反应设计成原电池,电极反应式分别是:
①负极:
②正极:
(3)画出装置图,指出电极材料和电解质溶液:
| ①不含盐桥 | ②含盐桥 |
您最近一年使用:0次
2021-08-27更新
|
550次组卷
|
7卷引用:第六章 化学反应与能量 第35讲 原电池 化学电源
(已下线)第六章 化学反应与能量 第35讲 原电池 化学电源(已下线)第3讲 原电池 化学电源(已下线)1.2.2 化学电源(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)(已下线)高中化学《新教材变化解读与考法剖析》第四章 化学反应与电能(人教版2019选择性必修1)(已下线)4.1 原电池-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第11讲 原电池的工作原理(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)(已下线)第24讲 原电池的工作原理(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)



