名校
1 . 能源的开发、利用与人类社会的可持续发展息息相关,充分利用好能源是摆在人类面前的重大课题。
(1)为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有专家提出利用太阳能促进燃料循环使用的构想,如图所示:
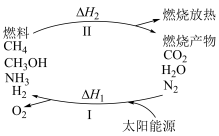
过程Ⅰ的能量转化形式为___________ 能转化为___________ 能。
(2)有机物M经过太阳光照射可转化成N,转化过程如下:
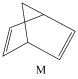

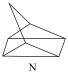 ΔH=+88.6kJ/mol
ΔH=+88.6kJ/mol
则M、N中,较稳定的是___________ 。
(3)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。其过程如图所示:
太阳能→热能→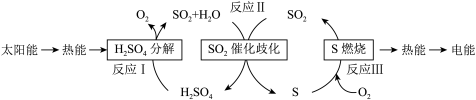
反应Ⅰ:2H2SO4(l) 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551kJ/mol
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551kJ/mol
反应Ⅲ:S(s)+O2(g) SO2(g) ΔH3=-297kJ/mol
SO2(g) ΔH3=-297kJ/mol
写出反应Ⅱ的热化学方程式:___________ 。
(4)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是___________(填标号)。
(5)如图所示的装置中,X、Y都是惰性电极。将电路接通后,向乙装置中滴入无色酚酞溶液,Fe极附近显红色。
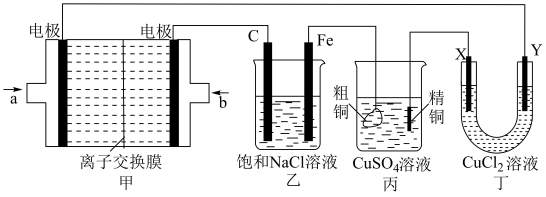
①甲装置是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,电极a上的电极反应式是___________ 。
②乙装置中,总反应的离子方程式是___________ 。
③若丙装置中精铜电极的质量增加了6.4g,则甲装置中标准状况下消耗的CH4的体积为___________ 。
(1)为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有专家提出利用太阳能促进燃料循环使用的构想,如图所示:

过程Ⅰ的能量转化形式为
(2)有机物M经过太阳光照射可转化成N,转化过程如下:


 ΔH=+88.6kJ/mol
ΔH=+88.6kJ/mol则M、N中,较稳定的是
(3)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。其过程如图所示:
太阳能→热能→

反应Ⅰ:2H2SO4(l)
 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551kJ/mol
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551kJ/mol反应Ⅲ:S(s)+O2(g)
 SO2(g) ΔH3=-297kJ/mol
SO2(g) ΔH3=-297kJ/mol写出反应Ⅱ的热化学方程式:
(4)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是___________(填标号)。
| A.C(s)+CO2(g)=2CO(g) ΔH>0 |
| B.4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ΔH<0 |
| C.NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l) ΔH<0 |
| D.C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH<0 |
(5)如图所示的装置中,X、Y都是惰性电极。将电路接通后,向乙装置中滴入无色酚酞溶液,Fe极附近显红色。

①甲装置是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,电极a上的电极反应式是
②乙装置中,总反应的离子方程式是
③若丙装置中精铜电极的质量增加了6.4g,则甲装置中标准状况下消耗的CH4的体积为
您最近一年使用:0次
名校
解题方法
2 . 为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
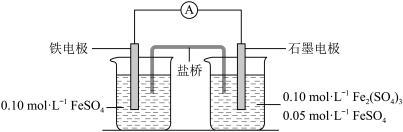
回答下列问题:
(1)由FeSO4·7H2O固体配制0.10 mol/LFeSO4溶液,需要的仪器有药匙、玻璃棒、_______ (填序号)。
A. B.
B. 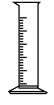 C.
C. 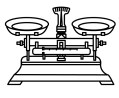 D.
D.  E.
E.
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择___________ (物质化学式)作为电解质。
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入___________ 电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+ )增加了0.02 mol/L。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=___________ 。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为___________ ,铁电极的电极反应式为___________ 。因此,验证了Fe2+氧化性小于___________ ,还原性小于___________ 。
(6)实验前需要对铁电极表面活化。在FeSO4 溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是___________ 。

回答下列问题:
(1)由FeSO4·7H2O固体配制0.10 mol/LFeSO4溶液,需要的仪器有药匙、玻璃棒、
A.
 B.
B.  C.
C.  D.
D.  E.
E.
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择
| 阳离子 | u∞×108/(m2·s-1·v-1) | 阴离子 | u∞×108/(m2·s-1·v-1) |
| Li+ | 4.07. |  | 4.61 |
| Na+ | 5.19 |  | 7.40 |
| Ca2+ | 6.59 | Cl- | 7.91 |
| K+ | 7.62 |  | 8.27 |
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+ )增加了0.02 mol/L。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为
(6)实验前需要对铁电极表面活化。在FeSO4 溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是
您最近一年使用:0次
名校
解题方法
3 . 碱性银锌二次航空电池为价格昂贵的高能电池。该电池的总反应为: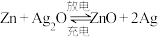 ,其电池中的基本单元示意图如下:
,其电池中的基本单元示意图如下:
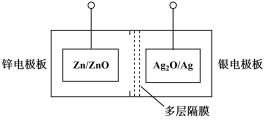
(1)该电池放电时,银电极板为电池的___________ (填“正极”或“负极”)。
(2)以KOH溶液为电解液,放电时锌电极板区域中发生的电极反应可分为两步:
反应ⅰ.锌电极板的溶解:∙∙∙∙∙∙
反应ⅱ.锌电极板上ZnO的析出:
补充反应ⅰ:___________ 。
(3)放电时,析出的ZnO会覆盖在锌电极板表面,影响电池使用效果。用浓KOH溶液可以抑制ZnO的生成,并促进锌电极板的溶解,请结合化学用语,从速率和平衡的角度说明原因:_______ 。
(4)将锌电极板制成蜂窝孔状,如图a所示,能增大锌电极板的表面积,但蜂窝孔的孔径过小,影响 进出蜂窝孔的速率,导致孔径内外
进出蜂窝孔的速率,导致孔径内外 浓度出现差异,多次充放电后会影响锌电极板的形状。图b是使用一段时间后的锌极板变形情况。
浓度出现差异,多次充放电后会影响锌电极板的形状。图b是使用一段时间后的锌极板变形情况。
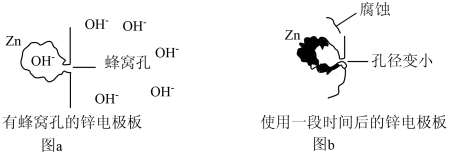
下列说法正确的是___________ (填字母序号)。
a.充电时, 向锌极板方向迁移
向锌极板方向迁移
b.孔内沉积ZnO,导电能力减弱,影响电池使用效果
c.导致该腐蚀变形的主要原因是孔外 浓度高于孔内
浓度高于孔内 浓度
浓度
d.为延长电池使用寿命,提高电池放电效果,应选用孔径恰当的锌极板
 ,其电池中的基本单元示意图如下:
,其电池中的基本单元示意图如下:
(1)该电池放电时,银电极板为电池的
(2)以KOH溶液为电解液,放电时锌电极板区域中发生的电极反应可分为两步:
反应ⅰ.锌电极板的溶解:∙∙∙∙∙∙
反应ⅱ.锌电极板上ZnO的析出:

补充反应ⅰ:
(3)放电时,析出的ZnO会覆盖在锌电极板表面,影响电池使用效果。用浓KOH溶液可以抑制ZnO的生成,并促进锌电极板的溶解,请结合化学用语,从速率和平衡的角度说明原因:
(4)将锌电极板制成蜂窝孔状,如图a所示,能增大锌电极板的表面积,但蜂窝孔的孔径过小,影响
 进出蜂窝孔的速率,导致孔径内外
进出蜂窝孔的速率,导致孔径内外 浓度出现差异,多次充放电后会影响锌电极板的形状。图b是使用一段时间后的锌极板变形情况。
浓度出现差异,多次充放电后会影响锌电极板的形状。图b是使用一段时间后的锌极板变形情况。
下列说法正确的是
a.充电时,
 向锌极板方向迁移
向锌极板方向迁移b.孔内沉积ZnO,导电能力减弱,影响电池使用效果
c.导致该腐蚀变形的主要原因是孔外
 浓度高于孔内
浓度高于孔内 浓度
浓度d.为延长电池使用寿命,提高电池放电效果,应选用孔径恰当的锌极板
您最近一年使用:0次
解题方法
4 . 近日,科学家设计一种具有石墨正极的高容量可充电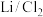 锂金属电池,原理如图所示。氯化铝(
锂金属电池,原理如图所示。氯化铝( )溶解在亚硫酰氯(
)溶解在亚硫酰氯( )中,以氟化物(
)中,以氟化物( )为添加剂作为电解质。回答下列问题:
)为添加剂作为电解质。回答下列问题:
(1)放电时,能量主要转化形式是___________ 。
(2)放电时,锂离子由___________ (填“锂”或“石墨”,下同)极向___________ 极迁移,石墨极反应式为___________ 。
(3)充电时,石墨极与电源___________ (填“正”或“负”)极连接。转移 个电子时锂电极理论上净增
个电子时锂电极理论上净增___________ g锂( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(4)该装置不能使用水、醇、酸作溶剂,其理由是___________ 。
(5) 在
在 中完全燃烧放出热量为
中完全燃烧放出热量为 。写出热化学方程式:
。写出热化学方程式:___________ 。
(6)工业上制备亚硫酰氯: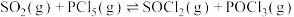
 。下列措施能提高
。下列措施能提高 平衡转化率的是___________(填字母)。
平衡转化率的是___________(填字母)。
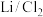 锂金属电池,原理如图所示。氯化铝(
锂金属电池,原理如图所示。氯化铝( )溶解在亚硫酰氯(
)溶解在亚硫酰氯( )中,以氟化物(
)中,以氟化物( )为添加剂作为电解质。回答下列问题:
)为添加剂作为电解质。回答下列问题:
(1)放电时,能量主要转化形式是
(2)放电时,锂离子由
(3)充电时,石墨极与电源
 个电子时锂电极理论上净增
个电子时锂电极理论上净增 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。(4)该装置不能使用水、醇、酸作溶剂,其理由是
(5)
 在
在 中完全燃烧放出热量为
中完全燃烧放出热量为 。写出热化学方程式:
。写出热化学方程式:(6)工业上制备亚硫酰氯:
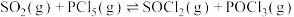
 。下列措施能提高
。下列措施能提高 平衡转化率的是___________(填字母)。
平衡转化率的是___________(填字母)。| A.升高温度 | B.增大压强 | C.加入催化剂 | D.分离 |
您最近一年使用:0次
名校
5 . 重铬酸铵[(NH4)2Cr2O7](M=252 g·mol-1)常用作分析试剂、催化剂及媒染剂等。某化学兴趣小组对重铬酸铵的一些性质及组成进行探究。已知: + H2O
+ H2O 2
2 +2H+。回答下列问题:
+2H+。回答下列问题:
(1)在试管中加入少量重铬酸铵样品,滴加足量6 mol·L-1 NaOH溶液,振荡、微热。产生的现象是______________________ 。
(2)为探究重铬酸铵的分解产物,按下图连接好装置,在A中加入2.52 g重铬酸铵样品进行实验。

①实验过程中通入N2的主要目的是___________ 。
②实验过程中,若发现加热温度不够,如何改进?___________ 。
③C装置的作用是___________ 。加热A至恒重,观察到B中固体由白变蓝,D中酚酞溶液不变色,同时测得A中剩余固体1.52 g、B增重0.72 g,另外分解产物中还含有N2,则重铬酸铵受热分解的化学方程式为___________ 。
(3)为探究溶液酸性增强对铬(VI)盐溶液氧化性或Na2SO3溶液还原性的影响,该小组利用下图装置继续实验(已知物质氧化性与还原性强弱差异越大,电压越大)。

a.K闭合时,记录电压。
b.向U型管左侧溶液中滴加硫酸至pH=2后,电压增大了y。
c.继续向U型管右侧溶液中滴加硫酸后,无气体逸出,电压几乎不变。
①上述实验得出结论:___________ ;酸性增强,对Na2SO3溶液还原性几乎无影响。
②有同学认为:随着溶液酸性的增强,溶液中O2的氧化性增强也会使电压增大。补做实验:U型管左管中改为盛放___________ 溶液;然后向左管中滴加硫酸至pH=2后,测得电压增大了z,若z_____ y(填“>”、“<”或“=”),则证明实验结论不受影响。
 + H2O
+ H2O 2
2 +2H+。回答下列问题:
+2H+。回答下列问题:(1)在试管中加入少量重铬酸铵样品,滴加足量6 mol·L-1 NaOH溶液,振荡、微热。产生的现象是
(2)为探究重铬酸铵的分解产物,按下图连接好装置,在A中加入2.52 g重铬酸铵样品进行实验。

①实验过程中通入N2的主要目的是
②实验过程中,若发现加热温度不够,如何改进?
③C装置的作用是
(3)为探究溶液酸性增强对铬(VI)盐溶液氧化性或Na2SO3溶液还原性的影响,该小组利用下图装置继续实验(已知物质氧化性与还原性强弱差异越大,电压越大)。

a.K闭合时,记录电压。
b.向U型管左侧溶液中滴加硫酸至pH=2后,电压增大了y。
c.继续向U型管右侧溶液中滴加硫酸后,无气体逸出,电压几乎不变。
①上述实验得出结论:
②有同学认为:随着溶液酸性的增强,溶液中O2的氧化性增强也会使电压增大。补做实验:U型管左管中改为盛放
您最近一年使用:0次
解题方法
6 . 某小组研究Cu2+和Fe3+的氧化性,进行如下实验。
实验Ⅰ: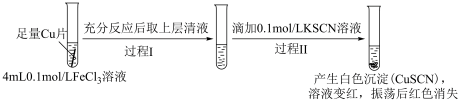
已知:1.(SCN)2 是黄色液体,氧化性:I2 < (SCN)2 < Br2。
2.K3[Fe(CN)6]溶液可用于Fe2+的检验,生成蓝色沉淀。
3.Fe3+与SCN-可以形成多种微粒,例如[Fe(SCN)]2+、Fe(SCN)3等溶液显红色。
(1)实验Ⅰ过程Ⅰ中Cu与FeCl3反应的化学方程式是___________ 。
(2)实验Ⅰ过程Ⅱ中溶液变红,说明产生了Fe3+,分析可能原因。
假设①:Fe2+被Cu2+氧化。
过程Ⅱ发生反应的电极反应式:
a.氧化反应:Fe2+-e-+3SCN-=Fe(SCN)3
b.还原反应:___________ 。
假设②:Cu2+和SCN-发生反应生成(SCN)2,进而将清液中的Fe2+氧化为Fe3+。
设计实验Ⅱ证实假设。
实验Ⅱ: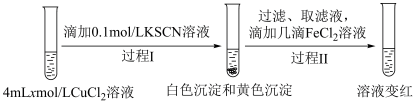
i.
___________ 。
ⅱ.实验Ⅱ中过程Ⅱ的离子方程式为___________ 。
(3)设计实验进一步研究Fe3+能否氧化SCN-。
实验Ⅲ:
①实验Ⅲ中加入K3[Fe(CN)6]溶液后,若___________ (写出实验现象),
说明在该实验条件下,Fe3+未能氧化SCN-。
②进一步查阅资料发现:Fe3+与SCN-可以发生氧化还原反应。该小组通过实验证明了该反应的发生。请你在答题卡方框中用文字或图示 设计实验方案,并描述相关的实验现象:___________ 。
实验Ⅰ:

已知:1.(SCN)2 是黄色液体,氧化性:I2 < (SCN)2 < Br2。
2.K3[Fe(CN)6]溶液可用于Fe2+的检验,生成蓝色沉淀。
3.Fe3+与SCN-可以形成多种微粒,例如[Fe(SCN)]2+、Fe(SCN)3等溶液显红色。
(1)实验Ⅰ过程Ⅰ中Cu与FeCl3反应的化学方程式是
(2)实验Ⅰ过程Ⅱ中溶液变红,说明产生了Fe3+,分析可能原因。
假设①:Fe2+被Cu2+氧化。
过程Ⅱ发生反应的电极反应式:
a.氧化反应:Fe2+-e-+3SCN-=Fe(SCN)3
b.还原反应:
假设②:Cu2+和SCN-发生反应生成(SCN)2,进而将清液中的Fe2+氧化为Fe3+。
设计实验Ⅱ证实假设。
实验Ⅱ:

i.

ⅱ.实验Ⅱ中过程Ⅱ的离子方程式为
(3)设计实验进一步研究Fe3+能否氧化SCN-。
实验Ⅲ:

①实验Ⅲ中加入K3[Fe(CN)6]溶液后,若
说明在该实验条件下,Fe3+未能氧化SCN-。
②进一步查阅资料发现:Fe3+与SCN-可以发生氧化还原反应。该小组通过实验证明了该反应的发生。请你在
您最近一年使用:0次
名校
7 . 中国明确提出2030年“碳达峰”与2060年“碳中和”目标。 选择性甲烷化是有望实现“双碳目标”具有良好应用前景的处理方法。富氢气氛下,
选择性甲烷化是有望实现“双碳目标”具有良好应用前景的处理方法。富氢气氛下, 、
、 均可与
均可与 发生甲烷化反应:
发生甲烷化反应:
Ⅰ.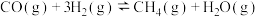
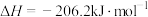
Ⅱ.
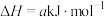
回答下列问题:
(1)已知
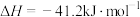 ,则
,则
_______ 。
(2)请从平衡移动的角度,提出三种可行的操作提高反应Ⅰ中 的转化率
的转化率_______ 、_______ 、_______ 。
(3)400℃时,选用镍基催化剂,向 密闭容器中通入
密闭容器中通入 、
、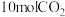 和
和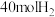 进行反应,平衡后测得
进行反应,平衡后测得 ,
,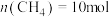 。
。
① 的平衡转化率为
的平衡转化率为_______ 。
②反应Ⅱ平衡常数K的数值最接近下列哪个数值_______ (填字母)。
A.20 B.2 C.0.2 D.0.02
(4)其他条件相同,反应Ⅱ使用两种不同催化剂,反应相同的时间,测得 的转化率随温度变化的影响如图所示。
的转化率随温度变化的影响如图所示。
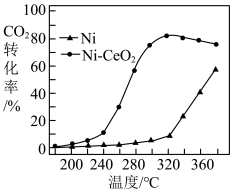
①请解释使用 催化剂时,随着温度的升高,为何
催化剂时,随着温度的升高,为何 转化率先升高后降低
转化率先升高后降低_____ ?
②根据图像分析,下列说法错误的是_______ (填字母)。
A.在200~360℃范围内, 的催化效果比
的催化效果比 更好
更好
B.可以通过改变催化剂种类的方式调控 平衡转化率
平衡转化率
C.在240℃附近,可以通过延长反应时间的方式提高 的转化率
的转化率
(5) 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
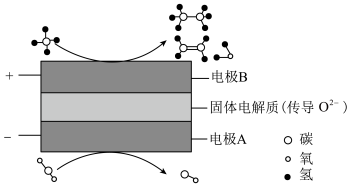
①阴极上的反应式为_______ 。
②阳极上生成乙烯 和乙烷
和乙烷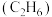 的反应式分别为
的反应式分别为_______ 和_______ 。
③若生成的乙烯 和乙烷
和乙烷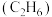 的体积比为
的体积比为 ,则消耗的
,则消耗的 和
和 的体积比为
的体积比为_______ 。
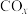 选择性甲烷化是有望实现“双碳目标”具有良好应用前景的处理方法。富氢气氛下,
选择性甲烷化是有望实现“双碳目标”具有良好应用前景的处理方法。富氢气氛下, 、
、 均可与
均可与 发生甲烷化反应:
发生甲烷化反应:Ⅰ.
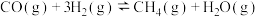
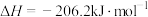
Ⅱ.

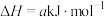
回答下列问题:
(1)已知

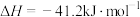 ,则
,则
(2)请从平衡移动的角度,提出三种可行的操作提高反应Ⅰ中
 的转化率
的转化率(3)400℃时,选用镍基催化剂,向
 密闭容器中通入
密闭容器中通入 、
、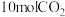 和
和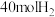 进行反应,平衡后测得
进行反应,平衡后测得 ,
,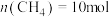 。
。①
 的平衡转化率为
的平衡转化率为②反应Ⅱ平衡常数K的数值最接近下列哪个数值
A.20 B.2 C.0.2 D.0.02
(4)其他条件相同,反应Ⅱ使用两种不同催化剂,反应相同的时间,测得
 的转化率随温度变化的影响如图所示。
的转化率随温度变化的影响如图所示。
①请解释使用
 催化剂时,随着温度的升高,为何
催化剂时,随着温度的升高,为何 转化率先升高后降低
转化率先升高后降低②根据图像分析,下列说法错误的是
A.在200~360℃范围内,
 的催化效果比
的催化效果比 更好
更好B.可以通过改变催化剂种类的方式调控
 平衡转化率
平衡转化率C.在240℃附近,可以通过延长反应时间的方式提高
 的转化率
的转化率(5)
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
①阴极上的反应式为
②阳极上生成乙烯
 和乙烷
和乙烷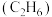 的反应式分别为
的反应式分别为③若生成的乙烯
 和乙烷
和乙烷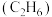 的体积比为
的体积比为 ,则消耗的
,则消耗的 和
和 的体积比为
的体积比为
您最近一年使用:0次
名校
8 . 某小组同学实验验证“ ”为可逆反应。
”为可逆反应。
(1)实验验证
实验Ⅰ:将含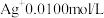 的溶液与
的溶液与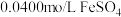 溶液(
溶液( )等体积混合,产生灰黑色沉淀,溶液呈黄色。
)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验Ⅱ:向少量Ag粉中加入 溶液(
溶液( ),固体完全溶解。
),固体完全溶解。
①取Ⅰ中沉淀,加入浓硝酸,证实灰黑色沉淀为Ag。请写出该反应的离子方程式:___________ 。
②Ⅱ中溶液选用 ,不选用
,不选用 的原因为
的原因为___________ 。
综合上述实验,证实“ ”为可逆反应。
”为可逆反应。
(2)采用电化学装置进行验证。
小组同学设计如图电化学装置进行实验:

①按照上图的装置图,组装好仪器后,分别在两烧杯中加入一定浓度的a、b两电解质溶液,闭合开关K,观察到的现象为:Ag电极上有灰黑色固体析出,指针向右偏转,一段时间后指针归零,说明此时反应达到平衡。则a为___________ 溶液;b为___________ 溶液;(写a、b化学式)
②再向左侧烧杯中滴加较浓的___________ 溶液(填化学式),产生的现象为___________ ,表明“ ”为可逆反应。
”为可逆反应。
 ”为可逆反应。
”为可逆反应。(1)实验验证
实验Ⅰ:将含
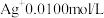 的溶液与
的溶液与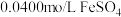 溶液(
溶液( )等体积混合,产生灰黑色沉淀,溶液呈黄色。
)等体积混合,产生灰黑色沉淀,溶液呈黄色。实验Ⅱ:向少量Ag粉中加入
 溶液(
溶液( ),固体完全溶解。
),固体完全溶解。①取Ⅰ中沉淀,加入浓硝酸,证实灰黑色沉淀为Ag。请写出该反应的离子方程式:
②Ⅱ中溶液选用
 ,不选用
,不选用 的原因为
的原因为综合上述实验,证实“
 ”为可逆反应。
”为可逆反应。(2)采用电化学装置进行验证。
小组同学设计如图电化学装置进行实验:

①按照上图的装置图,组装好仪器后,分别在两烧杯中加入一定浓度的a、b两电解质溶液,闭合开关K,观察到的现象为:Ag电极上有灰黑色固体析出,指针向右偏转,一段时间后指针归零,说明此时反应达到平衡。则a为
②再向左侧烧杯中滴加较浓的
 ”为可逆反应。
”为可逆反应。
您最近一年使用:0次
9 . 下图是飞船和空间站中利用Sabatier反应再生氧气的大体流程。
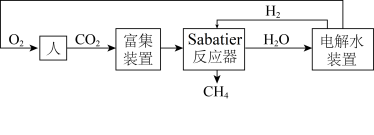
(1)已知:2H2(g)+O2(g) 2H2O(g) ∆H=﹣483.6kJ·mol-1
2H2O(g) ∆H=﹣483.6kJ·mol-1
CH4(g)+2O2(g) CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1
CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1
则Sabatier反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的∆H=
CH4(g)+2H2O(g)的∆H=___________ 。
(2)二氧化碳的富集装置如图所示。
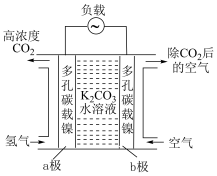
①该富集法采用___________ 原理(填“原电池”或“电解池”)。当a极上消耗1molH2,并保持电解液溶质不变时,b极上除去的CO2在标准状况下的体积为___________ 。
②工作一段时间后,K2CO3溶液的pH___________ (填“变大”“变小”或“不变”)。
(3)一定条件下,进行上述Sabatier反应:
①在恒温恒压装置中,下列能说明反应达到平衡状态的是___________ 。
a.混合气体的密度不再改变 b.混合气体的总质量不再改变
c.混合气体平均摩尔质量不再改变 d.v正(CO2)=2v逆(H2O)
②在Sabatier反应器的前端维持较高温度800K,其目的是___________ 。
③在温度为T、压强为P0的条件下,按n(CO2)∶n(H2)=1∶4投料进行反应,平衡时CO2的转化率为50%,Kp=___________ (用P0表示)。已知Kp是以分压表示的平衡常数,分压=总压×物质的量分数。
(4)在298K时,几种离子的摩尔电导率如下表。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现O2的再生,从导电性角度选择最适宜的电解质为___________ (填化学式)。

(1)已知:2H2(g)+O2(g)
 2H2O(g) ∆H=﹣483.6kJ·mol-1
2H2O(g) ∆H=﹣483.6kJ·mol-1CH4(g)+2O2(g)
 CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1
CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1则Sabatier反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的∆H=
CH4(g)+2H2O(g)的∆H=(2)二氧化碳的富集装置如图所示。

①该富集法采用
②工作一段时间后,K2CO3溶液的pH
(3)一定条件下,进行上述Sabatier反应:
①在恒温恒压装置中,下列能说明反应达到平衡状态的是
a.混合气体的密度不再改变 b.混合气体的总质量不再改变
c.混合气体平均摩尔质量不再改变 d.v正(CO2)=2v逆(H2O)
②在Sabatier反应器的前端维持较高温度800K,其目的是
③在温度为T、压强为P0的条件下,按n(CO2)∶n(H2)=1∶4投料进行反应,平衡时CO2的转化率为50%,Kp=
(4)在298K时,几种离子的摩尔电导率如下表。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现O2的再生,从导电性角度选择最适宜的电解质为
| 离子种类 | H+ | OH- |  SO SO | Cl- |  CO CO | K+ | Na+ |
| 摩尔电导率×104(S·m2·mol-1) | 349.82 | 198.0 | 79.8 | 76.34 | 72.0 | 73.52 | 50.11 |
您最近一年使用:0次
名校
10 . 人们应用原电池原理制作了多种电池,以满足不同的需要。以下是几种不同形式的原电池装置,请根据题中提供的信息,填写空格。
(1)某原电池的装置如图1所示。若需将反应
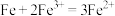 设计成如图1所示的原电池装置,则A(负极)极材料为
设计成如图1所示的原电池装置,则A(负极)极材料为
(2)如图2是一个双液原电池装置图,下列说法正确的是 (填字母)。

A.盐桥中的阴离子向 溶液移动 溶液移动 | B.电子流动方向为Zn→盐桥→Cu |
| C.铜片作电池的正极 | D.该电池比单液原电池的电流更稳定 |
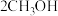 和
和 组合形成的质子交换膜燃料电池的结构示意图如图3。电池总反应为
组合形成的质子交换膜燃料电池的结构示意图如图3。电池总反应为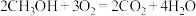 ,则a处充入的是
,则a处充入的是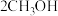 燃料电池消耗的
燃料电池消耗的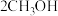 的质量为
的质量为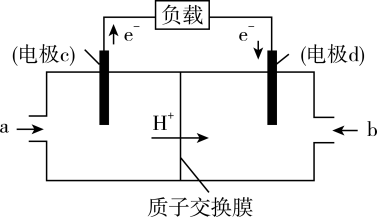
您最近一年使用:0次
2023-07-21更新
|
145次组卷
|
2卷引用:辽宁省本溪市第一中学2023-2024学年高二上学期11月期中考试化学试题



