名校
解题方法
1 . 电池是人类生产和生活中的重要能量来源,各式各样电池的发明是化学对人类的一项重要贡献。
(1)生活中利用原电池原理生产了各种各样的电池,下列有关电池的叙述正确的是___________ (填字母)。
A.锌锰电池工作一段时间后碳棒会变细
B.氢氧燃料电池可将化学能直接转变为电能
C.铅蓄电池负极是 ,正极是Pb
,正极是Pb
(2)氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式都可表示为: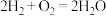 。
。
①酸式氢氧燃料电池的电解质是酸,其正极的电极反应式为___________ 。
②工作一段时间后,电解质溶液的pH将___________ (填“变大”、“变小”或“不变”)。
(3)将 设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为:
设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为: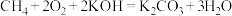 。
。___________ (填“A”或“B”)电极入口通甲烷,其电极反应式为___________ 。
(4)某同学欲把反应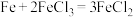 设计成原电池,请写出负极的电极反应式:
设计成原电池,请写出负极的电极反应式:___________ 。
(1)生活中利用原电池原理生产了各种各样的电池,下列有关电池的叙述正确的是
A.锌锰电池工作一段时间后碳棒会变细
B.氢氧燃料电池可将化学能直接转变为电能
C.铅蓄电池负极是
 ,正极是Pb
,正极是Pb(2)氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式都可表示为:
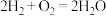 。
。①酸式氢氧燃料电池的电解质是酸,其正极的电极反应式为
②工作一段时间后,电解质溶液的pH将
(3)将
 设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为:
设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒),电池总反应为: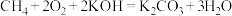 。
。
(4)某同学欲把反应
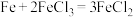 设计成原电池,请写出负极的电极反应式:
设计成原电池,请写出负极的电极反应式:
您最近一年使用:0次
2023-04-16更新
|
553次组卷
|
3卷引用:福建省福州第三中学2022-2023学年高一下学期期中考试化学试题
名校
2 . 电化学及其产品与能源、材料、环境和健康等领域紧密联系,被广泛地应用于生产、生活的许多方面。
(1)如图为氢氧燃料电池的构造示意图。
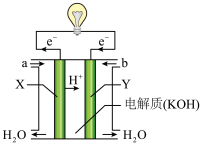
①氧气从___________ (填“a”或“b”)口通入;电池工作时,OH-向___________ (填“X”或“Y”)极移动。
②某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,则电池工作时负极电极反应式为___________ 。
(2)王航同学用石墨作电极电解Cu(NO3)2溶液。
①电解过程中,阳极的电极反应式为___________ 。
②电解一段时间后,溶液蓝色变浅。若要将电解质溶液恢复到电解前的状态,可加入的物质是___________ (任填一种)。
(3)铅酸蓄电池有电压稳定、安全、价格低廉等优点而广泛应用于生产生活中,其电池反应为Pb+PbO2+2H2SO4 2PbSO4+2H2O。用铅酸蓄电池电化学降解法处理酸性硝酸盐污水,电化学降解NO
2PbSO4+2H2O。用铅酸蓄电池电化学降解法处理酸性硝酸盐污水,电化学降解NO 的原理如图所示。
的原理如图所示。
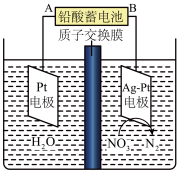
①A为铅酸蓄电池的___________ (填“Pb”或“PbO2”)极。
②Ag-Pt电极上的电极反应式为___________ 。
③若电路中转移了2mole-,则铅酸蓄电池的正极增重___________ g;质子交换膜两侧电解液的质量变化差(|Δm左|-|Δm右|)为___________ g。
(1)如图为氢氧燃料电池的构造示意图。

①氧气从
②某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,则电池工作时负极电极反应式为
(2)王航同学用石墨作电极电解Cu(NO3)2溶液。
①电解过程中,阳极的电极反应式为
②电解一段时间后,溶液蓝色变浅。若要将电解质溶液恢复到电解前的状态,可加入的物质是
(3)铅酸蓄电池有电压稳定、安全、价格低廉等优点而广泛应用于生产生活中,其电池反应为Pb+PbO2+2H2SO4
 2PbSO4+2H2O。用铅酸蓄电池电化学降解法处理酸性硝酸盐污水,电化学降解NO
2PbSO4+2H2O。用铅酸蓄电池电化学降解法处理酸性硝酸盐污水,电化学降解NO 的原理如图所示。
的原理如图所示。
①A为铅酸蓄电池的
②Ag-Pt电极上的电极反应式为
③若电路中转移了2mole-,则铅酸蓄电池的正极增重
您最近一年使用:0次
名校
解题方法
3 . 我国能够造出几百万一颗的卫星芯片,但是在智能手机芯片上却屡屡遭到美国垄断。制造手机芯片需要高纯硅,工业上制取高纯硅的流程如图。请根据所学知识回答下列问题。
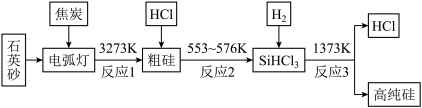
(1)石英砂的主要成分为____________ (填化学式),实验室不能用石英坩埚熔融氢氧化钠的原因是________________________ 。
(2)整个过程中可以循环利用的物质为____________ (填化学式)。
(3)晶体硅为灰黑色固体,溶于氢氟酸可生成氢气。写出晶体硅与氢氟酸反应的化学方程式:__________________ 。
(4)某科研团队设计了一种以硅作为基底的微型直接氢气酸性燃料电池,其工作原理如图所示:
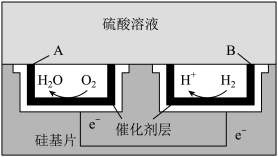
①电池工作时,电子由______ (填“A”或“B”,下同)电极流向______ 电极。
②电池工作时,B电极上的电极反应式为__________________ 。
③每转移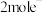 ,A电极消耗标准状况下的
,A电极消耗标准状况下的 的体积为
的体积为______ L。

(1)石英砂的主要成分为
(2)整个过程中可以循环利用的物质为
(3)晶体硅为灰黑色固体,溶于氢氟酸可生成氢气。写出晶体硅与氢氟酸反应的化学方程式:
(4)某科研团队设计了一种以硅作为基底的微型直接氢气酸性燃料电池,其工作原理如图所示:

①电池工作时,电子由
②电池工作时,B电极上的电极反应式为
③每转移
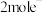 ,A电极消耗标准状况下的
,A电极消耗标准状况下的 的体积为
的体积为
您最近一年使用:0次
2023-03-31更新
|
573次组卷
|
3卷引用:广东省部分名校2022-2023学年高一下学期3月大联考化学试题
广东省部分名校2022-2023学年高一下学期3月大联考化学试题四川省泸县第五中学2022-2023学年高一下学期5月期中考试化学试题(已下线)考点12 硅及其无机非金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
4 . 为了探究原电池的工作原理,某研究性学习小组进行了如下实验。
(1)分别按图1中甲、乙所示装置进行实验,甲中两个烧杯中的溶液为同浓度的稀硫酸。
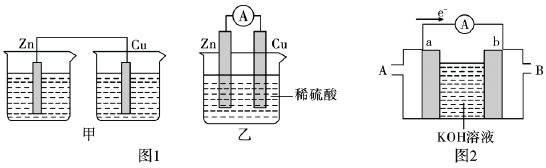
①以下叙述中正确的是_______ (填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两装置中铜片表面均有气泡产生
C.乙的外电路中电流方向Cu→Zn
D.如果将装置乙中锌片换成铁片,则电路中的电流方向不变
②在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是_______ 。
③在乙实验中,如果把硫酸换成硫酸铜溶液,可观察到正极_______ (填实验现象),其对应的电极反应式为_______ 。
(2)某氢氧燃料电池装置如图2所示,a、b均为惰性电极。
①电池工作时,空气从_______ (填“A”或“B”)口通入。
②正极上的电极反应式为_______ ,当电路中转移0.4mol电子时,理论上负极通入的气体在标准状况下的体积为_______ L。
(1)分别按图1中甲、乙所示装置进行实验,甲中两个烧杯中的溶液为同浓度的稀硫酸。

①以下叙述中正确的是
A.甲中锌片是负极,乙中铜片是正极
B.两装置中铜片表面均有气泡产生
C.乙的外电路中电流方向Cu→Zn
D.如果将装置乙中锌片换成铁片,则电路中的电流方向不变
②在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是
③在乙实验中,如果把硫酸换成硫酸铜溶液,可观察到正极
(2)某氢氧燃料电池装置如图2所示,a、b均为惰性电极。
①电池工作时,空气从
②正极上的电极反应式为
您最近一年使用:0次
名校
解题方法
5 . 电化学在科技、生产、社会和生活的各个发面都发挥着重要的作用。
(1)图中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择_______ (填字母)。这种防止金属材料腐蚀的方法叫做_______。
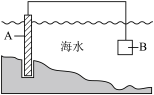
a.金块 b.锌板 c.铜板 d.钠块
氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺,节能超过30%,在此工艺中,物料传输和转化关系如图。(电极均为石墨电极)
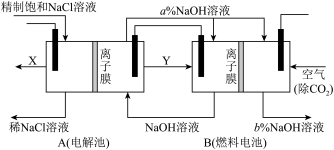
(2)写出A装置中发生反应的离子反应方程式:_______,分析比较图示中a%与b%的大小:a%_______b%(填“>”“<”或“=”)。
(3)写出燃料电池B中的负极的电极反应:_______。
通过NO传感器可监测汽车尾气中NO的含量,工作原理如图所示:
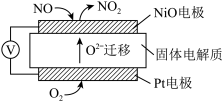
(4)NiO电极上发生的是反应_______(填“氧化”或“还原”)。Pt电极上的电极反应式为_______。
(1)图中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择_______ (填字母)。这种防止金属材料腐蚀的方法叫做_______。

a.金块 b.锌板 c.铜板 d.钠块
氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺,节能超过30%,在此工艺中,物料传输和转化关系如图。(电极均为石墨电极)

(2)写出A装置中发生反应的离子反应方程式:_______,分析比较图示中a%与b%的大小:a%_______b%(填“>”“<”或“=”)。
(3)写出燃料电池B中的负极的电极反应:_______。
通过NO传感器可监测汽车尾气中NO的含量,工作原理如图所示:

(4)NiO电极上发生的是反应_______(填“氧化”或“还原”)。Pt电极上的电极反应式为_______。
您最近一年使用:0次
2022-10-11更新
|
300次组卷
|
2卷引用:山东省枣庄市第三中学2022-2023学年高二上学期10月阶段检测化学试题
解题方法
6 . 回答下列问题
(1)能源是现代社会物质文明的原动力,与我们每个人息息相关。下图是 反应过程中的能量变化图。
反应过程中的能量变化图。
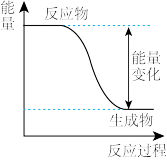
①由图可知,反应物的总键能_______ (填“ ”、“
”、“ ”或“
”或“ ”)生成物的总键能。
”)生成物的总键能。
②已知 氢气完全燃烧生成水蒸气时放出
氢气完全燃烧生成水蒸气时放出 的能量,且氧气中
的能量,且氧气中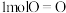 键完全断裂时需要吸收
键完全断裂时需要吸收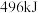 的能量,水蒸气中
的能量,水蒸气中 键形成时放出
键形成时放出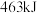 的能量,则氢气中
的能量,则氢气中 键断裂时吸收的能量为
键断裂时吸收的能量为_______ 。
(2)化学电池在通讯、交通及日常生活中有着广泛的应用。
①铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4+2H2O Pb+PbO2+2H2SO4,铅蓄电池放电时是将
Pb+PbO2+2H2SO4,铅蓄电池放电时是将_______ 能转化为_______ 能,负极是_______ (填物质化学式)。
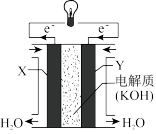
②下图为氢氧燃料电池的构造示意图,由此判断Y极为电池的_______ 极,电极反应式为_______ ; 向
向_______ (填“正”或“负”)极作定向移动,电路中每转移 电子,标准状况下负极上消耗气体的体积是
电子,标准状况下负极上消耗气体的体积是_______ L。
③为了验证 与
与 氧化性强弱,设计一个装置,下列装置既能产生电流又能达到实验目的的是
氧化性强弱,设计一个装置,下列装置既能产生电流又能达到实验目的的是_______ 。
A. B.
B. 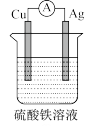 C.
C.  D.
D. 
(1)能源是现代社会物质文明的原动力,与我们每个人息息相关。下图是
 反应过程中的能量变化图。
反应过程中的能量变化图。 
①由图可知,反应物的总键能
 ”、“
”、“ ”或“
”或“ ”)生成物的总键能。
”)生成物的总键能。②已知
 氢气完全燃烧生成水蒸气时放出
氢气完全燃烧生成水蒸气时放出 的能量,且氧气中
的能量,且氧气中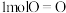 键完全断裂时需要吸收
键完全断裂时需要吸收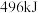 的能量,水蒸气中
的能量,水蒸气中 键形成时放出
键形成时放出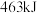 的能量,则氢气中
的能量,则氢气中 键断裂时吸收的能量为
键断裂时吸收的能量为(2)化学电池在通讯、交通及日常生活中有着广泛的应用。
①铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4+2H2O
 Pb+PbO2+2H2SO4,铅蓄电池放电时是将
Pb+PbO2+2H2SO4,铅蓄电池放电时是将②下图为氢氧燃料电池的构造示意图,由此判断Y极为电池的
 向
向 电子,标准状况下负极上消耗气体的体积是
电子,标准状况下负极上消耗气体的体积是
③为了验证
 与
与 氧化性强弱,设计一个装置,下列装置既能产生电流又能达到实验目的的是
氧化性强弱,设计一个装置,下列装置既能产生电流又能达到实验目的的是A.
 B.
B.  C.
C.  D.
D. 
您最近一年使用:0次
解题方法
7 . Ⅰ.兴趣小组的同学们把铝片投入盛有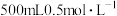 硫酸溶液的烧杯中,该铝片与硫酸产生氢气的速率与反应时间的关系可用如图曲线来表示。回答下列问题:
硫酸溶液的烧杯中,该铝片与硫酸产生氢气的速率与反应时间的关系可用如图曲线来表示。回答下列问题:

(1)用离子方程式解释曲线0-a段不产生氢气的原因_______ 。
(2)曲线b→c段,产生氢气的速率增加较快的主要原因是_______ 。
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因是_______ 。
Ⅱ.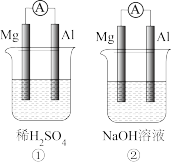
(4)装置①中负极是:_______ ,正极反应式为:_______ ;
(5)装置②中电子从_______ (填“镁片”或“铝片”)流出,该原电池工作一段时间后,溶液pH_______ 。(填“增大”或“减小”)。
(6)2022年北京冬奥会使用氢燃料电池车有利于实现碳达峰和碳中和,下列说法错误的是_______。
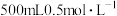 硫酸溶液的烧杯中,该铝片与硫酸产生氢气的速率与反应时间的关系可用如图曲线来表示。回答下列问题:
硫酸溶液的烧杯中,该铝片与硫酸产生氢气的速率与反应时间的关系可用如图曲线来表示。回答下列问题:
(1)用离子方程式解释曲线0-a段不产生氢气的原因
(2)曲线b→c段,产生氢气的速率增加较快的主要原因是
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因是
Ⅱ.

(4)装置①中负极是:
(5)装置②中电子从
(6)2022年北京冬奥会使用氢燃料电池车有利于实现碳达峰和碳中和,下列说法错误的是_______。
| A.电能属于二次能源 |
| B.氢燃料电池是一种具有广阔应用前景的绿色电源 |
| C.氢燃料电池能量的利用率比氢气直接燃烧高 |
| D.氢燃料电池工作时,氢气在正极发生还原反应 |
您最近一年使用:0次
2022-07-20更新
|
704次组卷
|
3卷引用:陕西省宝鸡市渭滨区2021-2022学年高一下学期期末考试化学试题
名校
8 . 能源是国民经济发展的重要基础。请根据所学知识回答下列问题:
Ⅰ.火箭推进器中装有还原剂肼 和强氧化剂过氧化氢
和强氧化剂过氧化氢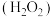 ,当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256.4kJ的热量。
,当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256.4kJ的热量。
(1)肼的结构式为_______ ,过氧化氢的电子式为_______ 。
(2)写出反应的热化学方程式:_______ 。
(3)已知
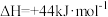 ,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是
,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是_______ kJ。
(4)上述反应用于火箭推进器,除释放大量热和快速产生大量气体外,还有一个很突出的优点是_______ 。
Ⅱ.氨气是一种重要的化学物质,可用于制取化肥和硝酸等。合成氨原料中的可用CO在高温下与水蒸气反应制得。已知:在25℃、101kPa下,
①2C(石墨,s)

②
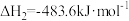
③C(石墨,s)
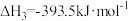
(5)25℃、101kPa下,CO与水蒸气反应转化为 和
和 的热化学方程式为
的热化学方程式为_______ 。
Ⅲ.氢氧燃料电池是符合绿色化学理念的新型发电装置。电池示意图如图所示,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。
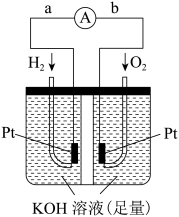
(6)其正极上的电极反应式为_______ ,若将负极改为通入 ,写出其负极上的电极反应式:
,写出其负极上的电极反应式:_______ 。
Ⅰ.火箭推进器中装有还原剂肼
 和强氧化剂过氧化氢
和强氧化剂过氧化氢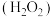 ,当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256.4kJ的热量。
,当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256.4kJ的热量。(1)肼的结构式为
(2)写出反应的热化学方程式:
(3)已知

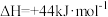 ,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是
,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是(4)上述反应用于火箭推进器,除释放大量热和快速产生大量气体外,还有一个很突出的优点是
Ⅱ.氨气是一种重要的化学物质,可用于制取化肥和硝酸等。合成氨原料中的可用CO在高温下与水蒸气反应制得。已知:在25℃、101kPa下,
①2C(石墨,s)


②

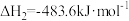
③C(石墨,s)

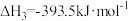
(5)25℃、101kPa下,CO与水蒸气反应转化为
 和
和 的热化学方程式为
的热化学方程式为Ⅲ.氢氧燃料电池是符合绿色化学理念的新型发电装置。电池示意图如图所示,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。

(6)其正极上的电极反应式为
 ,写出其负极上的电极反应式:
,写出其负极上的电极反应式:
您最近一年使用:0次
2022-06-16更新
|
261次组卷
|
3卷引用:辽宁省协作校2021-2022学年高一下学期6月考试化学试题
名校
9 . 铜基催化剂催化甲醇水蒸气重整制氢是液体燃料制氢的重要方向,主要包含甲醇水蒸气重整反应、甲醇分解反应和水气变换反应,具体反应方程式如下:
Ⅰ.

Ⅱ.

Ⅲ.

回答下列问题:
(1)则
___________  。
。
(2)有利于提高甲醇平衡转化率的是___________ (填标号)。
A.增加 的用量 B.恒温恒压条件下通入Ar
的用量 B.恒温恒压条件下通入Ar
C.升高温度 D.选择更高效的催化剂 E.及时分离出
(3)一定条件下,向压强为 的恒压密闭容器中通入
的恒压密闭容器中通入 、
、 物质的量比为
物质的量比为 的混合气体,发生上述反应,达到平衡时,容器中
的混合气体,发生上述反应,达到平衡时,容器中 、
、 ,此时
,此时 的产率为
的产率为___________ ,反应Ⅱ的以分压表示的化学平衡常数 为
为___________ (用含 的代数式表示)。
的代数式表示)。
(4)液相空速表示进料速度的快慢。不同温度下,平衡时甲醇转化率和CO浓度随甲醇液相空速的变化如图所示。随温度升高,CO浓度变化的原因是___________ ,制氢产物可以用于车载燃料电池,CO含量太高会对电池产生巨大危害。甲醇水蒸气重整制氢的适宜条件是___________ ℃,___________  。
。 自由迁移的固体电解质氢氧燃料电池中,
自由迁移的固体电解质氢氧燃料电池中, 放电的电极反应式为
放电的电极反应式为___________ 。
Ⅰ.


Ⅱ.


Ⅲ.


回答下列问题:
(1)则

 。
。(2)有利于提高甲醇平衡转化率的是
A.增加
 的用量 B.恒温恒压条件下通入Ar
的用量 B.恒温恒压条件下通入ArC.升高温度 D.选择更高效的催化剂 E.及时分离出

(3)一定条件下,向压强为
 的恒压密闭容器中通入
的恒压密闭容器中通入 、
、 物质的量比为
物质的量比为 的混合气体,发生上述反应,达到平衡时,容器中
的混合气体,发生上述反应,达到平衡时,容器中 、
、 ,此时
,此时 的产率为
的产率为 为
为 的代数式表示)。
的代数式表示)。(4)液相空速表示进料速度的快慢。不同温度下,平衡时甲醇转化率和CO浓度随甲醇液相空速的变化如图所示。随温度升高,CO浓度变化的原因是
 。
。
 自由迁移的固体电解质氢氧燃料电池中,
自由迁移的固体电解质氢氧燃料电池中, 放电的电极反应式为
放电的电极反应式为
您最近一年使用:0次
2024-02-22更新
|
199次组卷
|
3卷引用:山东省济南市名校联盟2023-2024学年高三下学期开学考试化学试题
解题方法
10 . 废旧碱性锌锰电池经以下工艺处理后,可实现钾、锌、锰等元素的有效回收。回答下列问题:
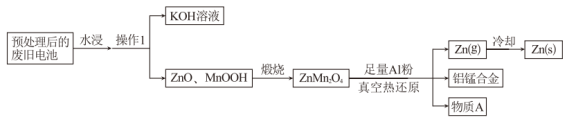
(1)“操作1”的名称为___________ 。
(2) 中
中 元素的化合价为
元素的化合价为___________ 。
(3)“煅烧”得到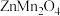 的化学方程式为
的化学方程式为___________ 。
(4)物质 的主要成分为
的主要成分为___________ (填化学式)。
(5)预处理后的废旧电池质量为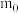 ,其中
,其中 元素的质量分数为
元素的质量分数为 ,回收得到
,回收得到 的质量为
的质量为 ,则
,则 元素的回收率为
元素的回收率为___________ (回收率 )。
)。
(6)氢氧燃料电池选用 溶液作为电解质溶液,负极的电极反应式为
溶液作为电解质溶液,负极的电极反应式为___________ 。

(1)“操作1”的名称为
(2)
 中
中 元素的化合价为
元素的化合价为(3)“煅烧”得到
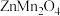 的化学方程式为
的化学方程式为(4)物质
 的主要成分为
的主要成分为(5)预处理后的废旧电池质量为
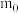 ,其中
,其中 元素的质量分数为
元素的质量分数为 ,回收得到
,回收得到 的质量为
的质量为 ,则
,则 元素的回收率为
元素的回收率为 )。
)。(6)氢氧燃料电池选用
 溶液作为电解质溶液,负极的电极反应式为
溶液作为电解质溶液,负极的电极反应式为
您最近一年使用:0次



