名校
解题方法
1 . 一氧化氮—空气质子交换膜燃料电池将化学能转化为电能,实现了制硝酸、发电环保三位一体的结合。如图所示,某同学设计用该电池探究将雾霾中的SO2、NO转化为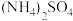 的原理和粗铜的精炼原理。
的原理和粗铜的精炼原理。
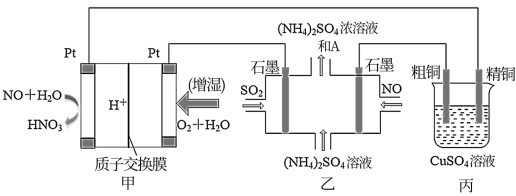
(1)燃料电池放电过程中正极的电极反应式________ 。
(2)乙装置中物质A是________ (填化学式),该装置电解过程阴极的电极反应式________ 。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,CuSO4溶液的浓度将________ (填“增大”、“减小”或“不变”)。
(4)若在标准状况下,甲装置有22.4 L O2参加反应,则乙装置中转化SO2和NO的物质试的量共有________ mol;丙装置中阴极析出的质量为________ g。
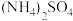 的原理和粗铜的精炼原理。
的原理和粗铜的精炼原理。
(1)燃料电池放电过程中正极的电极反应式
(2)乙装置中物质A是
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,CuSO4溶液的浓度将
(4)若在标准状况下,甲装置有22.4 L O2参加反应,则乙装置中转化SO2和NO的物质试的量共有
您最近半年使用:0次
2021-01-21更新
|
139次组卷
|
2卷引用:湖南省雅礼中学2020-2021学年高二上学期期中考试化学试题
名校
2 . 某研究机构使用Li—SO2Cl2电池作为电源电解制备Ni(H2PO2)2,其工作原理如图所示。已知电池反应为2Li+SO2Cl2=2LiCl+SO2↑,下列说法错误的是
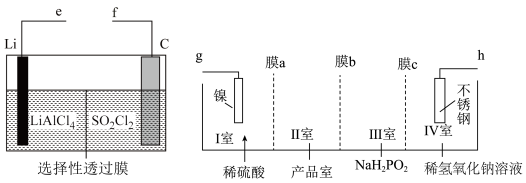

| A.电池中C电极的电极反应式为SO2Cl2+2e-=2Cl-+SO2↑ |
| B.电池的e极连接电解池的g极 |
| C.膜a、c是阳离子交换膜,膜b是阴离子交换膜 |
| D.电解池中不锈钢电极附近溶液的pH增大 |
您最近半年使用:0次
2021-01-01更新
|
1964次组卷
|
15卷引用:河北省“五个一名校联盟”(张家口一中、唐山一中、保定一中、邯郸一中、邢台一中)2021届高三上学期第一次诊断考试化学试题
河北省“五个一名校联盟”(张家口一中、唐山一中、保定一中、邯郸一中、邢台一中)2021届高三上学期第一次诊断考试化学试题(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)北京市昌平区新学道临川学校2021届高三上学期期末考试化学试题(已下线)小题19 多池多室带膜电化学装置 ——备战2021年高考化学经典小题考前必刷(全国通用)四川省成都市树德中学2020-2021学年高二下学期4月月考化学试题(已下线)课时31 新型电解池装置-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题六 化学反应与能量 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)山东师范大学附属中学2022-2023学年高二上学期第一次月考化学试题山东省2022-2023学年高二上学期学业水平测试化学试题福建省泉州市第七中学2022-2023学年高三上学期期中考化学试题(已下线)回归教材重难点07 重温“两池”原理-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)第4讲 电解池 金属的电化学腐蚀与防护山东省郓城第一中学2023-2024学年高二上学期开学考试化学试题河南省南阳市第一中学校2023-2024学年高二上学期第一次月考化学试题
名校
解题方法
3 . 已知装置E为电解池,认真观察下列装置,回答下列问题:
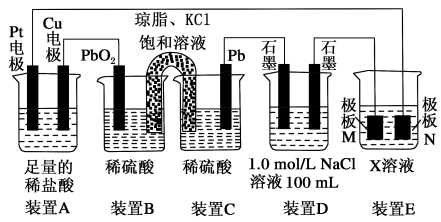
(1)装置D为___ (填“原电池”“电解池”或“电镀池”),装置C中Pb上发生的电极反应方程式为___ 。
(2)装置A中Pt电极的名称为___ (填“正极”“负极”“阴极”或“阳极”),装置A总反应的离子方程式为___ 。
(3)若装置E中的目的是在Cu材料上镀银,则X为___ ,极板N的材料为___ 。
(4)当装置B中PbO2电极质量改变12.8g时,装置D中产生气体的总物质的量为___ 。

(1)装置D为
(2)装置A中Pt电极的名称为
(3)若装置E中的目的是在Cu材料上镀银,则X为
(4)当装置B中PbO2电极质量改变12.8g时,装置D中产生气体的总物质的量为
您最近半年使用:0次
名校
4 . 某储能电池的原理如图所示,溶液中c(H+)=2.0mol•L-1,阴离子为SO ,a、b均为惰性电极,充电过程中左槽溶液颜色由蓝色变为黄色。下列叙述正确的是
,a、b均为惰性电极,充电过程中左槽溶液颜色由蓝色变为黄色。下列叙述正确的是
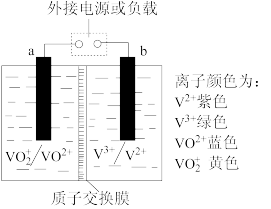
 ,a、b均为惰性电极,充电过程中左槽溶液颜色由蓝色变为黄色。下列叙述正确的是
,a、b均为惰性电极,充电过程中左槽溶液颜色由蓝色变为黄色。下列叙述正确的是
| A.当右槽溶液颜色由绿色变为紫色时,电池中能量转化形式为化学能转化为电能 |
| B.储能电池a、b两极间的电解质溶液中通过电子的定向移动形成闭合回路 |
C.充电过程中,a极的反应式为VO2+-e-+H2O=VO +2H+ +2H+ |
| D.放电时,H+从左槽迁移进入右槽 |
您最近半年使用:0次
2020-12-25更新
|
305次组卷
|
7卷引用:重庆市第八中学2020-2021学年高二上学期第一次月考化学试题
重庆市第八中学2020-2021学年高二上学期第一次月考化学试题安徽省蚌埠第三中学2020-2021学年高二上学期1月教学质量检测化学试题重庆市铁路中学高2020-2021学年高二上学期12月月考化学试题(已下线)专题30 电化学中的交换膜-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)专题08 新型化学电源(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)天津市第四十七中学2023-2024学年高二上学期12月月考化学试题安徽省安庆市怀宁县高河中学2023-2024学年高二上学期第三次月考化学试题
名校
解题方法
5 . 现以CO、O2、熔熔盐Z(Na2CO3)组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2,下列说法正确的是
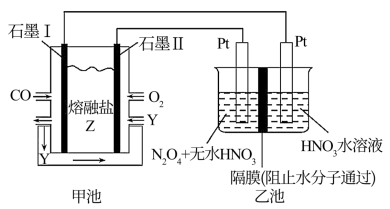

| A.石墨I是原电池的正极,发生氧化反应 |
B.甲池中的CO 向石墨I极移动 向石墨I极移动 |
| C.乙池中左端Pt极电极反应式:N2O4-2e-+H2O=N2O5+2H+ |
| D.若甲池消耗氧气2.24L,则乙池中产生氢气0.2mol |
您最近半年使用:0次
2020-12-25更新
|
167次组卷
|
2卷引用:重庆市第八中学2020-2021学年高二上学期第一次月考化学试题
名校
解题方法
6 . 如图是一个电化学过程的示意图,请按要求回答下列问题
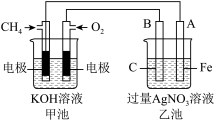
(1)甲池是___________ 装置(填“原电池”或“电解池”)
(2)写出电极反应式:通入CH4的电极___________ 。
(3)反应一段时间后,甲池中消耗 1.6 g甲烷,则乙池中某电极的质量增加__________ g。
(4)反应一段时间后,乙池中溶液成分发生了变化,想要完全恢复到电解前可加入的物质是___________ 。
(5)某工厂烟气中主要含SO2,可用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。
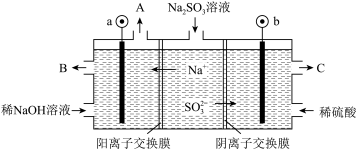
①图中a极要连接电源的___________ (填“正”或“负”)极,C口流出的物质是___________ 。
②SO 放电的电极反应式为
放电的电极反应式为___________ 。
③阴极的电极反应式为___________ 。

(1)甲池是
(2)写出电极反应式:通入CH4的电极
(3)反应一段时间后,甲池中消耗 1.6 g甲烷,则乙池中某电极的质量增加
(4)反应一段时间后,乙池中溶液成分发生了变化,想要完全恢复到电解前可加入的物质是
(5)某工厂烟气中主要含SO2,可用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。

①图中a极要连接电源的
②SO
 放电的电极反应式为
放电的电极反应式为③阴极的电极反应式为
您最近半年使用:0次
2020-12-24更新
|
296次组卷
|
2卷引用:山西省长治市第二中学校2020-2021学年高二上学期第二次月考化学试题
名校
7 . 磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一,采用湿法治金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有 Al 箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
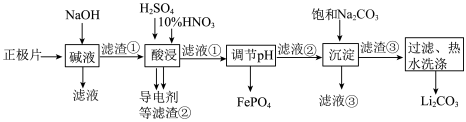
(1)从“正极”可以回收的金属有_______ 。
(2)“碱溶”时 Al 箔溶解的离子方程式为_______ 。
(3)“酸浸”时产生标况下2.24 L NO时,被氧化的LiFePO4为_______ mol(其他杂质不与HNO3反应)。
(4)磷酸亚铁锂电池总反应为:LiFePO4+6C Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向_______ (填“阳极”或“阴极”);放电时,正极反应式为_______ 。
(5)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取 1.40 g 试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入 HgCl2 饱和溶液,用二苯胺磺酸钠作指示剂,用 0.030 mol·L-1 重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液40.00 mL。
已知:2Fe3++Sn2++6Cl-=SnCl +2Fe2+
+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl +Hg2Cl2
+Hg2Cl2
6Fe2++Cr2O +14H+=6Fe3++2Cr3++7H2O
+14H+=6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是_______ 。
②磷酸亚铁锂电池中铁的含量为_______ 。

(1)从“正极”可以回收的金属有
(2)“碱溶”时 Al 箔溶解的离子方程式为
(3)“酸浸”时产生标况下2.24 L NO时,被氧化的LiFePO4为
(4)磷酸亚铁锂电池总反应为:LiFePO4+6C
 Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向(5)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取 1.40 g 试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入 HgCl2 饱和溶液,用二苯胺磺酸钠作指示剂,用 0.030 mol·L-1 重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液40.00 mL。
已知:2Fe3++Sn2++6Cl-=SnCl
 +2Fe2+
+2Fe2+4Cl-+Sn2++2HgCl2=SnCl
 +Hg2Cl2
+Hg2Cl26Fe2++Cr2O
 +14H+=6Fe3++2Cr3++7H2O
+14H+=6Fe3++2Cr3++7H2O①实验中加入HgCl2饱和溶液的目的是
②磷酸亚铁锂电池中铁的含量为
您最近半年使用:0次
名校
解题方法
8 . 碳氮及其化合物广泛存在于自然界中。
Ⅰ、(l)化学家Gethard Ertl证实了氢气与氮气在固体催化剂表面合成氨的过程,示意如图:
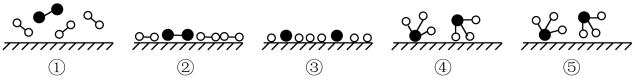
下列说法正确的是___________ (选填字母)。
A.①表示N2、H2分子中均是单键
B.②→③需要吸收能量
C.该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(2)氨气分解反应的热化学方程式如下:2NH3(g)⇌N2(g)+3H2(g) △H。若:N≡N键、H-H键和N-H键的键能分别记作a、b和c(单位:kJ•mol﹣l),则上述反应的△H=___________ kJ•mol﹣1。
Ⅱ、(1)CO与H2在一定条件下可反应生成甲醇:CO(g)+2H2(g)=CH3OH(g)。以KOH溶液为电解质溶液,甲醇、空气构成的原电池(图2)作图3的电源,电极M与___________ (填“X”或“Y”)极相连,N极的电极反应式为___________ 。
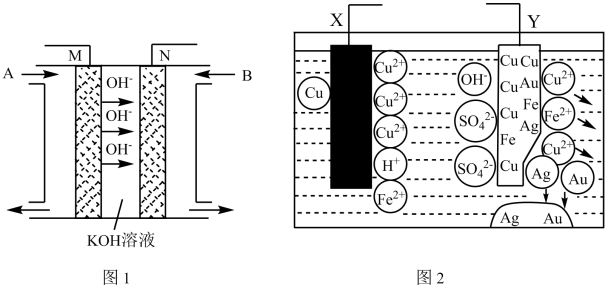
(2)若用图2燃料电池,以惰性电极电解100 mL 0.5 mol/L CuSO4溶液,阳极产生56 mL 标况下气体时,所得溶液的pH 为___________ (不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入___________ (填序号)。
A.CuO B.Cu(OH)2 C.CuCO3 D.Cu2(OH)2CO3
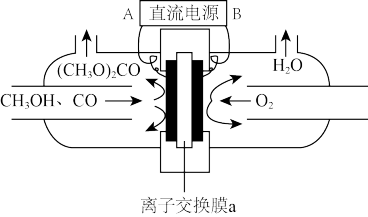
(3)以甲醇和CO为原料通过电化学合成碳酸二甲酯的工作原理如图所示。离子交换膜a为___________ (填“阳膜”或“阴膜”),阳极的电极反应式为___________ 。
Ⅰ、(l)化学家Gethard Ertl证实了氢气与氮气在固体催化剂表面合成氨的过程,示意如图:

下列说法正确的是
A.①表示N2、H2分子中均是单键
B.②→③需要吸收能量
C.该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(2)氨气分解反应的热化学方程式如下:2NH3(g)⇌N2(g)+3H2(g) △H。若:N≡N键、H-H键和N-H键的键能分别记作a、b和c(单位:kJ•mol﹣l),则上述反应的△H=
Ⅱ、(1)CO与H2在一定条件下可反应生成甲醇:CO(g)+2H2(g)=CH3OH(g)。以KOH溶液为电解质溶液,甲醇、空气构成的原电池(图2)作图3的电源,电极M与

(2)若用图2燃料电池,以惰性电极电解100 mL 0.5 mol/L CuSO4溶液,阳极产生56 mL 标况下气体时,所得溶液的pH 为
A.CuO B.Cu(OH)2 C.CuCO3 D.Cu2(OH)2CO3
(3)以甲醇和CO为原料通过电化学合成碳酸二甲酯的工作原理如图所示。离子交换膜a为

您最近半年使用:0次
解题方法
9 . 利用所学电化学反应原理,解决以下问题:
Ⅰ.如图所示,A为电源,B为浸透饱和食盐水和酚酞溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液如图所示。
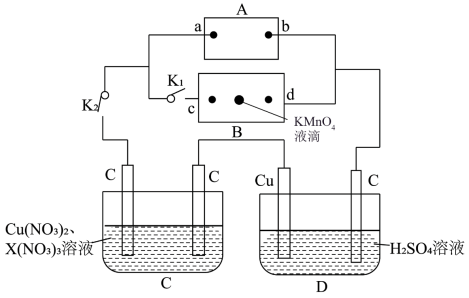
(1)闭合K1,断开K2,通电后,d端显红色,则电源b端为____ 极,若c、d为惰性电极,检验c端产物的方法为__ 。滤纸中央KMnO4溶液处发生的现象为____ 。
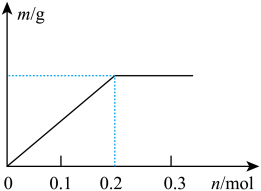
(2)已知C装置中溶液的溶质为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示,则Cu2+、X3+、H+氧化能力由大到小的顺序是_____ 。
(3)D装置中溶液是H2SO4溶液,则电极C端从开始至一段时间后的实验现象是____ 。
Ⅱ.电化学技术是有效解决CO、SO2、NOx等大气污染的重要方法,某兴趣小组以SO2为原料,采用电化学方法制取硫酸,装置如下:
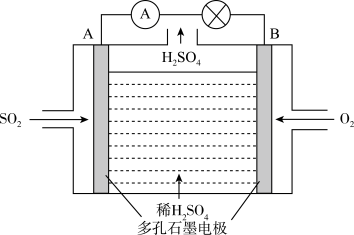
(1)电解质溶液中 离子向
离子向_____ (填“A极”或“B极” )移动。
(2)请写出负极电极反应式_____ 。
(3)用该原电池做电源,石墨做电极电解2L AgNO3和KNO3混合溶液,通电一段时间,两极均产生2.24 L(标准状况)气体,假设电解前后溶液体积不变,则电解后溶液中H+的浓度为____ ,析出银的质量___ g。
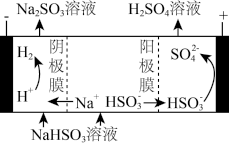
(4)用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图。请写出开始时阳极反应的电极反应式:_____ 。
Ⅰ.如图所示,A为电源,B为浸透饱和食盐水和酚酞溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液如图所示。

(1)闭合K1,断开K2,通电后,d端显红色,则电源b端为
(2)已知C装置中溶液的溶质为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示,则Cu2+、X3+、H+氧化能力由大到小的顺序是

(3)D装置中溶液是H2SO4溶液,则电极C端从开始至一段时间后的实验现象是
Ⅱ.电化学技术是有效解决CO、SO2、NOx等大气污染的重要方法,某兴趣小组以SO2为原料,采用电化学方法制取硫酸,装置如下:

(1)电解质溶液中
 离子向
离子向(2)请写出负极电极反应式
(3)用该原电池做电源,石墨做电极电解2L AgNO3和KNO3混合溶液,通电一段时间,两极均产生2.24 L(标准状况)气体,假设电解前后溶液体积不变,则电解后溶液中H+的浓度为
(4)用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图。请写出开始时阳极反应的电极反应式:

您最近半年使用:0次
名校
解题方法
10 . 图是新型镁-锂双离子二次电池,下列关于该电池的说法不正确的是
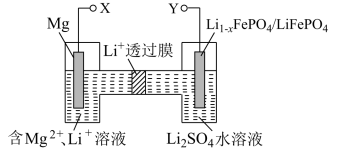

| A.放电时,Y电极上的电势比X电极上的高 |
B.放电时,正极的电极反应式: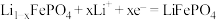 |
| C.充电时,外加电源的正极与Y相连 |
D.充电时,导线上每通过 ,左室溶液质量减轻12g ,左室溶液质量减轻12g |
您最近半年使用:0次
2020-11-14更新
|
959次组卷
|
4卷引用:黑龙江宾县第一中学2021届高三上学期第二次月考化学试题
黑龙江宾县第一中学2021届高三上学期第二次月考化学试题(已下线)第四章 化学反应与电能(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)吉林省长春吉大附中实验学校2021-2022学年高三上学期第三次摸底考试化学试题(已下线)选择题11-16



