名校
解题方法
1 . H2、CO、CH4等都是重要的能源,也是重要的化工原料。
(1)25℃,101kPa时,8.0gCH4完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:_______ 。
(2)水煤气中的CO和H2在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和5molH2,一定温度下发生反应: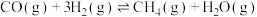 。测得CO和H2的转化率随时间变化如图所示。
。测得CO和H2的转化率随时间变化如图所示。
①从反应开始到6min,CO的平均反应速率_________ ,6min时,H2的转化率为________ 。
②下列叙述中能说明上述反应达到化学平衡状态的是___________ 。(填字母)
a.容器中混合气体的密度保持不变
b.容器中混合气体的总压强保持不变
c.容器中CH4的体积分数保持不变
d.单位时间内每消耗1molCO,同时生成1molCH4
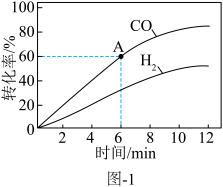
(3)甲烷燃料电池装置如图,电池总反应为 。通入CH4一端电极反应方程式为:
。通入CH4一端电极反应方程式为:__________ ;通入氧气的电极为电池的_________ (填“正极”或“负极”),若通入0.1molCH4充分反应,计算用此燃料电池电解饱和食盐水,理论上得到氢气的体积(标准状况下)__________ 。
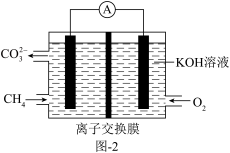
(1)25℃,101kPa时,8.0gCH4完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:
(2)水煤气中的CO和H2在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和5molH2,一定温度下发生反应:
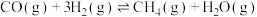 。测得CO和H2的转化率随时间变化如图所示。
。测得CO和H2的转化率随时间变化如图所示。
①从反应开始到6min,CO的平均反应速率
②下列叙述中能说明上述反应达到化学平衡状态的是
a.容器中混合气体的密度保持不变
b.容器中混合气体的总压强保持不变
c.容器中CH4的体积分数保持不变
d.单位时间内每消耗1molCO,同时生成1molCH4
(3)甲烷燃料电池装置如图,电池总反应为
 。通入CH4一端电极反应方程式为:
。通入CH4一端电极反应方程式为:
您最近半年使用:0次
2 . 为了实现“碳中和”,研发 的利用技术成为热点。
的利用技术成为热点。
反应I:
反应Ⅱ:
请回答:
(1)反应I能够自发进行的条件是__________ 。
(2)向 的恒容密闭容器中充入
的恒容密闭容器中充入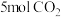 和
和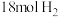 (起始压强为
(起始压强为 ),在不同温度下同时发生上述反应I和反应Ⅱ,得到平衡时各含碳物质的物质的量
),在不同温度下同时发生上述反应I和反应Ⅱ,得到平衡时各含碳物质的物质的量 与温度
与温度 的关系如下图所示。
的关系如下图所示。
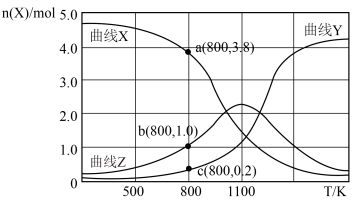
①写出曲线Y表示的含碳元素物质的化学式__________ 。
② 时,反应Ⅱ的平衡常数
时,反应Ⅱ的平衡常数
__________ [对于气相反应,用某组分 的平衡压强
的平衡压强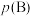 代替物质的量浓度
代替物质的量浓度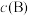 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如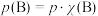 ,
, 为平衡总压强,
为平衡总压强,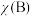 为平衡系统中
为平衡系统中 的物质的量分数]。
的物质的量分数]。
(3)可用 与
与 催化加氢制乙醇,反应原理为:
催化加氢制乙醇,反应原理为: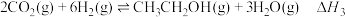 。经实验测定在不同投料比
。经实验测定在不同投料比 、
、 、
、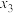 时
时 的平衡转化率与温度的关系如图所示
的平衡转化率与温度的关系如图所示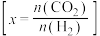 :
:

①上述反应的活化能 (正)
(正)__________  (逆)(填“
(逆)(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
② 、
、 、
、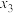 由大到小的顺序是
由大到小的顺序是__________ 。
③从平衡角度分析,随温度升高,不同投料比时 的平衡转化率趋于相近的原因
的平衡转化率趋于相近的原因__________ 。
(4)科学家提出由 制取
制取 的太阳能工艺如图。已知“重整系统”发生的反应中
的太阳能工艺如图。已知“重整系统”发生的反应中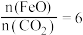 ,则
,则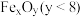 的化学式为
的化学式为__________ 。

(5)水系可逆 电池可吸收利用
电池可吸收利用 ,将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的
,将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的 解离成
解离成 和
和 ,工作原理如图所示:
,工作原理如图所示:

①放电时复合膜中向 极移动的离子是
极移动的离子是__________ 。
②充电时多孔 纳米片电极的电极反应式为
纳米片电极的电极反应式为__________ 。
 的利用技术成为热点。
的利用技术成为热点。反应I:

反应Ⅱ:

请回答:
(1)反应I能够自发进行的条件是
(2)向
 的恒容密闭容器中充入
的恒容密闭容器中充入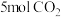 和
和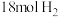 (起始压强为
(起始压强为 ),在不同温度下同时发生上述反应I和反应Ⅱ,得到平衡时各含碳物质的物质的量
),在不同温度下同时发生上述反应I和反应Ⅱ,得到平衡时各含碳物质的物质的量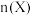 与温度
与温度 的关系如下图所示。
的关系如下图所示。
①写出曲线Y表示的含碳元素物质的化学式
②
 时,反应Ⅱ的平衡常数
时,反应Ⅱ的平衡常数
 的平衡压强
的平衡压强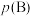 代替物质的量浓度
代替物质的量浓度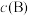 也可表示平衡常数,记作
也可表示平衡常数,记作 ,如
,如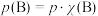 ,
, 为平衡总压强,
为平衡总压强,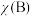 为平衡系统中
为平衡系统中 的物质的量分数]。
的物质的量分数]。(3)可用
 与
与 催化加氢制乙醇,反应原理为:
催化加氢制乙醇,反应原理为: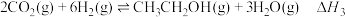 。经实验测定在不同投料比
。经实验测定在不同投料比 、
、 、
、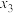 时
时 的平衡转化率与温度的关系如图所示
的平衡转化率与温度的关系如图所示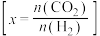 :
:
①上述反应的活化能
 (正)
(正) (逆)(填“
(逆)(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。②
 、
、 、
、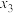 由大到小的顺序是
由大到小的顺序是③从平衡角度分析,随温度升高,不同投料比时
 的平衡转化率趋于相近的原因
的平衡转化率趋于相近的原因(4)科学家提出由
 制取
制取 的太阳能工艺如图。已知“重整系统”发生的反应中
的太阳能工艺如图。已知“重整系统”发生的反应中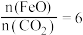 ,则
,则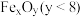 的化学式为
的化学式为
(5)水系可逆
 电池可吸收利用
电池可吸收利用 ,将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的
,将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的 解离成
解离成 和
和 ,工作原理如图所示:
,工作原理如图所示:
①放电时复合膜中向
 极移动的离子是
极移动的离子是②充电时多孔
 纳米片电极的电极反应式为
纳米片电极的电极反应式为
您最近半年使用:0次
3 . 半湿法处理铜阳极泥回收贵金属银、铂、金的工艺如下图:
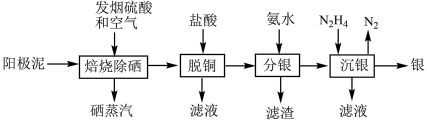
已知:①“焙烧除硒”过程中硒、铜和银转化为相应的氧化物;②“分银”工艺中银转化为[Ag(NH3)2]+。
回答下列问题:
(1)CuAgSe中铜的化合价为___________ ;Cu的价层电子轨道表达式为___________ ,位于周期表___________ 区。
(2)“脱铜”工艺中,与银元素相关的离子反应方程式为___________ 。
(3)“分银”得到滤渣的主要成分有Pt和___________ 。
(4)“沉银”过程中肼(N2H4)的作用是___________ 。
(5)经上述工艺得到的粗银还需进行电解精炼:纯银作阴极,电解液为硝酸和硝酸银的混合溶液。硝酸浓度不能过大,可能的原因是___________ (用化学语言解释)。
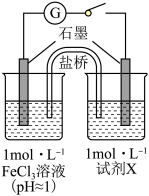
(6)某研究性学习小组为探究Ag与Fe3+的反应,按图装置进行实验(盐桥中的物质不参与反应)。
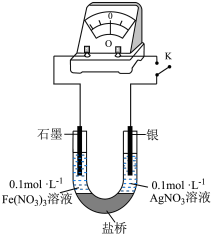
①K闭合时,电流表指针偏转,石墨作___________ (填“正极”或“负极”)。
②当指针归零后,向U形管左侧滴加几滴Fe(NO3)2浓溶液,发现指针向反方向偏转,写出此时银电极的反应式:___________ 。
③结合上述实验分析,写出Fe3+和Ag反应的离子方程式:___________ 。

已知:①“焙烧除硒”过程中硒、铜和银转化为相应的氧化物;②“分银”工艺中银转化为[Ag(NH3)2]+。
回答下列问题:
(1)CuAgSe中铜的化合价为
(2)“脱铜”工艺中,与银元素相关的离子反应方程式为
(3)“分银”得到滤渣的主要成分有Pt和
(4)“沉银”过程中肼(N2H4)的作用是
(5)经上述工艺得到的粗银还需进行电解精炼:纯银作阴极,电解液为硝酸和硝酸银的混合溶液。硝酸浓度不能过大,可能的原因是
(6)某研究性学习小组为探究Ag与Fe3+的反应,按图装置进行实验(盐桥中的物质不参与反应)。

①K闭合时,电流表指针偏转,石墨作
②当指针归零后,向U形管左侧滴加几滴Fe(NO3)2浓溶液,发现指针向反方向偏转,写出此时银电极的反应式:
③结合上述实验分析,写出Fe3+和Ag反应的离子方程式:
您最近半年使用:0次
2023高三·全国·专题练习
4 . 高铁电池作为新型可充电电池,具有放电曲线平坦,高能高容量,原料丰富,绿色无污染等优点。如图为简易的高铁电池的工作装置。已知:放电后,两极都产生红褐色悬浮物。
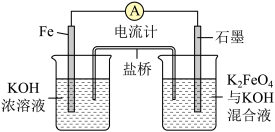
请回答下列问题:
(1)该电池放电时的总反应为___________ 。
(2)该电池充电时阳极反应的电极反应方程式为___________ 。
(3)放电时,此盐桥中阴离子的运动方向是___________ (填“从左向右”或“从右向左”)。

请回答下列问题:
(1)该电池放电时的总反应为
(2)该电池充电时阳极反应的电极反应方程式为
(3)放电时,此盐桥中阴离子的运动方向是
您最近半年使用:0次
名校
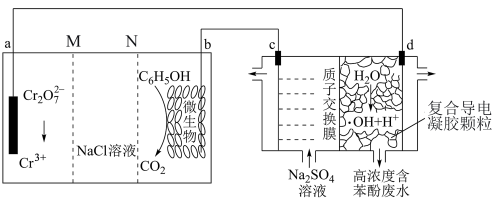
5 . 我国科学家设计了一种能将苯酚氧化为 和
和 的原电池—电解池组合装置,实现了发电、环保两位一体(如图所示)。已知羟基自由基(
的原电池—电解池组合装置,实现了发电、环保两位一体(如图所示)。已知羟基自由基( )具有强氧化性,能氧化苯酚。左侧装置为原电池。下列说法错误的是
)具有强氧化性,能氧化苯酚。左侧装置为原电池。下列说法错误的是
 和
和 的原电池—电解池组合装置,实现了发电、环保两位一体(如图所示)。已知羟基自由基(
的原电池—电解池组合装置,实现了发电、环保两位一体(如图所示)。已知羟基自由基( )具有强氧化性,能氧化苯酚。左侧装置为原电池。下列说法错误的是
)具有强氧化性,能氧化苯酚。左侧装置为原电池。下列说法错误的是
| A.电池工作时,b极附近pH增大 |
| B.电极电势的高低:a>b |
C.d极区苯酚被氧化的化学方程式为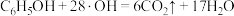 |
| D.右侧装置中,c、d两极产生气体的体积比(相同条件下)为7∶3 |
您最近半年使用:0次
名校
解题方法
6 . 某实验小组对 分别与
分别与 、
、 的反应进行探究。
的反应进行探究。
【甲同学的实验】
(1)甲同学探究实验Ⅰ的电极产物。
①取少量 溶液电极附近的混合液,加入
溶液电极附近的混合液,加入___________ ,产生白色沉淀,证明产生了 。
。
②该同学又设计实验探究另一电极的产物,所需检验试剂及现象分别是___________ 、___________ 。
(2)实验Ⅰ中负极的电极反应式为___________ 。
【乙同学的实验】
乙同学进一步探究 溶液与
溶液与 溶液能否发生反应,设计、完成实验并记录如下:
溶液能否发生反应,设计、完成实验并记录如下:
(3)查阅资料:溶液中 、
、 、
、 三种微粒会形成红色配合物并存在如下转化:
三种微粒会形成红色配合物并存在如下转化:

从反应速率和化学平衡两个角度解释1~30min的实验现象:___________ 。
(4)解释30min后上层溶液又变为浅红色的可能原因:___________ 。
【实验反思】
(5)分别对比Ⅰ和Ⅱ、Ⅱ和Ⅲ, 能否与
能否与 或
或 发生氧化还原反应和
发生氧化还原反应和___________ 有关(写出两条)。
 分别与
分别与 、
、 的反应进行探究。
的反应进行探究。【甲同学的实验】
| 装置 | 编号 | 试剂X | 实验现象 |
 | Ⅰ |  溶液( 溶液(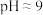 ) ) | 闭合开关后灵敏电流计指针发生偏转 |
| Ⅱ |  溶液( 溶液( ) ) | 闭合开关后灵敏电流计指针未发生偏转 |
①取少量
 溶液电极附近的混合液,加入
溶液电极附近的混合液,加入 。
。②该同学又设计实验探究另一电极的产物,所需检验试剂及现象分别是
(2)实验Ⅰ中负极的电极反应式为
【乙同学的实验】
乙同学进一步探究
 溶液与
溶液与 溶液能否发生反应,设计、完成实验并记录如下:
溶液能否发生反应,设计、完成实验并记录如下:| 装置 | 编号 | 反应时间 | 实验现象 |
 | Ⅲ | 0~1min | 产生红色沉淀,有刺激性气味气体逸出 |
| 1~30min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | ||
| 30min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
 、
、 、
、 三种微粒会形成红色配合物并存在如下转化:
三种微粒会形成红色配合物并存在如下转化:
从反应速率和化学平衡两个角度解释1~30min的实验现象:
(4)解释30min后上层溶液又变为浅红色的可能原因:
【实验反思】
(5)分别对比Ⅰ和Ⅱ、Ⅱ和Ⅲ,
 能否与
能否与 或
或 发生氧化还原反应和
发生氧化还原反应和
您最近半年使用:0次
名校
解题方法
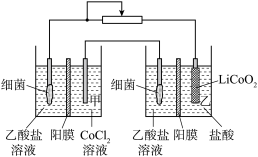
7 . 设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成 ,将废旧锂离子电池的正极材料
,将废旧锂离子电池的正极材料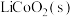 转化为
转化为 ,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法
,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法不正确 的是
 ,将废旧锂离子电池的正极材料
,将废旧锂离子电池的正极材料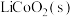 转化为
转化为 ,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法
,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法
| A.装置工作时,甲室溶液pH最终升高 |
| B.装置工作一段时间后,乙室应补充盐酸 |
C.乙室电极反应式为 |
D.若甲室 减少 减少 ,乙室 ,乙室 增加 增加 ,则此时已进行过溶液转移 ,则此时已进行过溶液转移 |
您最近半年使用:0次
8 . 全钒液流储能电池是一种新型的绿色环保储能系统(工作原理如下图,电解液含硫酸)。
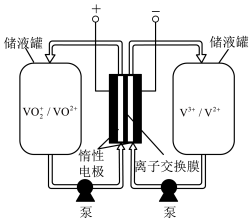
下列说法不正确 的是
| 离子种类 |  |  | 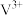 |  |
| 颜色 | 黄色 | 蓝色 | 绿色 | 紫色 |

下列说法
A.该电池总反应的离子方程式是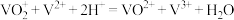 |
| B.当完成储能时,正极溶液的颜色是黄色 |
C.电池工作时, 透过离子交换膜向负极区移动 透过离子交换膜向负极区移动 |
| D.该电池能提供稳定的输出功率,原因是电解液循环,保持各离子浓度稳定 |
您最近半年使用:0次
9 . 电化学在化工、冶金、机械、电子、航空、航天、轻工、仪表、医学、材料、能源、金属腐蚀与防护、环境科学等科技领域获得了广泛的应用。
Ⅰ.电解精炼镓的装置如图所示,粗镓含 、
、 、
、 杂质,已知镓(
杂质,已知镓( )的化学性质与铝(
)的化学性质与铝( )相似,金属活动性顺序为
)相似,金属活动性顺序为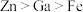 ,镓(
,镓( )的熔点为29.8℃。
)的熔点为29.8℃。
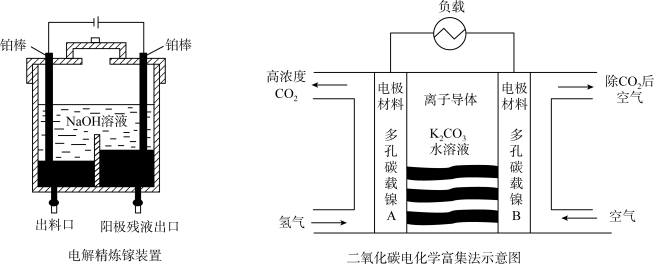
(1)电解后,电解槽底部阳极泥中所含的金属有_____ 。
(2)电解过程中阴极的电极反应式是_____ 。
Ⅱ.载人航天器中的物质和能源资源十分宝贵,二氧化碳的富集与转化是氧气再生的核心问题,电化学富集二氧化碳的方法如图所示。回答下列问题:
(3)离子导体中, 向多孔碳载镍
向多孔碳载镍_____ (填“A”或“B”)电极移动。
(4)负极的电极反应式是_____ 。
(5)在多孔碳载镍A电极上消耗1
 ,理论上多孔碳载镍B电极转化的
,理论上多孔碳载镍B电极转化的 在标准状况下的体积是
在标准状况下的体积是_____ L。
Ⅲ.日常生活中使用的金属往往含有杂质,当这样的金属与潮湿的空气或者电解质溶液接触时,会在其表面的杂志附近形成许多微小的原电池而被腐蚀。钢铁吸氧腐蚀的原理如图所示。
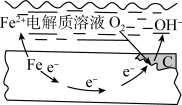
(6)钢铁吸氧腐蚀的正极反应式是_____ 。
(7)下列关于金属腐蚀的防护说法正确的是_____ 。
①用电镀的方法,在钢铁制品表面镀上一层不易被腐蚀的金属,能够减缓金属的腐蚀。
②镀铜铁制品镀层受损后,铁制品比受损前更易生锈。
③改变金属内部组成、结构可以防止金属腐蚀。
④牺牲阳极保护法是将被保护的金属作正极,以一种活动性较强的金属作负极。
⑤外加电流阴极保护法是将被保护的金属作阴极,惰性电极作辅助阳极,连接直流电源。
Ⅰ.电解精炼镓的装置如图所示,粗镓含
 、
、 、
、 杂质,已知镓(
杂质,已知镓( )的化学性质与铝(
)的化学性质与铝( )相似,金属活动性顺序为
)相似,金属活动性顺序为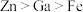 ,镓(
,镓( )的熔点为29.8℃。
)的熔点为29.8℃。
(1)电解后,电解槽底部阳极泥中所含的金属有
(2)电解过程中阴极的电极反应式是
Ⅱ.载人航天器中的物质和能源资源十分宝贵,二氧化碳的富集与转化是氧气再生的核心问题,电化学富集二氧化碳的方法如图所示。回答下列问题:
(3)离子导体中,
 向多孔碳载镍
向多孔碳载镍(4)负极的电极反应式是
(5)在多孔碳载镍A电极上消耗1

 ,理论上多孔碳载镍B电极转化的
,理论上多孔碳载镍B电极转化的 在标准状况下的体积是
在标准状况下的体积是Ⅲ.日常生活中使用的金属往往含有杂质,当这样的金属与潮湿的空气或者电解质溶液接触时,会在其表面的杂志附近形成许多微小的原电池而被腐蚀。钢铁吸氧腐蚀的原理如图所示。

(6)钢铁吸氧腐蚀的正极反应式是
(7)下列关于金属腐蚀的防护说法正确的是
①用电镀的方法,在钢铁制品表面镀上一层不易被腐蚀的金属,能够减缓金属的腐蚀。
②镀铜铁制品镀层受损后,铁制品比受损前更易生锈。
③改变金属内部组成、结构可以防止金属腐蚀。
④牺牲阳极保护法是将被保护的金属作正极,以一种活动性较强的金属作负极。
⑤外加电流阴极保护法是将被保护的金属作阴极,惰性电极作辅助阳极,连接直流电源。
您最近半年使用:0次
名校
解题方法
10 . 电化学是化学研究重要分支,在生产生活中发挥着非常重要的作用。请回答下列问题:
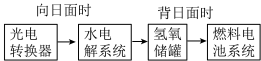
(1)某空间站局部能量转化系统如图所示,其中氢氧燃料电池采用KOH溶液为电解液,燃料电池放电时的负极反应式为___________ 。
(2)铅酸蓄电池是最常见的二次电池,电压稳定,安全可靠,价格低廉,应用广泛。电池总反应为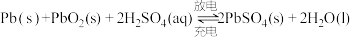 。
。
①放电时,正极的电极反应式:___________ ,
当外电路通过0.5 mole-时,理论上负极板的质量增加___________ g。
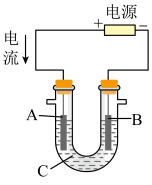
②用该蓄电池作电源,进行粗铜(含Ag、Pt、Au等杂质)的电解精炼。如下图所示,电解液c选用___________ 溶液,A电极的材料是___________ ,B电极反应式是___________ 。
(3)以CH3OH燃料电池为电源电解法制取ClO2,二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
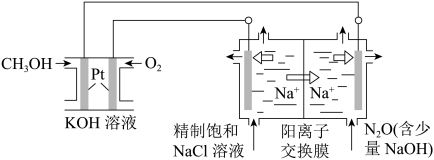
①CH3OH燃料电池放电过程中,负极反应式为___________ 。
②图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取ClO2,阳极产生ClO2的反应式为___________ 。
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多3.36 L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为___________ mol(精确到小数点后两位)。
(1)某空间站局部能量转化系统如图所示,其中氢氧燃料电池采用KOH溶液为电解液,燃料电池放电时的负极反应式为

(2)铅酸蓄电池是最常见的二次电池,电压稳定,安全可靠,价格低廉,应用广泛。电池总反应为
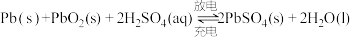 。
。①放电时,正极的电极反应式:
当外电路通过0.5 mole-时,理论上负极板的质量增加
②用该蓄电池作电源,进行粗铜(含Ag、Pt、Au等杂质)的电解精炼。如下图所示,电解液c选用

(3)以CH3OH燃料电池为电源电解法制取ClO2,二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。

①CH3OH燃料电池放电过程中,负极反应式为
②图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取ClO2,阳极产生ClO2的反应式为
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多3.36 L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为
您最近半年使用:0次



