1 . 二氧化碳是潜在的碳资源,无论是天然的二氧化碳气藏,还是各种炉气、尾气、副产气,进行分离回收和提浓,合理利用,意义重大。
(1)在空间站中常利用CO2(g)+2H2(g) C(s)+2H2O(g),再电解水实现O2的循环利用,350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生以上反应。
C(s)+2H2O(g),再电解水实现O2的循环利用,350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生以上反应。
①若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强(p)随时间(t)的变化如图中a所示,则上述反应的△H___________ 0(填“>”或“<”);其他条件相同时,若仅改变某一条件,测得其压强(p)随时间(t)的变化如图中曲线b所示,则改变的条件是___________ 。
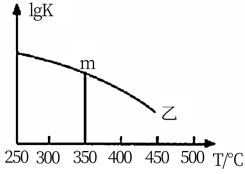
②图是反应平衡常数的对数与温度的变化关系图,m的值为___________ 。
(2)CO2在 Cu-ZnO催化下,同时发生如下反应I,II,是解决温室效应和能源短缺的重要手段。
Ⅰ.CO2(g)+3H2(g) CH3OH (g)+H2O(g) △H1<0
CH3OH (g)+H2O(g) △H1<0
Ⅱ.CO2(g)+H2(g) CO(g)+ H2O(g) △H2>0
CO(g)+ H2O(g) △H2>0
保持温度T时,在容积不变的密闭容器中,充入一定量的CO2及H2,起始及达平衡时,容器内各气体物质的量及总压强如下表:
若反应I、II均达平衡时,p0=1.4p,则表中n=__________ ;反应1的平衡常数Kp=____ (kPa)-2。(用含p的式子表示)
(3)Al-CO2电池是一种以低温熔融盐[Al2(CO3)3]为电解质,以完全非碳的钯Pd包覆纳米多孔金属为催化剂正极的可充电电池。正极反应为:3CO2+4e-=2CO32-+C,则生成Al的反应发生在___________ 极(填“阳”或“阴”),该电池充电时反应的化学方程式为___________ 。
(1)在空间站中常利用CO2(g)+2H2(g)
 C(s)+2H2O(g),再电解水实现O2的循环利用,350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生以上反应。
C(s)+2H2O(g),再电解水实现O2的循环利用,350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生以上反应。①若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强(p)随时间(t)的变化如图中a所示,则上述反应的△H

②图是反应平衡常数的对数与温度的变化关系图,m的值为
(2)CO2在 Cu-ZnO催化下,同时发生如下反应I,II,是解决温室效应和能源短缺的重要手段。
Ⅰ.CO2(g)+3H2(g)
 CH3OH (g)+H2O(g) △H1<0
CH3OH (g)+H2O(g) △H1<0Ⅱ.CO2(g)+H2(g)
 CO(g)+ H2O(g) △H2>0
CO(g)+ H2O(g) △H2>0保持温度T时,在容积不变的密闭容器中,充入一定量的CO2及H2,起始及达平衡时,容器内各气体物质的量及总压强如下表:
| CO2 | H2 | CH3OH(g) | CO | H2O(g) | 总压强/kPa | |
| 起始/mol | 0.5 | 0.9 | 0 | 0 | 0 | p0 |
| 平衡/mol | n | 0.3 | p |
若反应I、II均达平衡时,p0=1.4p,则表中n=
(3)Al-CO2电池是一种以低温熔融盐[Al2(CO3)3]为电解质,以完全非碳的钯Pd包覆纳米多孔金属为催化剂正极的可充电电池。正极反应为:3CO2+4e-=2CO32-+C,则生成Al的反应发生在
您最近半年使用:0次
2019-03-14更新
|
552次组卷
|
3卷引用:【市级联考】山东省日照市2019届高三下学期3月模拟理科综合化学试题
名校
解题方法
2 . 天宫二号空间实验室已于2016 年9月15日22时04分在酒泉卫星发射中心发射成功。请回答下列问题:

(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英玻璃的成分是______ (填化学式)
(2)“碳纤维复合材料制品”应用于“天宫二号”的推进系统。碳纤维复合材料具有重量轻、可设计强度高的特点。碳纤维复合材料由碳纤维和合成树脂组成,其中合成树脂是高分子化合物,则制备合成树脂的反应类型是_____________ 。
(3)太阳能电池帆板是“天宫二号”空间运行的动力源泉,其性能直接影响到“天宫二号”的运行寿命和可靠性。
① 天宫二号使用的光伏太阳能电池,该电池的核心材料是_____ ,其能量转化方式为_____ 。
② 下图是一种全天候太阳能电池的工作原理:
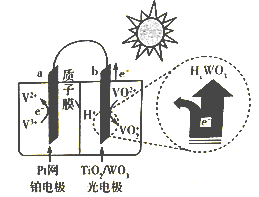
太阳照射时的总反应为V3++ VO2++ H2O=V2++VO2++2H+,则负极反应式为__________ ;夜间时,电池正极为______ (填“a”或“b”)。
(4)太阳能、风能发电逐渐得到广泛应用,下列说法中,正确的是______ ( 填字母序号)。
a.太阳能、风能都是清洁能源
b.太阳能电池组实现了太阳能到电能的转化
c.控制系统能够控制储能系统是充电还是放电
d.阳光或风力充足时,储能系统实现由化学能到电能的转化
(5)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含有Al3+,Fe3+等)进行综合处理可实现钒资源的回收利用,流程如下:
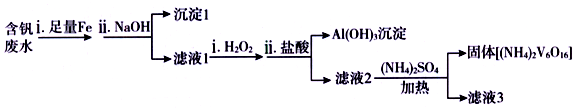
已知溶液pH 范围不同时,钒的存在形式如下表所示:
①加入NaOH 调节溶液pH至13时,沉淀1达最大量,并由灰白色转变为红褐色,用化学用语表示加入NaOH 后生成沉淀1的反应过程为_______ 、_______ ;所得滤液1中,铝元素的存在形式为__________ 。
②向碱性的滤液1 ( V的化合价为+4 )中加入H2O2的作用是________ (用离子方程式表示)。

(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英玻璃的成分是
(2)“碳纤维复合材料制品”应用于“天宫二号”的推进系统。碳纤维复合材料具有重量轻、可设计强度高的特点。碳纤维复合材料由碳纤维和合成树脂组成,其中合成树脂是高分子化合物,则制备合成树脂的反应类型是
(3)太阳能电池帆板是“天宫二号”空间运行的动力源泉,其性能直接影响到“天宫二号”的运行寿命和可靠性。
① 天宫二号使用的光伏太阳能电池,该电池的核心材料是
② 下图是一种全天候太阳能电池的工作原理:

太阳照射时的总反应为V3++ VO2++ H2O=V2++VO2++2H+,则负极反应式为
(4)太阳能、风能发电逐渐得到广泛应用,下列说法中,正确的是
a.太阳能、风能都是清洁能源
b.太阳能电池组实现了太阳能到电能的转化
c.控制系统能够控制储能系统是充电还是放电
d.阳光或风力充足时,储能系统实现由化学能到电能的转化
(5)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含有Al3+,Fe3+等)进行综合处理可实现钒资源的回收利用,流程如下:

已知溶液pH 范围不同时,钒的存在形式如下表所示:
| 钒的化合价 | pH<2 | pH>11 |
| +4价 | VO2+,VO(OH)+ | VO(OH)3- |
| +5价 | VO2+ | VO43- |
①加入NaOH 调节溶液pH至13时,沉淀1达最大量,并由灰白色转变为红褐色,用化学用语表示加入NaOH 后生成沉淀1的反应过程为
②向碱性的滤液1 ( V的化合价为+4 )中加入H2O2的作用是
您最近半年使用:0次
名校
解题方法
3 . 如图是一个电化学过程的示意图.请回答下列问题:
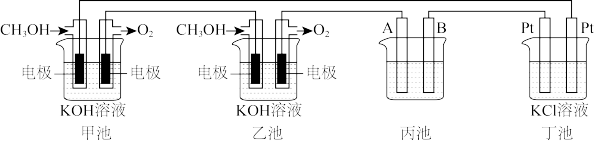
(1)通入CH3OH的电极的电极反应式为_______ .
(2)丙池是铜的精炼池,电解一段时间后烧杯中的溶液浓度会_______ (填“增大、减小、不变”),A电极反应式_______ (已知粗铜中含有Zn,Ag杂质).
(3)丁池中滴有酚酞,实验开始后观察到的现象_______ ,丁池采用无隔膜电解,产生的氯气可能会与KOH溶液接触仅得到KClO和H2,则相应的化学反应方程式为_______ 。
(4)若甲、乙两个电池氧气通入量均为20L(标准状况),且反应完全,则理论上通过丁池的电量为_______ (法拉第常数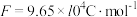 ),丁池最多能产生气体的总体积为
),丁池最多能产生气体的总体积为_______ L(标准状况)。

(1)通入CH3OH的电极的电极反应式为
(2)丙池是铜的精炼池,电解一段时间后烧杯中的溶液浓度会
(3)丁池中滴有酚酞,实验开始后观察到的现象
(4)若甲、乙两个电池氧气通入量均为20L(标准状况),且反应完全,则理论上通过丁池的电量为
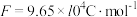 ),丁池最多能产生气体的总体积为
),丁池最多能产生气体的总体积为
您最近半年使用:0次
解题方法
4 . 回答下列问题
(1)目前已开发出用电解法制取ClO2的新工艺。
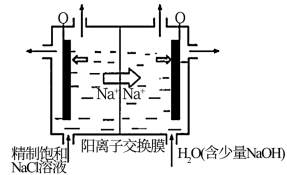
① 图中用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为_______ 。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_______ mol。
(2)某研究性学习小组根据反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4 + 8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为 1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。
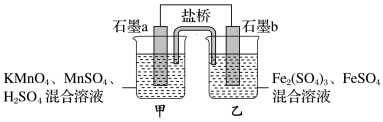
回答下列问题:
③ 此原电池的正极是石墨_______ (填“a”或“b”)。
④电池工作时,盐桥中的SO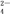 移向
移向_______ (填“甲”或“乙”)烧杯。
⑤ 甲烧杯中的电极反应式为_______ 。
⑥ 若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为_______ mol。
(1)目前已开发出用电解法制取ClO2的新工艺。

① 图中用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为
(2)某研究性学习小组根据反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4 + 8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为 1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。

回答下列问题:
③ 此原电池的正极是石墨
④电池工作时,盐桥中的SO
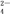 移向
移向⑤ 甲烧杯中的电极反应式为
⑥ 若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为
您最近半年使用:0次
名校
解题方法
5 . 铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
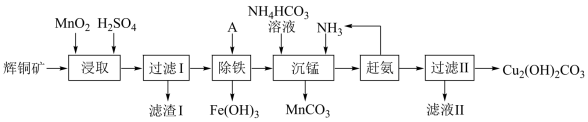
①浸取反应中氧化剂的化学式为_______ ;滤渣Ⅰ的成分为MnO2和_______ (写化学式)。
②“除铁”这一步反应在25℃进行,加入的试剂A为__________ ,若加A后溶液的PH调为4,溶液中Fe3+离子浓度为___________ mol/L。(已知Ksp[Fe(OH)3]=4.0×10-38)
③“沉锰”(除Mn2+)过程中反应的离子方程式______________________ 。
④ 滤液Ⅱ经蒸发结晶得到的盐主要是_________________________ (写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①下图1为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前电极质量相等,一段时间后,两电极质量相差25.8g,则导线中通过了_______ mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则乙池电解质溶液的质量与实验前的电解质溶液的质量差△m=________ g。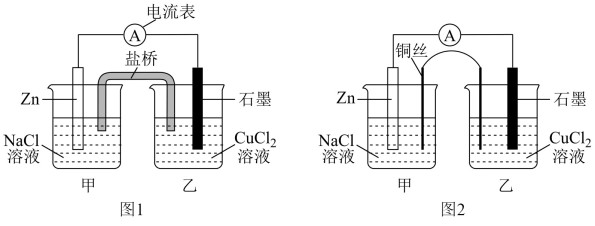
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如图2所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH___ (填“减小”、“增大”或“不变”) ,乙池中石墨为_____ 极(填“正”、“负”、“阴”或“阳”) 。
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:

①浸取反应中氧化剂的化学式为
②“除铁”这一步反应在25℃进行,加入的试剂A为
③“沉锰”(除Mn2+)过程中反应的离子方程式
④ 滤液Ⅱ经蒸发结晶得到的盐主要是
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①下图1为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前电极质量相等,一段时间后,两电极质量相差25.8g,则导线中通过了

②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如图2所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH
您最近半年使用:0次
2016-12-09更新
|
280次组卷
|
2卷引用:2016届江西南昌二中、临川一中等高三4月联考二理综化学试卷
2011·广东广州·模拟预测
6 . 碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l);△H1= —1214kJ/mol
②2CO(g)+O2(g)=2CO2(g);△H2= —566kJ/mol
则反应CH4(g)+2O2(g)=CO2(g)+2H2O(l)的△H= 。
(2)①将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其正极电极反应式是: 。
②某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
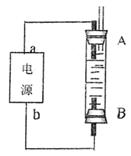
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-→H2↑
③若将所得Fe(OH)2沉淀暴露在空气中,反应的化学方程式为 。
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
①实验1中,以v(H2)表示的平均反应速率为 。
②该反应的正反应为 (填“吸”或“放”)热反应。
(4)将2.4g碳(碳的相对原子质量为12)在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中的溶质的化学式是 ;溶液中所含离子的物质的量浓度由大到小的顺序为: 。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l);△H1= —1214kJ/mol
②2CO(g)+O2(g)=2CO2(g);△H2= —566kJ/mol
则反应CH4(g)+2O2(g)=CO2(g)+2H2O(l)的△H= 。
(2)①将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其正极电极反应式是: 。
②某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)

A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-→H2↑
③若将所得Fe(OH)2沉淀暴露在空气中,反应的化学方程式为 。
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | a | b | c | 1 |
①实验1中,以v(H2)表示的平均反应速率为 。
②该反应的正反应为 (填“吸”或“放”)热反应。
(4)将2.4g碳(碳的相对原子质量为12)在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中的溶质的化学式是 ;溶液中所含离子的物质的量浓度由大到小的顺序为: 。
您最近半年使用:0次



