名校
解题方法
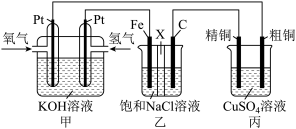
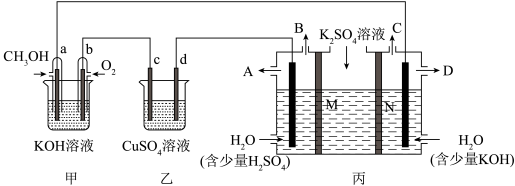
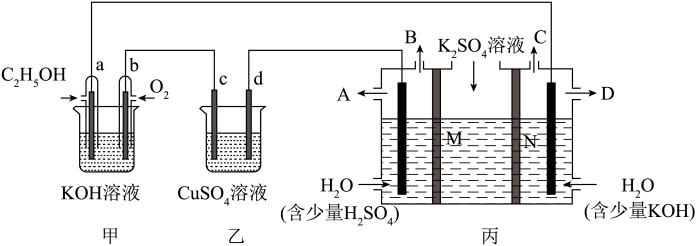
1 . 某同学设计了如图所示装置,可探究氯碱工业原理和粗铜的精炼原理。
(1)甲装置中负极的电极反应式为___________ 。
(2)乙装置中Fe电极名称及为电极反应式为___________ 。
(3)乙中的X把电解槽隔成了阴极室和阳极室,X为___________ (填“阴”或“阳”)离子交换膜,它只允许溶液中的___________ 通过(填写下列微粒的编号),而两边的水不能自由流通。
① ,②
,② ,③
,③ ,④
,④ ,⑤
,⑤ ,⑥
,⑥ 。
。
(4)若在标准状况下,有2.24L氧气参加反应,丙装置中阴极析出铜的质量为___________ g。
(1)甲装置中负极的电极反应式为
(2)乙装置中Fe电极名称及为电极反应式为
(3)乙中的X把电解槽隔成了阴极室和阳极室,X为
①
 ,②
,② ,③
,③ ,④
,④ ,⑤
,⑤ ,⑥
,⑥ 。
。(4)若在标准状况下,有2.24L氧气参加反应,丙装置中阴极析出铜的质量为
您最近一年使用:0次
名校
解题方法
2 . 工业废水中常含有一定量的 和
和 ,它们会对人类及生态系统产生很大的危害,必须进行处理。某工厂使用还原沉淀法处理,该法的工艺流程为:
,它们会对人类及生态系统产生很大的危害,必须进行处理。某工厂使用还原沉淀法处理,该法的工艺流程为:



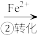 Cr3+
Cr3+ Cr(OH)3
Cr(OH)3
其中第①步存在平衡:2 (黄色)+2H+
(黄色)+2H+ 
 (橙色)+H2O
(橙色)+H2O
(1)若平衡体系显比较强的酸性,此时溶液显______ 色。
(2)能说明第①步反应达平衡状态的是________ 。
a.溶液的pH不变 b. 和
和 的浓度相同
的浓度相同
c.2υ( )= υ(
)= υ( ) d.溶液的颜色不变
) d.溶液的颜色不变
(3)第②步反应的离子方程式为_______ 。
(4)Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)
 Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=6.4×10-31,要使c(Cr3+)降至10-5 mol·L-1时,溶液的pH应调至
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=6.4×10-31,要使c(Cr3+)降至10-5 mol·L-1时,溶液的pH应调至______ 。(已知:lg2=0.3)
(5)室温下,初始浓度为1.0mol•L-1的Na2CrO4溶液中c( )随c(H+)的变化如图所示:
)随c(H+)的变化如图所示:
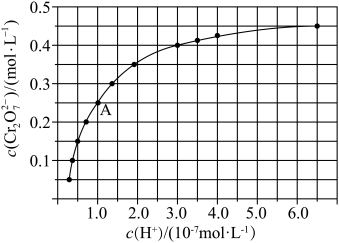
由图可知,溶液酸性增大, 的平衡转化率
的平衡转化率______ (填“增大“减小”或“不变”)。根据A点数据,计算出此时 的平衡转化率为
的平衡转化率为________ 。
(6)有人提出用Fe做电极电解处理含 的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示:
的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示:
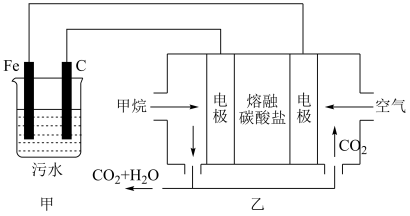
甲中碳电极上发生的反应式为________ ,该燃料电池正极的电极反应式为_______ , 燃料电池中若有2.4gCH4参加反应,则甲中碳电极理论上生成的气体在标准状况下体积为______ 。
 和
和 ,它们会对人类及生态系统产生很大的危害,必须进行处理。某工厂使用还原沉淀法处理,该法的工艺流程为:
,它们会对人类及生态系统产生很大的危害,必须进行处理。某工厂使用还原沉淀法处理,该法的工艺流程为:


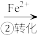 Cr3+
Cr3+ Cr(OH)3
Cr(OH)3其中第①步存在平衡:2
 (黄色)+2H+
(黄色)+2H+ 
 (橙色)+H2O
(橙色)+H2O(1)若平衡体系显比较强的酸性,此时溶液显
(2)能说明第①步反应达平衡状态的是
a.溶液的pH不变 b.
 和
和 的浓度相同
的浓度相同c.2υ(
 )= υ(
)= υ( ) d.溶液的颜色不变
) d.溶液的颜色不变(3)第②步反应的离子方程式为
(4)Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)

 Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=6.4×10-31,要使c(Cr3+)降至10-5 mol·L-1时,溶液的pH应调至
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=6.4×10-31,要使c(Cr3+)降至10-5 mol·L-1时,溶液的pH应调至(5)室温下,初始浓度为1.0mol•L-1的Na2CrO4溶液中c(
 )随c(H+)的变化如图所示:
)随c(H+)的变化如图所示:
由图可知,溶液酸性增大,
 的平衡转化率
的平衡转化率 的平衡转化率为
的平衡转化率为(6)有人提出用Fe做电极电解处理含
 的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示:
的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示:
甲中碳电极上发生的反应式为
您最近一年使用:0次
解题方法
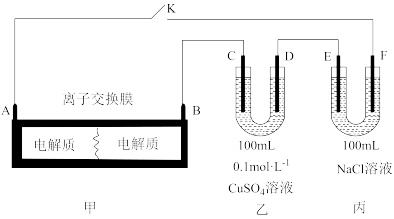
3 . 应用电化学原理,回答下列问题:
(1)图1中电流计指针偏移时,盐桥(含琼脂的饱和 溶液)中
溶液)中_____________ (填离子符号)移向硫酸锌溶液。
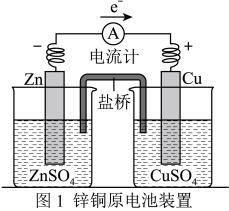
(2)若图2为电解精炼银的示意图(粗银中含有 加杂质),则
加杂质),则_____________ (填“a”或“b”)极为粗银。电解一段时间后,电解液中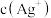 浓度将
浓度将_____________ (填“变大”“变小”或“不变”)。若图2为在铁件上电镀银的示意图,铁件应是_____________ (填“a”或“b”)极。
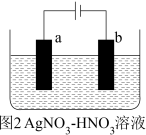
(3)现有如下图所示装置,所有电极均为 ,请按要求回答下列问题:
,请按要求回答下列问题:
①甲装置是_____________ (填“原电池”或“电解池”),乙池c极的电极反应为_______________________ 。
②通电 后,电路中通过
后,电路中通过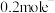 ,乙中共收集
,乙中共收集 气体(标准状况),溶液体积为
气体(标准状况),溶液体积为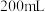 ,则通电前
,则通电前 溶液的物质的量浓度为
溶液的物质的量浓度为______________________ (设电解前后溶液体积无变化),若加入一种物质即可使乙装置溶液恢复到电解前的状态,则加入的物质及其物质的量为____________________________ 。
③现用丙装置电解硫酸钾溶液制取氢气、氧气、硫酸和氢氧化钾,其中M、N为离子交换膜,只允许某些离子通过,则N为_____________ (填“阴”或“阳”)离子交换膜。
(1)图1中电流计指针偏移时,盐桥(含琼脂的饱和
 溶液)中
溶液)中
(2)若图2为电解精炼银的示意图(粗银中含有
 加杂质),则
加杂质),则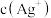 浓度将
浓度将
(3)现有如下图所示装置,所有电极均为
 ,请按要求回答下列问题:
,请按要求回答下列问题:
①甲装置是
②通电
 后,电路中通过
后,电路中通过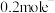 ,乙中共收集
,乙中共收集 气体(标准状况),溶液体积为
气体(标准状况),溶液体积为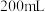 ,则通电前
,则通电前 溶液的物质的量浓度为
溶液的物质的量浓度为③现用丙装置电解硫酸钾溶液制取氢气、氧气、硫酸和氢氧化钾,其中M、N为离子交换膜,只允许某些离子通过,则N为
您最近一年使用:0次
名校
4 . 氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
(1)航天领域中常用肼
 作为火箭发射的助燃剂。
作为火箭发射的助燃剂。
①已知各共价键键能如下表:
 的结构为
的结构为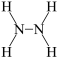 。
。
 ;
;
________  。
。
② 与氨气相似,是一种碱性气体,易溶于水,生成弱碱
与氨气相似,是一种碱性气体,易溶于水,生成弱碱 。用电离方程式表示
。用电离方程式表示 显碱性的原因
显碱性的原因___________ 。
(2)查阅资料可知,常温下,部分弱电解质的电离平衡常数如表:
① 的电离平衡常数的表达式
的电离平衡常数的表达式
___________ ;
②常温下,等浓度的下列溶液a. ;b.
;b. ;c.
;c. ,其
,其 由大到小的顺序是
由大到小的顺序是___________ (用字母表示)。
(3)某同学设计一个肼
 燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中
燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中
 为阳离子交换膜。
为阳离子交换膜。
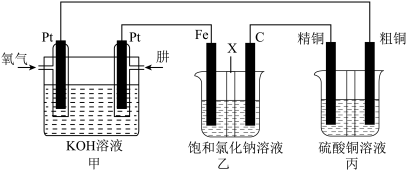
①通入肼的电极为___________ (填“正极”或“负极”),正极的电极反应式为___________ 。
②若甲中有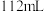 氧气(标准况下)参加反应,乙中通过离子交换膜的阳离子个数为
氧气(标准况下)参加反应,乙中通过离子交换膜的阳离子个数为___________ ,丙中硫酸铜溶液的浓度___________ (填“变大”、“变小”或“不变”)。
(1)航天领域中常用肼
 作为火箭发射的助燃剂。
作为火箭发射的助燃剂。①已知各共价键键能如下表:
 |  |  |  |  | |
键能 | 946 | 497 | 193 | 391 | 463 |
 的结构为
的结构为 。
。 ;
;
 。
。②
 与氨气相似,是一种碱性气体,易溶于水,生成弱碱
与氨气相似,是一种碱性气体,易溶于水,生成弱碱 。用电离方程式表示
。用电离方程式表示 显碱性的原因
显碱性的原因(2)查阅资料可知,常温下,部分弱电解质的电离平衡常数如表:
| 弱电解质 |  |  |  |
电离平衡常数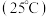 |  | 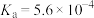 | 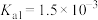 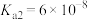 |
 的电离平衡常数的表达式
的电离平衡常数的表达式
②常温下,等浓度的下列溶液a.
 ;b.
;b. ;c.
;c. ,其
,其 由大到小的顺序是
由大到小的顺序是(3)某同学设计一个肼
 燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中
燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中 为阳离子交换膜。
为阳离子交换膜。
①通入肼的电极为
②若甲中有
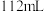 氧气(标准况下)参加反应,乙中通过离子交换膜的阳离子个数为
氧气(标准况下)参加反应,乙中通过离子交换膜的阳离子个数为
您最近一年使用:0次
2023·河北·模拟预测
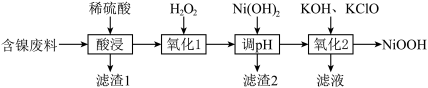
5 . NiOOH可用作碱性镍镉电池的电极材料,用含镍废料(主要成分是Ni,杂质有Al、Fe、SiO2)制取NiOOH的流程如图。
已知:i.镍、铁同族,但Ni2+的性质较稳定;
ii.常温下,该工艺条件下金属阳离子生成氢氧化物沉淀时的pH范围如表所示。
回答下列问题:
(1)“酸浸”前将废料粉碎的目的是___________ ,“滤渣2”的主要成分是___________ 。
(2)加入 的目的是
的目的是___________ ,实际生产中发现 的实际用量比理论用量多,原因是
的实际用量比理论用量多,原因是___________ 。
(3)“调pH”时pH的范围是___________ ,当溶液中离子浓度小于或等于 时认为该离子沉淀完全,则常温下
时认为该离子沉淀完全,则常温下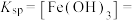
___________ ,“氧化2”中反应的离子方程式为___________ 。
(4)锌镍电池是一种可充电电池,其充电时总反应为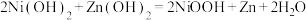 ,则放电时正极的电极反应式为
,则放电时正极的电极反应式为___________ ,充电时阴极周围溶液pH___________ (填“增大”“减小”或“不变”)。

已知:i.镍、铁同族,但Ni2+的性质较稳定;
ii.常温下,该工艺条件下金属阳离子生成氢氧化物沉淀时的pH范围如表所示。
| 沉淀物 |  |  |  |  |
| 开始沉淀时pH | 3.0 | 1.5 | 5.9 | 7.1 |
| 完全沉淀时pH | 4.7 | 3.2 | 9.0 | 9.2 |
(1)“酸浸”前将废料粉碎的目的是
(2)加入
 的目的是
的目的是 的实际用量比理论用量多,原因是
的实际用量比理论用量多,原因是(3)“调pH”时pH的范围是
 时认为该离子沉淀完全,则常温下
时认为该离子沉淀完全,则常温下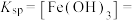
(4)锌镍电池是一种可充电电池,其充电时总反应为
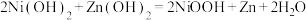 ,则放电时正极的电极反应式为
,则放电时正极的电极反应式为
您最近一年使用:0次
2023-04-21更新
|
366次组卷
|
3卷引用:黑龙江省大庆市大庆中学2023届高三下学期模拟预测理综化学试题
黑龙江省大庆市大庆中学2023届高三下学期模拟预测理综化学试题(已下线)2023年普通高中学业水平选择性考试化学押题卷(五)四川省南充高级中学2022-2023学年高二下学期第二次月考考试理综化学试题
名校
6 . Ⅰ.一定条件下,容积2L的密闭容器中,将2 L气体和3
L气体和3 M气体混合,发生如下反应:
M气体混合,发生如下反应: ,10s末,生成2.4
,10s末,生成2.4 R,测得Q的浓度为0.4
R,测得Q的浓度为0.4 。
。
(1)前10s内用M表示的化学反应速率为_______ 。
(2)化学方程式中x值为_______ 。
(3)10s末L的转化率是_______ 。
(4)下列说法可以说明该反应已达平衡的是_______ 。(填序号)
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④单位时间内消耗3 M的同时生成3
M的同时生成3 R
R
⑤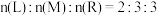
Ⅱ.乙醇燃料电池因其无污染,且原料来源广可再生被人们青睐。现有如下图所示装置,所有电极均为 ,请按要求回答下列问题:
,请按要求回答下列问题:
(5)写出甲装置a极的电极反应式_______ 。
(6)若乙池中 溶液足量,当b极消耗标准状况下
溶液足量,当b极消耗标准状况下 11.2
11.2 时,d电极增重
时,d电极增重_______ g。
(7)现用丙装置电解硫酸钾溶液制取氢气、氧气、硫酸和氢氧化钾,其中M、N为离子交换膜,只允许某些离子通过,则N为_______ 离子交换膜(填“阴”或“阳”),产生B气体的电极反应式为_______ 。
 L气体和3
L气体和3 M气体混合,发生如下反应:
M气体混合,发生如下反应: ,10s末,生成2.4
,10s末,生成2.4 R,测得Q的浓度为0.4
R,测得Q的浓度为0.4 。
。(1)前10s内用M表示的化学反应速率为
(2)化学方程式中x值为
(3)10s末L的转化率是
(4)下列说法可以说明该反应已达平衡的是
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④单位时间内消耗3
 M的同时生成3
M的同时生成3 R
R⑤
Ⅱ.乙醇燃料电池因其无污染,且原料来源广可再生被人们青睐。现有如下图所示装置,所有电极均为
 ,请按要求回答下列问题:
,请按要求回答下列问题:
(5)写出甲装置a极的电极反应式
(6)若乙池中
 溶液足量,当b极消耗标准状况下
溶液足量,当b极消耗标准状况下 11.2
11.2 时,d电极增重
时,d电极增重(7)现用丙装置电解硫酸钾溶液制取氢气、氧气、硫酸和氢氧化钾,其中M、N为离子交换膜,只允许某些离子通过,则N为
您最近一年使用:0次
名校
解题方法
7 .  转化是环保和资源利用的研究课题。将烧碱吸收
转化是环保和资源利用的研究课题。将烧碱吸收 后的溶液加入如图装置,可以回收单质硫,甲为二甲醚(
后的溶液加入如图装置,可以回收单质硫,甲为二甲醚( )-空气燃料电池。已知常温下,
)-空气燃料电池。已知常温下, 的电离常数
的电离常数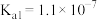 ,
,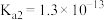 ;S可与NaOH溶液反应。回答下列问题:
;S可与NaOH溶液反应。回答下列问题: KHS溶液中,含硫微粒浓度由大到小顺序为
KHS溶液中,含硫微粒浓度由大到小顺序为_______ 。
(2)X极电极反应式____ 。
(3)电解一段时间后,甲池溶液pH_______ (填“增大”、“减小”或“不变”)。
(4)M交换膜为_______ 离子交换膜(填“阳”、“阴”或“质子”)。
(5)乙池总反应方程式为_______ 。
(6)当Y极消耗3.2g气体时,标准状况下W极生成气体的体积为_______ 。
 转化是环保和资源利用的研究课题。将烧碱吸收
转化是环保和资源利用的研究课题。将烧碱吸收 后的溶液加入如图装置,可以回收单质硫,甲为二甲醚(
后的溶液加入如图装置,可以回收单质硫,甲为二甲醚( )-空气燃料电池。已知常温下,
)-空气燃料电池。已知常温下, 的电离常数
的电离常数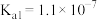 ,
,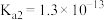 ;S可与NaOH溶液反应。回答下列问题:
;S可与NaOH溶液反应。回答下列问题: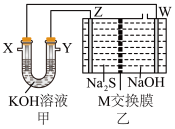
 KHS溶液中,含硫微粒浓度由大到小顺序为
KHS溶液中,含硫微粒浓度由大到小顺序为(2)X极电极反应式
(3)电解一段时间后,甲池溶液pH
(4)M交换膜为
(5)乙池总反应方程式为
(6)当Y极消耗3.2g气体时,标准状况下W极生成气体的体积为
您最近一年使用:0次
2022-11-23更新
|
192次组卷
|
2卷引用:黑龙江省哈尔滨市阿城区第一中学校2022-2023学年高二11月阶段性检测化学试题
解题方法
8 . 某兴趣小组设计以甲烷、氧气酸性燃料电池为电源电解 溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
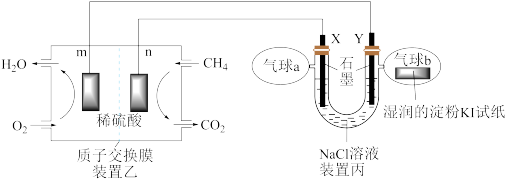
(1)m极为_______ 极,该电极发生的电极反应式为_______
(2)装置丙Y极电极反应式为_______ ;装置乙中n电极发生反应的电极反应式为:_______
(3)另一化学兴趣小组利用已知浓度的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。已知亚磷酸(H3PO3)具有较强的还原性,能被酸性高锰酸钾溶液氧化为磷酸。
①该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,选用0.1mol/L的酸性KMnO4标准溶液进行滴定,则滴定终点的现象为:_______ 。
②已知三次滴定数据如下表,该亚磷酸溶液的物质的量浓度为_______  。(保留小数点后两位)
。(保留小数点后两位)
③某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是_______ 。
A. 实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B. 如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C. 容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D. 酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大。
 溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
(1)m极为
(2)装置丙Y极电极反应式为
(3)另一化学兴趣小组利用已知浓度的酸性KMnO4标准溶液,测定某亚磷酸溶液的浓度。已知亚磷酸(H3PO3)具有较强的还原性,能被酸性高锰酸钾溶液氧化为磷酸。
①该小组用移液管准确量取25.00mL亚磷酸溶液于锥形瓶中,选用0.1mol/L的酸性KMnO4标准溶液进行滴定,则滴定终点的现象为:
②已知三次滴定数据如下表,该亚磷酸溶液的物质的量浓度为
 。(保留小数点后两位)
。(保留小数点后两位)| 试验编号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 22.00 |
| 2 | 0.50 | 22.50 |
| 3 | 0.50 | 25.50 |
A. 实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B. 如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C. 容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D. 酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大。
您最近一年使用:0次
解题方法
9 . 电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择___________ (填字母),
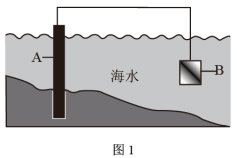
a.碳棒 b.锌板 c.铜板 d.铝镁合金
这种电化学防腐方法称为___________ 。
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
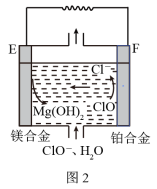
①E为该燃料电池的___________ 极,F电极上的电极反应式为___________ 。
②常温下,若用该燃料电池电解500mL饱和食盐水,当产生标准状况下1120mL气体时,溶液的pH为___________ 。(忽略电解前后溶液体积的变化)
③燃料电池应用前景广阔,主要优点有___________ (答出两点即可)。
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择

a.碳棒 b.锌板 c.铜板 d.铝镁合金
这种电化学防腐方法称为
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。

①E为该燃料电池的
②常温下,若用该燃料电池电解500mL饱和食盐水,当产生标准状况下1120mL气体时,溶液的pH为
③燃料电池应用前景广阔,主要优点有
您最近一年使用:0次
2022-01-01更新
|
190次组卷
|
2卷引用:黑龙江省齐齐哈尔市2021-2022学年高二上学期期末考试化学试题
名校
10 . 如图装置甲是某可充电电池的示意图,该电池放电的化学方程式为 ,图中的离子交换膜只允许
,图中的离子交换膜只允许 通过,
通过, 、
、 、
、 均为石墨电极,
均为石墨电极, 为铜电极。工作一段时间后,断开
为铜电极。工作一段时间后,断开 ,此时
,此时 、
、 两电极产生的气体体积相同,
两电极产生的气体体积相同, 电极质量减少
电极质量减少 
(1)装置甲的 电极为电池的
电极为电池的___________ 极,电解质的 向
向___________ (填“左侧”或“右侧”)迁移; 电极的电极反应式为
电极的电极反应式为___________ 。
(2)装置乙中 电极析出的气体体积为
电极析出的气体体积为___________ mL(标准状况)。
 ,图中的离子交换膜只允许
,图中的离子交换膜只允许 通过,
通过, 、
、 、
、 均为石墨电极,
均为石墨电极, 为铜电极。工作一段时间后,断开
为铜电极。工作一段时间后,断开 ,此时
,此时 、
、 两电极产生的气体体积相同,
两电极产生的气体体积相同, 电极质量减少
电极质量减少 

(1)装置甲的
 电极为电池的
电极为电池的 向
向 电极的电极反应式为
电极的电极反应式为(2)装置乙中
 电极析出的气体体积为
电极析出的气体体积为
您最近一年使用:0次



