1 . 能层
(1)含义:根据核外电子的_______ 不同,将核外电子分为不同的能层(电子层)。
(2)序号及符号:能层序号一、二、三、四、五、六、七……分别用K、L、M、N、O、P、Q……表示,其中每层所容纳的电子数最多为_______ 个。
(3)能量关系:能层越高,电子的能量越高,能量的高低顺序为_______ <E(L)<_______ <E(N)<E(O)<E(P) _______ 。
(1)含义:根据核外电子的
(2)序号及符号:能层序号一、二、三、四、五、六、七……分别用K、L、M、N、O、P、Q……表示,其中每层所容纳的电子数最多为
(3)能量关系:能层越高,电子的能量越高,能量的高低顺序为
您最近一年使用:0次
2 . 概率密度
1913年,_______ 提出氢原子模型,电子在_______ 上绕核运行。量子力学指出,一定空间运动状态的电子在核外空间各处都可能出现,但出现的_______ 不同,可用概率密度(ρ)表示,即ρ=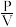 (P表示电子在某处出现的
(P表示电子在某处出现的_______ ;V表示该处的体积)。
1913年,
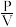 (P表示电子在某处出现的
(P表示电子在某处出现的
您最近一年使用:0次
21-22高二下·全国·单元测试
解题方法
3 . 熟记第四周期未成对电子数规律
| 未成对电子数及其占据的原子轨道 | 元素符号及价电子排布 | |
| 1 | 4s | K:4s1,Cu: |
| 3d | Sc:3d14s2 | |
| 4p | Ga:4s24p1,Br: | |
| 2 | 3d | Ti:3d24s2,Ni: |
| 4p | Ge:4s24p2,Se:4s24p4 | |
| 3 | 3d | V:3d34s2,Co: |
| 4p | As:4s24p3 | |
| 4 | 3d | Fe: |
| 5 | 3d | Mn:3d54s2 |
| 6 | 3d和4s | Cr:3d54s1 |
您最近一年使用:0次
21-22高二下·全国·单元测试
解题方法
4 . 原子轨道
(1)概念:量子力学把电子在原子核外的一个_______ 称为一个原子轨道。
(2)形状
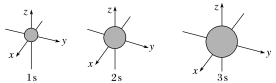
①s电子的原子轨道呈_______ 形,能层序数越_______ ,原子轨道的半径越_______ 。
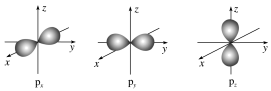
②p电子的原子轨道呈_______ 形,能层序数越_______ ,原子轨道的半径越_______ 。
(1)概念:量子力学把电子在原子核外的一个
(2)形状
①s电子的原子轨道呈

②p电子的原子轨道呈

您最近一年使用:0次
21-22高二下·全国·单元测试
解题方法
5 . 电子排布式
将_______ 上所容纳的电子数标在该能级符号_______ ,并按照能层从左到右的顺序排列的式子。
如氮原子的电子排布式为:

例:根据构造原理,写出下列基态原子的核外电子排布式
①2He:_______ ;
②8O:_______ ;
③10Ne:_______ ;
④14Si:_______ ;
⑤18Ar:_______ ;
⑥19K:_______ ;
⑦21Sc:_______ ;
⑧26Fe:_______ 。
将
如氮原子的电子排布式为:

例:根据构造原理,写出下列基态原子的核外电子排布式
①2He:
②8O:
③10Ne:
④14Si:
⑤18Ar:
⑥19K:
⑦21Sc:
⑧26Fe:
您最近一年使用:0次
21-22高二下·全国·单元测试
解题方法
6 . 解题技巧:粒子半径比较的一般思路
(1)“一层”:先看能层数,能层数越_______ ,一般微粒半径越_______ 。
(2)“二核”:若能层数相同,则看核电荷数,核电荷数越_______ ,微粒半径越_______ 。
(3)“三电子”:若能层数、核电荷数均相同,则看核外电子数,电子数_______ 的半径_______ 。
(1)“一层”:先看能层数,能层数越
(2)“二核”:若能层数相同,则看核电荷数,核电荷数越
(3)“三电子”:若能层数、核电荷数均相同,则看核外电子数,电子数
您最近一年使用:0次
7 . 注意:电离能的影响因素及特例
(1)电离能数值的大小主要取决于原子的_______ 、原子半径及原子的电子构型。
(2)具有全充满、半充满及全空的电子构型的元素稳定性较高,其电离能数值_______ ,如稀有气体的电离能在同周期元素中_______ ,N为半充满、Mg为全充满状态,其电离能均比同周期相邻元素大。一般情况,第一电离能:ⅡA_______ ⅢA,ⅤA_______ ⅥA。
(1)电离能数值的大小主要取决于原子的
(2)具有全充满、半充满及全空的电子构型的元素稳定性较高,其电离能数值
您最近一年使用:0次
8 . 比较下列能级的能量大小关系(填“>”“=”或“<”):
(1)2s_______ 4s;
(2)3p_______ 3d;
(3)3d_______ 4s;
(4)4d_______ 5d;
(5)2p_______ 3s;
(6)4d_______ 5f。
(1)2s
(2)3p
(3)3d
(4)4d
(5)2p
(6)4d
您最近一年使用:0次
9 . 电离能的应用
(1)根据电离能数据,确定元素原子核外电子的排布及元素的化合价。如Li:I1≪I2<I3,表明Li原子核外的_______ 个电子排布在两个能层上(K、L能层),且最外层上只有一个电子,易失去_______ 形成_______ 阳离子。
(2)判断元素的金属性、非金属性强弱:I1越_______ ,元素的非金属性越_______ ;I1越小,元素的金属性越_______ 。
(1)根据电离能数据,确定元素原子核外电子的排布及元素的化合价。如Li:I1≪I2<I3,表明Li原子核外的
(2)判断元素的金属性、非金属性强弱:I1越
您最近一年使用:0次
21-22高二下·全国·单元测试
解题方法
10 . 应用
①判断元素的金属性和非金属性强弱
i.金属的电负性一般_______ 1.8,非金属的电负性一般_______ 1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在_______ 左右,它们既有金属性,又有非金属性。
ii.金属元素的电负性_______ ,金属元素越活泼;非金属元素的电负性_______ ,非金属元素越活泼。
②判断元素的化合价
i.电负性数值小的元素在化合物中吸引电子的能力_______ ,元素的化合价为_______ 。
ii.电负性数值大的元素在化合物中吸引电子的能力_______ ,元素的化合价为_______ 。
③判断化合物的类型

如H的电负性为2.1,Cl的电负性为3.0,Cl的电负性与H的电负性之差为3.0-2.1=0.9<1.7,故HCl为共价化合物;如Al的电负性为1.5,Cl的电负性与Al的电负性之差为3.0-1.5=1.5<1.7,因此AlCl3为共价化合物;同理,BeCl2也是共价化合物。
注意:电负性之差大于1.7的元素不一定都形成离子化合物,如F的电负性与H的电负性之差为1.9,但HF为共价化合物。
①判断元素的金属性和非金属性强弱
i.金属的电负性一般
ii.金属元素的电负性
②判断元素的化合价
i.电负性数值小的元素在化合物中吸引电子的能力
ii.电负性数值大的元素在化合物中吸引电子的能力
③判断化合物的类型

如H的电负性为2.1,Cl的电负性为3.0,Cl的电负性与H的电负性之差为3.0-2.1=0.9<1.7,故HCl为共价化合物;如Al的电负性为1.5,Cl的电负性与Al的电负性之差为3.0-1.5=1.5<1.7,因此AlCl3为共价化合物;同理,BeCl2也是共价化合物。
注意:电负性之差大于1.7的元素不一定都形成离子化合物,如F的电负性与H的电负性之差为1.9,但HF为共价化合物。
您最近一年使用:0次



