名校
解题方法
1 . 新冠肺炎疫情防控,消毒用品必不可少。试回答下列问题:
(1)过氧乙酸(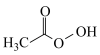 )也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有
)也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有___________ ,分子中 键和
键和 键的个数比为
键的个数比为___________ 。
(2)生活中常用的手消毒凝胶,其主要有效成分是三氮羟基二苯醚和乙醇,其中三氯羟基二苯醚是一种广谱抗菌剂,高效、安全。三氯羟基二苯醚的结构简式如图所示。

①组成三氯羟基二苯醚的四种元素H、C、O、Cl的电负性从大到小的顺序为___________ ;基态氯原子的价电子排布图为___________ ,最高能级的原子轨道电子云轮廓图形状为___________ 。
②三氯羟基二苯醚的熔点:55~57℃,沸点:120℃,常态为白色或灰白色晶状粉末,稍有酚臭味,不溶于水,易溶于碱液和有机溶剂,三氯羟基二苯醚属于___________ 晶体。
③乙醇与甲醚 的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是
的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是___________ 。
(3)Na、K等活泼金属在 中燃烧得到的
中燃烧得到的 、
、 具有强氧化性,也常做消毒剂。已知
具有强氧化性,也常做消毒剂。已知 的晶胞如图所示:
的晶胞如图所示:
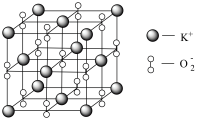
设阿伏加德罗常数的值为 ,晶胞的参数为a nm。晶胞的密度为
,晶胞的参数为a nm。晶胞的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
(1)过氧乙酸(
 )也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有
)也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有 键和
键和 键的个数比为
键的个数比为(2)生活中常用的手消毒凝胶,其主要有效成分是三氮羟基二苯醚和乙醇,其中三氯羟基二苯醚是一种广谱抗菌剂,高效、安全。三氯羟基二苯醚的结构简式如图所示。

①组成三氯羟基二苯醚的四种元素H、C、O、Cl的电负性从大到小的顺序为
②三氯羟基二苯醚的熔点:55~57℃,沸点:120℃,常态为白色或灰白色晶状粉末,稍有酚臭味,不溶于水,易溶于碱液和有机溶剂,三氯羟基二苯醚属于
③乙醇与甲醚
 的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是
的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是(3)Na、K等活泼金属在
 中燃烧得到的
中燃烧得到的 、
、 具有强氧化性,也常做消毒剂。已知
具有强氧化性,也常做消毒剂。已知 的晶胞如图所示:
的晶胞如图所示:
设阿伏加德罗常数的值为
 ,晶胞的参数为a nm。晶胞的密度为
,晶胞的参数为a nm。晶胞的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
2 . 某些过渡元素的相关化合物在化工、医药、材料等领域有着极为广泛的应用。回答下列问题:
(1)现有铜锌元素的3种微粒:①锌:[Ar]3d104s1;②铜:[Ar]3d104s1;③铜:[Ar]3d10,失去一个电子需要的最低能量由大到小的顺序是_______(填字母)。
(2)国际权威学术期刊《自然》最近报道,我国科学家选择碲化锆(ZrTes)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应。
①Zr是Ti的同族相邻元素,位于周期表的______ 区。
②Cd2+与NH3可形成配离子[Cd(NH3)4]2+。
i.该离子中不含的化学键类型有______ (填字母)。
A.离子键 B.配位键 C.σ键 D.共价键 E.π键 F.氢键
ii.已知该离子中2个NH3被2个Cl-替代只得到一种结构,则该离子的立体构型为______ 。
(3)二烃基锌(R-Zn-R)分子中烃基R与锌以σ键结合,C2H5-Zn-C2H5分子中原子的杂化方式有______ ,如表是2种二烃基锌的沸点数据,则烃基R1是______ ,推断的依据,是______ 。
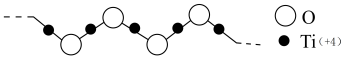
(4)硫酸氧钛(Ti)是一种优良的催化剂,其阳离子为如图所示链状聚合形式的离子,聚合度为n。则该阳离子的化学式为______ 。______ g•cm-3。用Al掺杂TiN后,其晶胞结构如图所示,距离Ti最近的Al有______ 个。(NA为阿伏加德罗常数的值)。
(1)现有铜锌元素的3种微粒:①锌:[Ar]3d104s1;②铜:[Ar]3d104s1;③铜:[Ar]3d10,失去一个电子需要的最低能量由大到小的顺序是_______(填字母)。
| A.①②③ | B.③①② | C.③②① | D.①③② |
(2)国际权威学术期刊《自然》最近报道,我国科学家选择碲化锆(ZrTes)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应。
①Zr是Ti的同族相邻元素,位于周期表的
②Cd2+与NH3可形成配离子[Cd(NH3)4]2+。
i.该离子中不含的化学键类型有
A.离子键 B.配位键 C.σ键 D.共价键 E.π键 F.氢键
ii.已知该离子中2个NH3被2个Cl-替代只得到一种结构,则该离子的立体构型为
(3)二烃基锌(R-Zn-R)分子中烃基R与锌以σ键结合,C2H5-Zn-C2H5分子中原子的杂化方式有
| 物质 | R1-Zn-R1 | C2H5-Zn-C2H5 |
| 沸点(℃) | 46 | 118 |
(4)硫酸氧钛(Ti)是一种优良的催化剂,其阳离子为如图所示链状聚合形式的离子,聚合度为n。则该阳离子的化学式为

您最近一年使用:0次
解题方法
3 . 硼是一种用途广泛的工业原料,除了用于生产硼砂、硼酸和硼的各种化合物外,在制备储氢材料方面也有重要的用途,试回答下列问题:
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为___________ , 的价层电子对数是
的价层电子对数是___________ 。
(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为___________ ;基态Q原子核外成对电子数和未成对电子数之比为___________ 。
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(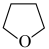 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: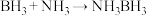 。
。
①测定晶体结构最常用的方法为___________ 。
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是___________ 。_
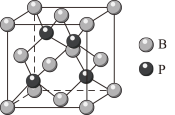
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有___________ 个;每个晶胞中的原子总数为___________ 。
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为
 的价层电子对数是
的价层电子对数是(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(
 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: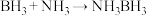 。
。①测定晶体结构最常用的方法为
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有

您最近一年使用:0次
名校
解题方法
4 . 氮元素可形成丰富的化合物,在生产生活中具有广泛用途。
(1) 是一种重要的化工原料,以
是一种重要的化工原料,以 合成
合成 ,常用
,常用 作催化剂。基态
作催化剂。基态 原子和基态
原子和基态 中未成对电子数之比为
中未成对电子数之比为_____ ;从轨道重叠方式的角度分析 的成键,
的成键, 分子中氮原子的
分子中氮原子的_____ 轨道与氢原子的 轨道重叠形成
轨道重叠形成 键。
键。
(2) 是中学化学常见微粒,键角:
是中学化学常见微粒,键角:
_____ (填“>”或“<”) 。
。
(3) (氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
① 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是_____
②比较沸点:
_____ (填“>”或“<”,下同) ,水溶性:
,水溶性:
_____  。
。
(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
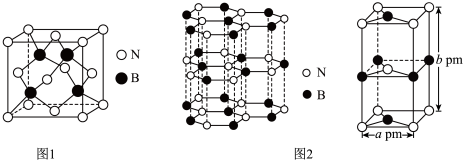
 —射线衍射实验测得立方氮化硼晶胞边长为
—射线衍射实验测得立方氮化硼晶胞边长为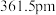 ,则立方氮化硼晶体中硼氮键的键长为
,则立方氮化硼晶体中硼氮键的键长为_____ (只列计算式) 。已知六方氮化硼密度为
。已知六方氮化硼密度为 ,底面角分别为
,底面角分别为 和
和 ,设
,设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则
_____ (列含a、b、d的计算式即可)
(1)
 是一种重要的化工原料,以
是一种重要的化工原料,以 合成
合成 ,常用
,常用 作催化剂。基态
作催化剂。基态 原子和基态
原子和基态 中未成对电子数之比为
中未成对电子数之比为 的成键,
的成键, 分子中氮原子的
分子中氮原子的 轨道重叠形成
轨道重叠形成 键。
键。(2)
 是中学化学常见微粒,键角:
是中学化学常见微粒,键角:
 。
。(3)
 (氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)的储氢量高,是具有广泛应用前景的储氢材料。①
 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是②比较沸点:

 ,水溶性:
,水溶性:
 。
。(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

 —射线衍射实验测得立方氮化硼晶胞边长为
—射线衍射实验测得立方氮化硼晶胞边长为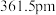 ,则立方氮化硼晶体中硼氮键的键长为
,则立方氮化硼晶体中硼氮键的键长为 。已知六方氮化硼密度为
。已知六方氮化硼密度为 ,底面角分别为
,底面角分别为 和
和 ,设
,设 为阿伏加德罗常数的值,则
为阿伏加德罗常数的值,则
您最近一年使用:0次
2024-04-02更新
|
448次组卷
|
3卷引用:第三章晶体结构与性质(B卷)
解题方法
5 . W、R、X、Y、Z是原子序数依次增大的前四周期元素,其元素性质或原子结构如下表:
请按要求填空:
(1)Y的基态原子有_______ 种不同的运动状态的电子,Z的价电子排布图为______ 。
(2)W、R、X的简单氢化物中,键角由大到小排列的是___________ (用对应的分子式表示),原因是___________ 。
(3)已知:羧酸的酸性可用pKa(pKa=−lgKa)的大小来衡量,pKa越小,酸性越强。
由表可见,酸性:三氯乙酸___________ 三氟乙酸(填“大于”“小于”或“等于”),从键的极性角度解释原因:___________ 。
| 元素 | 元素性质或原子结构 |
| W | 基态原子L能层所有能级上电子数相同 |
| R | 第二周期元素基态原子中未成对电子最多 |
| X | 基态原子核外s能级上电子总数与p能级上电子总数相等,且第一电离能低于同周期相邻元素 |
| Y | 次外层电子数是最外层电子数的2倍 |
| Z | 最外层只有1个电子,其他内层各能级所有轨道电子均成对 |
(1)Y的基态原子有
(2)W、R、X的简单氢化物中,键角由大到小排列的是
(3)已知:羧酸的酸性可用pKa(pKa=−lgKa)的大小来衡量,pKa越小,酸性越强。
| 羧酸 | pKa |
| 三氯乙酸(CCl3COOH) | 0.65 |
| 三氟乙酸(CF3COOH) | 0.23 |
您最近一年使用:0次
解题方法
6 . X、Y、Z、R、Q是元素周期表中前四周期的元素,它们的原子序数依次增大且分别位于前四周期的各个周期中。对它们的性质及结构的描述如下:X原子的基态只有一种形状的电子云,并容易形成共价键;Y的基态原子有3个不同的能级,各能级中电子数相等;Z与Y同周期,其第一电离能高于同周期与之相邻的元素;R元素的电负性在同周期元素中最大;Q元素的基态原子在前四周期中未成对电子数最多。据此,请回答下列问题。
(1)写出X的元素符号______ ,基态Q原子的电子排布式______ 。
(2)R元素的基态原子核外电子共占据______ 个原子轨道?
(3)与Q同周期的元素的基态原子中最外层电子数与Q原子相同的元素有______ ?
(4)将X、Y、Z三种元素按电负性由大到小的顺序排列______ (用元素符号表示)。
(5)已知X、Y、Z组成的一种物质的结构式为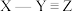 ,尝试推断该物质中Y元素的化合价
,尝试推断该物质中Y元素的化合价______ 。
(1)写出X的元素符号
(2)R元素的基态原子核外电子共占据
(3)与Q同周期的元素的基态原子中最外层电子数与Q原子相同的元素有
(4)将X、Y、Z三种元素按电负性由大到小的顺序排列
(5)已知X、Y、Z组成的一种物质的结构式为
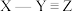 ,尝试推断该物质中Y元素的化合价
,尝试推断该物质中Y元素的化合价
您最近一年使用:0次
7 . 前四周期元素A、B、C、D、E原子序数依次增大,其相关性质如表所示:
请根据以上情况,回答下列问题:
(1)A元素在周期表中的位置为_______ ,其基态原子的价电子排布图为_______ 。
(2)A、B、D三种元素第一电离能由大到小的顺序为_______ (用元素符号表示)。B、C、D三种元素的简单离子的半径由大到小的顺序为_______ (用离子符号表示)。
(3)B和C可形成一种同时含有共价键和离子键的化合物,写出此化合物与水反应的化学方程式_______ 。
(4)E元素基态原子核外有_______ 种运动状态不同的电子,该元素的简化电子排布式为_______ 。
| A | 2p能级电子半充满 |
| B | 与A同周期,且原子核外有2个未成对电子 |
| C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
| D | 其基态原子外围电子排布式为 |
| E | 前四周期元素中,E元素基态原子未成对电子数最多 |
(1)A元素在周期表中的位置为
(2)A、B、D三种元素第一电离能由大到小的顺序为
(3)B和C可形成一种同时含有共价键和离子键的化合物,写出此化合物与水反应的化学方程式
(4)E元素基态原子核外有
您最近一年使用:0次
2022-11-22更新
|
1001次组卷
|
5卷引用:【知识图鉴】单元讲练测选择性必修2第1章03巩固练
(已下线)【知识图鉴】单元讲练测选择性必修2第1章03巩固练(已下线)第一章 原子结构与性质(A卷)四川省德阳市第五中学校2022-2023学年高二上学期期中考试化学试题浙江省宁波市鄞州中学2023-2024学年高二上学期期中考试化学试卷四川省宜宾市兴文第二中学校2023-2024学年高二下学期开学化学试题
名校
解题方法
8 . 现有部分前四周期元素的性质或原子结构如下表:
(1)T在周期表中的位置为___________ ,基态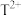 的核外电子排布式为
的核外电子排布式为_____________ ;T的单质在高温下与X的氢化物反应,其化学方程式为____________________________________________ 。
(2)基态Z原子中,核外电子占据的最高能级的符号是______________ ,占据最高能级的电子的电子云形状为______________ 。
(3)W、X、Y三种元素的离子半径由大到小的顺序是______________ (用离子符号表示)。
(4)在W、X的气态氢化物中,较稳定的是__________________________________________ 。
元素编号 | 元素性质或原子结构 |
W | 单质能与水剧烈反应,所得溶液呈弱酸性 |
X | 基态原子的s轨道与p轨道电子数相等 |
Y | 第三周期元素的简单离子中半径最小 |
Z | L层有三个未成对电子 |
T | 该元素的正三价离子的3d能级为半充满 |
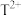 的核外电子排布式为
的核外电子排布式为(2)基态Z原子中,核外电子占据的最高能级的符号是
(3)W、X、Y三种元素的离子半径由大到小的顺序是
(4)在W、X的气态氢化物中,较稳定的是
您最近一年使用:0次
2022-11-15更新
|
594次组卷
|
4卷引用:【知识图鉴】单元讲练测选择性必修2第1章02基础练
(已下线)【知识图鉴】单元讲练测选择性必修2第1章02基础练(已下线)第一章 原子结构与性质(A卷)上海财经大学附属中学2022-2023学年高二上学期期中考试化学试题新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高二下学期第一次月考化学试卷
9 . 根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)X元素基态原子次外层电子数是最外层电子数的 ,其价电子轨道表示式是
,其价电子轨道表示式是____ 。
(2)Y是1~36号元素原子核外电子排布中未成对电子数最多的元素,Y元素的名称是____ ,在元素周期表中的位置是___ 。
(3)Z元素基态原子的轨道表示式是图中的____ (填写序号),____ 。
a.能量最低原理 b.泡利不相容原理 c.洪特规则
(4)第三周期元素的气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能量叫作第一电离能(I1)。如图所示:____ 。
②根据图中提供的信息,可推断出I氧____ I氟(填“>”“<”或“=”,下同)。
③根据第一电离能的含义和元素周期律,可推断出I镁____ I钙。
(1)X元素基态原子次外层电子数是最外层电子数的
 ,其价电子轨道表示式是
,其价电子轨道表示式是(2)Y是1~36号元素原子核外电子排布中未成对电子数最多的元素,Y元素的名称是
(3)Z元素基态原子的轨道表示式是图中的
①
②
a.能量最低原理 b.泡利不相容原理 c.洪特规则
(4)第三周期元素的气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能量叫作第一电离能(I1)。如图所示:
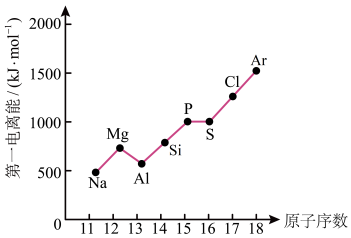
②根据图中提供的信息,可推断出I氧
③根据第一电离能的含义和元素周期律,可推断出I镁
您最近一年使用:0次
2022-11-03更新
|
613次组卷
|
13卷引用:第1章 原子结构——B拓展区综合拓展(鲁科版选修3)
第1章 原子结构——B拓展区综合拓展(鲁科版选修3)(已下线)第1章 章末综合测评B-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修1)人教化学选修3第一章第二节课时4海南省海口市海南枫叶国际学校2019-2020学年高二下学期期中考试化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 B素养拓展区(已下线)考点33 原子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)上海市建平中学2022-2023学年上学期高二10月月考化学(B卷)试题山西省朔州市怀仁市大地学校2021-2022学年高二上学期第四次月考化学试题安徽省滁州市定远县育才学校2021-2022学年高二下学期分层班第二次月考化学试题湖南省娄底市新化县2022-2023学年高二上学期期末考试化学试题广东省东莞市东华高级中学2022-2023学年高二下学期3月月考化学试题陕西省渭南市华州区咸林中学2023-2024学年高二下学期期中考试化学试题
10 . 已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A原子的电子只有一种自旋取向,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10电子分子,B、C处于同一周期,两者可以形成许多种共价化合物,C、F处于同一主族,B原子最外p能级上的电子处于半充满状态,C的最外层电子数是内层电子数的3倍,E的最外层电子数比最内层电子数多1。元素H原子M能层为全充满状态,且核外只有一个未成对电子的某金属元素,回答下列问题:
(1)E元素基态原子的简化电子排布式为____ 。F元素基态原子的价电子排布图为____ 。
(2)F、G元素对应的最高价含氧酸中酸性较强的化学式为___ 。离子半径:D+___ (填“<”“>”或“=”)B3-。
(3)元素C的简单气态氢化物的沸点____ (填“高于”或“低于”)元素F的简单气态氢化物的沸点,其主要原因是____ 。
(4)元素C与氟元素相比,非金属性较强的是____ (用元素符号表示),下列表述中能证明这一事实的是____ (填序号字母)。
a.常温下氟气的颜色比C单质的颜色深 b.氟气与C的氢化物剧烈反应,产生C的单质
c.氟与C形成的化合物中C元素呈正价态 d.比较两元素的单质与氢气化合时得电子的数目
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为____ 。试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式:____ 。
(6)E元素原子的第一电离能____ 镁(填“>”“<”或“=”),镁燃烧时会产生耀眼的白光,原因是____ 。
(7)元素H的原子核外电子有____ 种空间运动状态,化合物HC在加热条件下容易转化为H2C,从原子结构的角度解释原因____ 。
(1)E元素基态原子的简化电子排布式为
(2)F、G元素对应的最高价含氧酸中酸性较强的化学式为
(3)元素C的简单气态氢化物的沸点
(4)元素C与氟元素相比,非金属性较强的是
a.常温下氟气的颜色比C单质的颜色深 b.氟气与C的氢化物剧烈反应,产生C的单质
c.氟与C形成的化合物中C元素呈正价态 d.比较两元素的单质与氢气化合时得电子的数目
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为
(6)E元素原子的第一电离能
(7)元素H的原子核外电子有
您最近一年使用:0次



