1 . Ⅰ.(1)下列晶体中,属于离子晶体的是_______ 。
A. B.
B.  C.
C.  D.
D. 
(2)下列关于元素电负性大小的比较中,正确的是_______ 。
A.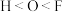 B.
B.  C.
C. 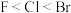 D.
D. 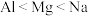
(3)下列能级中轨道数为5的是_______ 。
A. 能级 B.
能级 B.  能级 C.
能级 C.  能级 D.
能级 D.  能级
能级
(4)用短线“—”表示共用电子对,用“··”表示未成键孤电子对的式子叫路易斯结构式。 分子的路易斯结构式可以表示为
分子的路易斯结构式可以表示为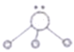 ,以下叙述正确的是
,以下叙述正确的是_______ 。
A. 可以是
可以是 B.
B.  分子的立体构型为三角锥形
分子的立体构型为三角锥形
C. 是非极性分子 D. 键角大于
是非极性分子 D. 键角大于
(5)下列有关 键、π键说法中
键、π键说法中不正确 的是_______ 。
A. 分子中有2个
分子中有2个 键,2个π键
键,2个π键
B. 气体单质中,一定有 键,可能有π键
键,可能有π键
C. 键比π键重叠程度大,形成的共价键较强
键比π键重叠程度大,形成的共价键较强
D. 两个原子之间形成共价键时,最多有一个 键
键
Ⅱ. 第四周期中的18种元素具有重要的用途。
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为_______ , 成为阳离子时首先失去
成为阳离子时首先失去_______ 轨道电子。
(2)金属 在材料科学上也有重要作用,它易形成配合物,如:
在材料科学上也有重要作用,它易形成配合物,如: 、
、 等。写出一种与配体
等。写出一种与配体 互为等电子体的阴离子
互为等电子体的阴离子_______ 。
(3)已知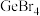 是电子工业中的一种常用试剂,其熔点为
是电子工业中的一种常用试剂,其熔点为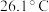 ,沸点为
,沸点为 ,则
,则 晶体类型为
晶体类型为_______ ,中心原子的杂化类型为_______ 。
(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,但 的第一电离能却明显低于
的第一电离能却明显低于 ,原因是
,原因是_______ 。
(5) 和
和 形成的一种晶体晶胞,原子堆积方式如图所示。图中六棱柱体积为
形成的一种晶体晶胞,原子堆积方式如图所示。图中六棱柱体积为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度
,则该晶体的密度
_______  。
。
A.
 B.
B.  C.
C.  D.
D. 
(2)下列关于元素电负性大小的比较中,正确的是
A.
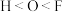 B.
B.  C.
C. 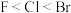 D.
D. 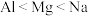
(3)下列能级中轨道数为5的是
A.
 能级 B.
能级 B.  能级 C.
能级 C.  能级 D.
能级 D.  能级
能级(4)用短线“—”表示共用电子对,用“··”表示未成键孤电子对的式子叫路易斯结构式。
 分子的路易斯结构式可以表示为
分子的路易斯结构式可以表示为 ,以下叙述正确的是
,以下叙述正确的是A.
 可以是
可以是 B.
B.  分子的立体构型为三角锥形
分子的立体构型为三角锥形C.
 是非极性分子 D. 键角大于
是非极性分子 D. 键角大于
(5)下列有关
 键、π键说法中
键、π键说法中A.
 分子中有2个
分子中有2个 键,2个π键
键,2个π键B. 气体单质中,一定有
 键,可能有π键
键,可能有π键C.
 键比π键重叠程度大,形成的共价键较强
键比π键重叠程度大,形成的共价键较强D. 两个原子之间形成共价键时,最多有一个
 键
键Ⅱ. 第四周期中的18种元素具有重要的用途。
(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为 成为阳离子时首先失去
成为阳离子时首先失去(2)金属
 在材料科学上也有重要作用,它易形成配合物,如:
在材料科学上也有重要作用,它易形成配合物,如: 、
、 等。写出一种与配体
等。写出一种与配体 互为等电子体的阴离子
互为等电子体的阴离子(3)已知
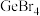 是电子工业中的一种常用试剂,其熔点为
是电子工业中的一种常用试剂,其熔点为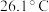 ,沸点为
,沸点为 ,则
,则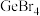 晶体类型为
晶体类型为(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,但
 的第一电离能却明显低于
的第一电离能却明显低于 ,原因是
,原因是(5)
 和
和 形成的一种晶体晶胞,原子堆积方式如图所示。图中六棱柱体积为
形成的一种晶体晶胞,原子堆积方式如图所示。图中六棱柱体积为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度
,则该晶体的密度
 。
。
您最近一年使用:0次
解题方法
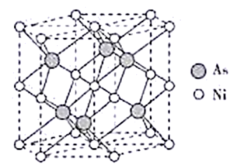
2 . 镍、铜等金属及其化合物在工农业生产上有重要用途。回答下列问题:
(1)基态Ni的核外电子排布式为___________ ,Ni位于元素周期表中___________ 区(填“s”“p”“d”或“ds”),其核外电子占据的最高能层符号为___________ 。
(2)第二电离能I2(Ni)___________ I2(Cu)(填“<”或“>”),其原因是___________ 。
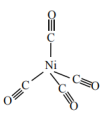
(3)Ni与CO能形成如图所示的配合物Ni(CO)4,该分子中 键与
键与 键个数比为
键个数比为___________ 。Ni(CO)4易溶于___________ (填标号)。
A.水 B.四氯化碳 C.苯 D.稀H2SO4
(4)将Cu粉加入浓氨水中,并通入O2,充分反应后溶液呈深蓝色,该反应的离子方程式为___________ 。
(5)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Ni2+与EDTA形成的螯合物的结构如图所示,1个该配合物中通过螯合作用形成的配位键有___________ 个,其中提供孤对电子的原子为___________ (写元素符号)。

(1)基态Ni的核外电子排布式为
(2)第二电离能I2(Ni)
(3)Ni与CO能形成如图所示的配合物Ni(CO)4,该分子中
 键与
键与 键个数比为
键个数比为
A.水 B.四氯化碳 C.苯 D.稀H2SO4
(4)将Cu粉加入浓氨水中,并通入O2,充分反应后溶液呈深蓝色,该反应的离子方程式为
(5)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Ni2+与EDTA形成的螯合物的结构如图所示,1个该配合物中通过螯合作用形成的配位键有

您最近一年使用:0次
名校
解题方法
3 . 过渡金属钛、铜、锌等金属及其化合物在工业上有重要用途。
(1)基态钛原子和铜原子最外层电子数之比为______________ 。
(2)TiOSO4溶液中加入H2O2可以生成稳定的[TiO(H2O2)]2+。已如S2Cl2的分子结构与H2O2相似,第一电离能(I1):I1(O)_____ I1(S)(填“大于或“小于”), 原因是______ ;沸点:H2O2____ S2Cl2(填“>”或“<”),其原因是_____ 。
(3)超细铜粉可用作导电材料、催化剂等,制备方法如下:

①关于[Cu(NH3)4]SO4和NH4CuSO3中的阴离子相同之处为_______ , 不同之处为_____ (填标号)
A.中心原子的杂化轨道类型 B.中心原子的孤电子对数
C.立体结构 D.VSEPR模型
②与[Cu(NH3)4]SO4外界离子互为等电子体的微粒是_______________ (任写一种)
(4)ZnS在荧光体、光导体材料、涂料、酸料等行业中应用广泛。立方ZnS晶体结构如图所示,

a为S2−,b为Zn2+,其晶胞边长为apm,则晶体的密度为______________ g∙cm−3[Mr(ZnS)=97,用含NA和a的代数式表示]。
(1)基态钛原子和铜原子最外层电子数之比为
(2)TiOSO4溶液中加入H2O2可以生成稳定的[TiO(H2O2)]2+。已如S2Cl2的分子结构与H2O2相似,第一电离能(I1):I1(O)
(3)超细铜粉可用作导电材料、催化剂等,制备方法如下:

①关于[Cu(NH3)4]SO4和NH4CuSO3中的阴离子相同之处为
A.中心原子的杂化轨道类型 B.中心原子的孤电子对数
C.立体结构 D.VSEPR模型
②与[Cu(NH3)4]SO4外界离子互为等电子体的微粒是
(4)ZnS在荧光体、光导体材料、涂料、酸料等行业中应用广泛。立方ZnS晶体结构如图所示,

a为S2−,b为Zn2+,其晶胞边长为apm,则晶体的密度为
您最近一年使用:0次
2020-12-23更新
|
472次组卷
|
2卷引用:四川省达州市2021届高三第一次诊断性测试理综化学试题
解题方法
4 . 氟及其化合物用途十分广泛,回答下列问题:
(1)氟化物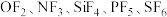 中,中心原子采取
中,中心原子采取 杂化且分子构型为正四面体形的是
杂化且分子构型为正四面体形的是_______ 。
(2)已知氟锑酸是一种超强酸,基态锑的电子排布式为_______ 。
(3)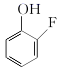 的分子内部存在氢键,画出氢键结构:
的分子内部存在氢键,画出氢键结构:_______ 。
(4)工业上电解 制取单质铝,常利用冰晶石
制取单质铝,常利用冰晶石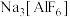 降低
降低 的熔点。冰晶石的生产原理为
的熔点。冰晶石的生产原理为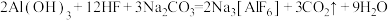 。
。
①测定气态 的摩尔质量时,往往得不到
的摩尔质量时,往往得不到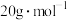 的数据,原因是
的数据,原因是_______ 。
②反应物中元素(氢除外)的第一电离能从大到小的顺序为_______ (用元素符号表示)。
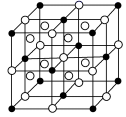
③冰晶石由阴阳离子两种微粒构成,冰晶石的晶胞结构如图所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是_______ (填具体的微粒符号)。
(1)氟化物
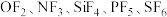 中,中心原子采取
中,中心原子采取 杂化且分子构型为正四面体形的是
杂化且分子构型为正四面体形的是(2)已知氟锑酸是一种超强酸,基态锑的电子排布式为
(3)
 的分子内部存在氢键,画出氢键结构:
的分子内部存在氢键,画出氢键结构:(4)工业上电解
 制取单质铝,常利用冰晶石
制取单质铝,常利用冰晶石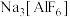 降低
降低 的熔点。冰晶石的生产原理为
的熔点。冰晶石的生产原理为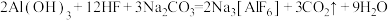 。
。①测定气态
 的摩尔质量时,往往得不到
的摩尔质量时,往往得不到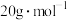 的数据,原因是
的数据,原因是②反应物中元素(氢除外)的第一电离能从大到小的顺序为
③冰晶石由阴阳离子两种微粒构成,冰晶石的晶胞结构如图所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是

您最近一年使用:0次



