名校
解题方法
1 . Fe、Co、Ni是第四周期的重要的金属元素,回答下列问题:
(1)FeCoOx是一种新型光电催化剂,第四电离能大小关系是I4(Fe)_____ I4(Co)(填“>”“<”或“=”),原因是____________________ 。
(2)二茂铁是一种具有芳香族性质的有机过渡金属化合物。其在工业、农业、医药、航天、节能、环保等行业具有广泛的应用。环戊二烯可用于制备二茂铁。
①环戊二烯中碳原子的杂化方式为____________
②1mol环戊二烯中有__________ molσ键。
(3)①FeS2晶体的晶胞如图甲所示。已知其晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,晶胞边长__________ nm。
②该晶胞中Fe2+位于S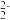 所形成的正八面体的体心,则正八面体的边长为
所形成的正八面体的体心,则正八面体的边长为______ nm
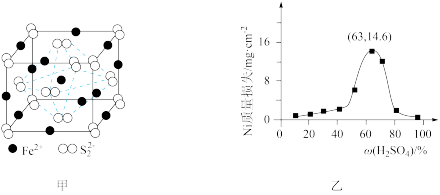
(4)基态Ni2+的价电子排布图为________ 。在一定温度下将Ni片与不同质量分数的硫酸反应,4h后的Ni的质量损失情况如图乙所示,发现当硫酸质量分数大于63%时Ni被腐蚀的速率逐渐降低,其可能原因为__________________ 。
(1)FeCoOx是一种新型光电催化剂,第四电离能大小关系是I4(Fe)
(2)二茂铁是一种具有芳香族性质的有机过渡金属化合物。其在工业、农业、医药、航天、节能、环保等行业具有广泛的应用。环戊二烯可用于制备二茂铁。
①环戊二烯中碳原子的杂化方式为
②1mol环戊二烯中有
(3)①FeS2晶体的晶胞如图甲所示。已知其晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,晶胞边长
②该晶胞中Fe2+位于S
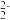 所形成的正八面体的体心,则正八面体的边长为
所形成的正八面体的体心,则正八面体的边长为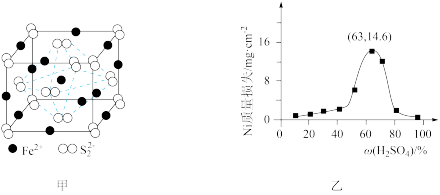
(4)基态Ni2+的价电子排布图为
您最近一年使用:0次
名校
解题方法
2 . 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中A原子核外有三个未成对电子;化合物B2E为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的; F原子最外层电子数与B的相同,其余各层均充满电子。请根据以上信息,回答下列问题(注:A、B、C、D、E、F用所对应的元素符号表示):
(1)A、B、C、D的第一电离能由小到大的顺序为___________ (用元素符号表示)。
(2)B的氯化物的熔点比MgO的熔点___________ (填“高”或“低”)。
(3)F的外围电子排布式是___________ 。
(4)A、F形成某种化合物的晶胞结构如图所示(其中A显−3价),则其化学式为___________ (每个球均表示1个原子)。
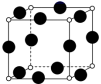
(5)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,其晶体中所含的化学键类型为___________ 。
(1)A、B、C、D的第一电离能由小到大的顺序为
(2)B的氯化物的熔点比MgO的熔点
(3)F的外围电子排布式是
(4)A、F形成某种化合物的晶胞结构如图所示(其中A显−3价),则其化学式为

(5)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,其晶体中所含的化学键类型为
您最近一年使用:0次
2021-10-19更新
|
205次组卷
|
2卷引用:江苏省淮安市涟水县第一中学2022届高三第一次阶段检测化学试卷
解题方法
3 . 不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素。其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3以防止腐蚀。
(1)基态碳原子的电子排布图为___ 。
(2)铬和镍元素都易形成配位化合物:
①[Cr(H2O)4Cl2]Cl•2H2O中Cr3+的配位数为___ 。
②硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。[Ni(NH3)6]SO4中阴离子的立体构型是___ ,在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为____ 。
③氨是___ 分子(填“极性”或“非极性”),中心原子的轨道杂化类型为___ ,氨的沸点高于PH3,原因是___ 。
(3)镍元素基态原子的价电子排布式为___ ,3d能级上的未成对电子数为___ 。
(4)单质铜及镍都是由金属键形成的晶体,元素铜与镍的第二电离能分别为:ICu=1958kJ/mol、INi=1753kJ/mol,ICu>INi的原因是___ 。
(5)某镍白铜合金的立方晶胞结构如图所示。若合金的密度为dg/cm3,晶胞参数a=___ nm。

(1)基态碳原子的电子排布图为
(2)铬和镍元素都易形成配位化合物:
①[Cr(H2O)4Cl2]Cl•2H2O中Cr3+的配位数为
②硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。[Ni(NH3)6]SO4中阴离子的立体构型是
③氨是
(3)镍元素基态原子的价电子排布式为
(4)单质铜及镍都是由金属键形成的晶体,元素铜与镍的第二电离能分别为:ICu=1958kJ/mol、INi=1753kJ/mol,ICu>INi的原因是
(5)某镍白铜合金的立方晶胞结构如图所示。若合金的密度为dg/cm3,晶胞参数a=

您最近一年使用:0次
2020-02-12更新
|
793次组卷
|
3卷引用:2021年广东省高考化学试卷变式题11-21



