名校
解题方法
1 . 短周期元素Q、R、T、W在周期表中的位置如图所示,其中,T所处周期序数与主族序数相等,则下列说法正确的是

| A.元素R的最高价氧化物对应的水化物是高沸点酸 |
| B.元素T和W各自形成的简单离子都能促进水的电离 |
| C.简单离子半径:W>T>R |
| D.常温下,T的单质能完全溶于R的最高价氧化物的水化物的浓溶液中 |
您最近一年使用:0次
2017-05-27更新
|
538次组卷
|
2卷引用:四川省资阳市外国语实验学校2021-2022学年高一下学期期中考试化学试题
名校
2 . X、Y、Z、M、W、N六种元素的原子序数依次增大,其中X、Y、Z、M、W为五种短周期元素。X元素的某种核素无中子,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示,N是用量最多的金属元素。下列说法不正确 的是
| Y | Z | M | ||
| W |
| A.原子半径:W>Y>Z>M>X |
| B.N的一种氧化物可用作油漆和涂料 |
| C.氢化物的沸点:Z小于M |
| D.工业上制备W单质的方法为电解熔融的W的氧化物 |
您最近一年使用:0次
2017-05-25更新
|
1560次组卷
|
4卷引用:【全国百强校】云南省曲靖市第一中学2018-2019学年高一下学期期中考试化学试题
【全国百强校】云南省曲靖市第一中学2018-2019学年高一下学期期中考试化学试题辽宁省鞍山市第一中学2017届高三下学期最后一次模拟考试理科综合化学试题辽宁省实验中学东戴河分校2019-2020学年高二12月月考化学试题(已下线)专题16 元素周期律和元素周期表(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练
名校
3 . 下表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素的元素符号:① ______ ,⑥______ ,⑦ _______ ,⑨______ 。
(2)画出下列微粒的结构示意图:④的原子:____________ ,⑧的离子:___________ 。
(3)表中的12种元素中,金属性最强的元素是________ ,非金属性最强的元素是_________ ,最不活泼的元素是_______ 。(均填元素符号)
(4)③④⑤⑦⑧五种元素中,离子半径最大的元素是______ (填元素符号)。元素③和⑦可以形成 _____________ (填“离子”或“共价”)化合物。
(5)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子方程式____________ 。
族 周期 | IA | IIA | IIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)画出下列微粒的结构示意图:④的原子:
(3)表中的12种元素中,金属性最强的元素是
(4)③④⑤⑦⑧五种元素中,离子半径最大的元素是
(5)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子方程式
您最近一年使用:0次
4 . 下图是元素周期表的一部分。
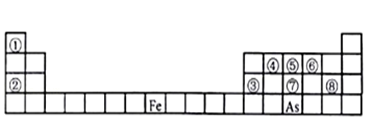
Ⅰ、用化学用语回答下列问题:
(1)由②、⑥两元素形成的强氧化性物质的电子式为_______ ,由①、⑤两元素构成的10电子化合物的形成过程为_______ 。
(2)⑦、⑧的最高价含氧酸的酸性较弱的是_______ 。(化学式表示)
(3)As在元素周期表中位置为__ ;氢化物的沸点:NH3 _______ AsH3(填“>”或“<”)
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为_______ ,当消耗75g还原剂时,电子转移了__ mol。
Ⅱ、A、B、C、D、E、X是上述周期表给出元素组成的常见单质或化合物。已知A、B、C、D、E、X存在如下图所示转化关系(部分生成物和反应条件略去),若常温下A为红棕色气体,B为强酸,X为常见金属单质。
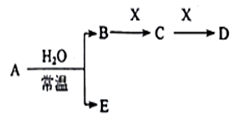
(1)A与水反应的化学方程式为_______ 。
(2)工业上常用CO热还原法冶炼X,写出其化学方程式_______ 。
(3)某温度下(>100℃)若m克X与H2O反应放出QkJ(Q>0)的热量。写出该反应的热化学方程式_______ 。
Ⅲ、由①、⑤、⑥、S和Fe五种元素组成的相对分子质量为392的化合物B,B中含有结晶水。对化合物B进行如下实验:
a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味气体;过一段时间白色沉淀变为灰绿色,最终变为红褐色。
b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
(1)由实验a、b推知B溶液中含有的离子为_______ ;
(2)B的化学式为_______ 。

Ⅰ、用化学用语回答下列问题:
(1)由②、⑥两元素形成的强氧化性物质的电子式为
(2)⑦、⑧的最高价含氧酸的酸性较弱的是
(3)As在元素周期表中位置为
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为
Ⅱ、A、B、C、D、E、X是上述周期表给出元素组成的常见单质或化合物。已知A、B、C、D、E、X存在如下图所示转化关系(部分生成物和反应条件略去),若常温下A为红棕色气体,B为强酸,X为常见金属单质。

(1)A与水反应的化学方程式为
(2)工业上常用CO热还原法冶炼X,写出其化学方程式
(3)某温度下(>100℃)若m克X与H2O反应放出QkJ(Q>0)的热量。写出该反应的热化学方程式
Ⅲ、由①、⑤、⑥、S和Fe五种元素组成的相对分子质量为392的化合物B,B中含有结晶水。对化合物B进行如下实验:
a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味气体;过一段时间白色沉淀变为灰绿色,最终变为红褐色。
b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
(1)由实验a、b推知B溶液中含有的离子为
(2)B的化学式为
您最近一年使用:0次
5 . 短周期元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素。X与W同一主族,Z元素原子半径在短周期中最大(稀有气体除外),W、Z之间与W、Q之间原子序数之差相等,五种元素原子最外层电子数之和为21。下列说法不正确的是
| A.W的氧化物既可以和酸反应又可以和碱反应 |
| B.Y的氢化物与其最高价氧化物对应水化物相遇生成白烟 |
| C.气态氢化物的稳定性:Y>X>W |
| D.Q可分别与X、Y、Z、W形成化学键类型相同的化合物 |
您最近一年使用:0次
名校
6 . 短周期元素A、B、C、D、E、F、G、H、I、J在周期表中的位置如下:

按要求回答下列问题。
(1)上表元素中,形成气态氢化物最稳定的是_______ 元素(填元素符号)。
(2)32Ge与B同族,32Ge的最高价的氧化物与氢氧化钠反应的化学方程式为
_______ 。
(3)等电子的D、F、G、H四种元素形成的离子,离子半径由大到小的顺序是(填离子符号)
________________________________
(4)D、I元素形成的氢化物中,沸点较高的是_______ ,理由_______ 。
(5)34Se非金属性比D_______ (填“强”或“弱”),从原子结构的角度解释其原因为_______ 。
(6)用电子式表示E、G形成化合物的过程_______ 。

按要求回答下列问题。
(1)上表元素中,形成气态氢化物最稳定的是
(2)32Ge与B同族,32Ge的最高价的氧化物与氢氧化钠反应的化学方程式为
(3)等电子的D、F、G、H四种元素形成的离子,离子半径由大到小的顺序是(填离子符号)
(4)D、I元素形成的氢化物中,沸点较高的是
(5)34Se非金属性比D
(6)用电子式表示E、G形成化合物的过程
您最近一年使用:0次
名校
7 . 几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是
元素代号 | X | Y | Z | W | Q |
原子半径/pm | 160 | 143 | 70 | 66 | 102 |
主要化合价 | +2 | +3 | +5、﹣3 | ﹣2 | +6、﹣2 |
| A.X、Y元素的金属性 X<Y |
| B.一定条件下,Z单质与W的常见单质直接生成ZW2 |
| C.Y的最高价氧化物对应的水化物能溶于稀氨水 |
| D.W、Q两元素的气态氢化物的热稳定性 H2W>H2Q |
您最近一年使用:0次
名校
解题方法
8 . 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.将等物质的量的X、Y的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下发生可逆反应。下列说法正确的是
| A.达到化学平衡时,正反应速率与逆反应速率不相等 |
| B.反应过程中,Y的单质的体积分数始终为50% |
| C.达到化学平衡时,X、Y的两种单质在混合气体中的物质的量之比为1:1 |
| D.达到化学平衡的过程中,混合气体平均相对分子质量逐渐减小 |
您最近一年使用:0次
名校
9 . 几种短周期元素的原子半径及主要化合价如下表:
下列说法正确的是
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -3 | -2 | |
| A.离子半径r(R3-)﹥r(X+)﹥r(Z3+) | B.元素X和Q形成的化合物中不可能含有共价键 |
| C.Q2-比R3-更容易失去电子 | D.Y的含氧酸的酸性一定比R的含氧酸的酸性强 |
您最近一年使用:0次
2017-05-17更新
|
780次组卷
|
4卷引用:四川省彭州市五校2016-2017学年高一下学期期中联考化学试题
名校
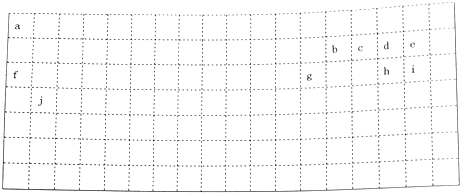
10 . 下表中的实线表示元素周期表的部分边界,a-j分别表示周期表中对应位置的元素。回答下列问题:
(1)请在上表中用实线补全元素周期表边界_______ 。
(2)元素b在元素周期表中的位置是_______ ;元素a与d形成的4核18电子物质的分子式_______ 。
(3)元素e、g、h的简单离子半径由小到大的顺序为______ 。(用离子符号表示)
(4)元素e的气态氢化物比元素i的气态氢化物稳定性______ 。(填“强”或“弱”)。
(5)元素d与f形成的化合物中,原子个数1:1的化合物所含化学键类型为______ 。
(6)用电子式表示元素i、j形成化合物的过程______________________ 。
(1)请在上表中用实线补全元素周期表边界
(2)元素b在元素周期表中的位置是
(3)元素e、g、h的简单离子半径由小到大的顺序为
(4)元素e的气态氢化物比元素i的气态氢化物稳定性
(5)元素d与f形成的化合物中,原子个数1:1的化合物所含化学键类型为
(6)用电子式表示元素i、j形成化合物的过程
您最近一年使用:0次



