名校
1 . 短周期元素X和Y,可组成化合物XY3。当X的原子序数为a时,Y的原子序数可能是:①a+2,②a+4,③a+8,④a+12,⑤a-6,其中正确的组合是
| A.①② | B.①②③ | C.①②③⑤ | D.①②④⑤ |
您最近一年使用:0次
2017-04-14更新
|
679次组卷
|
3卷引用:2016-2017学年四川省成都市九校高一下学期期中联考化学试卷
解题方法
2 . 4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
回答下列问题:
(1)元素x在周期表中的位置是____ ,其单质可采用电解熔融________ 的方法制备。
(2)气体分子(mn)2的电子式为____ ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为____ 。
(3)已知氰化钠(NaCN),可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物Na[Au(CN)2],其反应方程式为:①4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH,Na[Au(CN)2]在水溶液中的电离方程式为:②Na[Au(CN)2]=Na++[Au(CN)2]-,然后再用锌从溶液中把金置换出来,锌转化为Na2[Zn(CN)4]。据此,请利用①写出在空气中用氰化钠溶液提取金的电极反应式:正极:____ ,负极:_____ 。
(4)若人不慎氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为红色。写出解毒原理的相关离子方程式____ 。
| m | n | ||
| x | y |
(1)元素x在周期表中的位置是
(2)气体分子(mn)2的电子式为
(3)已知氰化钠(NaCN),可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物Na[Au(CN)2],其反应方程式为:①4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH,Na[Au(CN)2]在水溶液中的电离方程式为:②Na[Au(CN)2]=Na++[Au(CN)2]-,然后再用锌从溶液中把金置换出来,锌转化为Na2[Zn(CN)4]。据此,请利用①写出在空气中用氰化钠溶液提取金的电极反应式:正极:
(4)若人不慎氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为红色。写出解毒原理的相关离子方程式
您最近一年使用:0次
解题方法
3 . 下表列出了A﹣R 9种元素在周期表中的位置
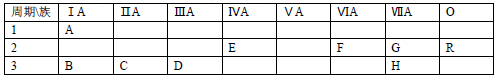
(1)这 9种元素中化学性质最不活泼的是________ (以上均填元素符号)
(2)B、C、D三种元素按原子半径由大到小的顺序排列为________ (用元素符号表示)
(3)F元素简单氢化物的化学式是________ ,H元素跟B元素形成化合物的化学式是______ ,高温灼烧该化合物时,火焰呈________ 色.
(4)G元素和 H元素两者核电荷数之差是________ .

(1)这 9种元素中化学性质最不活泼的是
(2)B、C、D三种元素按原子半径由大到小的顺序排列为
(3)F元素简单氢化物的化学式是
(4)G元素和 H元素两者核电荷数之差是
您最近一年使用:0次
解题方法
4 . R元素的单质4.5g,跟足量的硫酸反应生成R2(SO4)3,并放出5.6L的H2(标准状况下).试求:
(1)R的相对原子质量为_____
(2)若R原子中质子数比中子数少1,则R是(填元素符号)_____ ,它在元素周期表的位置为第_____ 周期第_____ 族.
(1)R的相对原子质量为
(2)若R原子中质子数比中子数少1,则R是(填元素符号)
您最近一年使用:0次
解题方法
5 . 下表为周期表的一部分,其中的编号代表对应的元素.

请回答下列问题:
(1)表中属于d区的元素是_____________ (填编号)。
(2)写出元素⑨的基态原子的电子排布式_____________ ;
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为_____________ 对,其单质的电子式为_____________ ;
(4)元素④的氢化物的分子构型为_____________ ,中心原子的杂化方式为_____________ ;
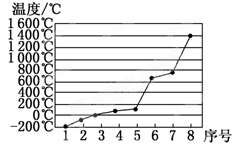
(5)第3周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表_____________ (填元素符号);其中电负性最大的是_____________ (填图中的序号)。

请回答下列问题:
(1)表中属于d区的元素是
(2)写出元素⑨的基态原子的电子排布式
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子为
(4)元素④的氢化物的分子构型为
(5)第3周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表

您最近一年使用:0次
解题方法
6 . 现有10种元素的性质、数据如下表所列,它们均为短周期元素.
回答下列问题:
(1)D的元素名称是_______ ,H的元素符号是_______ ,B在元素周期表中的位置是(周期、族)_______ 。
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是_______ .化合物F2A2的电子式是:_______ ,构成该物质的化学键类型为_______ 。
(3)用电子式表示A的简单氢化物的形成过程如下:_______ ;G的氢化物的结构式为_______ 。
(4)一定条件下,IA2气体与足量的A单质充分反应生成20 g气态化合物,放出24.6 kJ热量,写出其热化学方程式_______ 。
(5)用J元素的单质与A元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入J的单质,乙极通入A的单质,则甲极的电极反应式为:_______ 。
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径(10﹣10m) | 0.74 | 1.60 | 1.52 | 1.10[ | 0.99 | 1.86 | 0.75 | 0.82 | 0.102 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5[ | +7 | +1 | +5 | +3 | +6 | +1 | |
| ﹣2 | ﹣3 | ﹣1 | ﹣3 | ﹣2 |
(1)D的元素名称是
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是
(3)用电子式表示A的简单氢化物的形成过程如下:
(4)一定条件下,IA2气体与足量的A单质充分反应生成20 g气态化合物,放出24.6 kJ热量,写出其热化学方程式
(5)用J元素的单质与A元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入J的单质,乙极通入A的单质,则甲极的电极反应式为:
您最近一年使用:0次
解题方法
7 . 五种短周期元素A、B、C、D、E的原子序数依次增大,其中只有C为金属元素。A和C同主族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是__________ ,非金属性最强的是__________ (填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是__________ (用化学式表示);
(3)D在周期表的位置为__________
(4)A和B形成的化合物与A和E形成的化合物反应,产物的化学式为__________ ,该化合物溶于水,显__________ 性(填“酸”、“碱”、“中”)原因是__________ (用离子方程式表示);
(5)D和E可形成一种所有原子都满足8电子结构的化合物,其化学式为__________ 。
(1)五种元素中,原子半径最大的是
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是
(3)D在周期表的位置为
(4)A和B形成的化合物与A和E形成的化合物反应,产物的化学式为
(5)D和E可形成一种所有原子都满足8电子结构的化合物,其化学式为
您最近一年使用:0次
解题方法
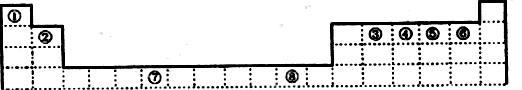
8 . 下表为元素周期表的一部分,其中编号代表对应的元素。
请回答下列问题:
(1)写出元素⑦的基态原子外围电子排布式________________ ,元素⑧位于_______ 区。⑤元素原子的价层电子的电子排布图为_____________________ ;
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中所有杂化原子的杂化方式分别为___________ 和________________ 。
(3)元素③④⑤⑥的第一电离能由大到小的顺序是_________ (用元素符号表示)。请写出由④和⑤两种元素形成的与N3ˉ互为等电子体的分子的化学式________________ ,(写出一种即可)其VSEPR构型为___________ 。
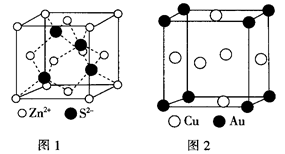
(4)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2-的配位数为___________ 。
(5)铜能与类卤素(SCN)2分子(与氯气分子性质相似)反应生成Cu(SCN)2,1mol(SCN)2分子中含有共价键的数目为______________ 。铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为__________ (用含“a、NA的代数式表示)g/cm3)。

请回答下列问题:
(1)写出元素⑦的基态原子外围电子排布式
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中所有杂化原子的杂化方式分别为
(3)元素③④⑤⑥的第一电离能由大到小的顺序是
(4)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2-的配位数为
(5)铜能与类卤素(SCN)2分子(与氯气分子性质相似)反应生成Cu(SCN)2,1mol(SCN)2分子中含有共价键的数目为

您最近一年使用:0次
11-12高三上·浙江宁波·期中
9 . 下表为部分短周期元素化合价及相应氢化物沸点的数据:
已知:①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙。
请回答:
(1)表中属于第三周期元素的是_________________________ (用表中元素编号填写)。
(2)写出H的最高价氧化物的电子式:__________________________ ;
比较A、D、G三种简单阴离子的半径大小:r( ) >r( ) >r( ) (均用实际的元素符号表示)。
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________________ 。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是:______________________ 。
元素性质 | 元素编号 | |||||||
A | B | C | D | E | F | G | H | |
氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
已知:①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙。
请回答:
(1)表中属于第三周期元素的是
(2)写出H的最高价氧化物的电子式:
比较A、D、G三种简单阴离子的半径大小:r
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是:
您最近一年使用:0次



