1 . 已知第四周期过渡金属元素M,其六氨合M盐与氨化钾溶液在液氨中反应生成棕色非晶态的A[含三种元素,其中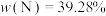 ],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中
],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中 ]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
(1)请计算推断出M______ 、A______ 、B______ ;
(2)写出反应方程式(Ⅰ)______ 、(Ⅱ)______ 。(提示:可以从最简单的情况开始考虑)
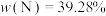 ],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中
],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中 ]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。(1)请计算推断出M
(2)写出反应方程式(Ⅰ)
您最近一年使用:0次
名校
2 . 元素在周期表中的位置,反映了元素的原子结构和性质。如图是元素周期表的一部分,请按照要求回答下列问题:
(1)①的元素符号是______ ,元素②位于周期表中的第______ 周期第______ 族。
(2)②、③两种元素中,非金属性较强的是______ (填元素符号)
(3)①、②、④三种元素中,原子半径最大的是______ (填元素符号)。
(4)④、⑤两种元素中最高价氧化物对应的水化物,属于两性氢氧化物的是______ (填化学式)。
(5)常温下,将元素⑥的单质通入 溶液中可制得漂白液,其有效成分是
溶液中可制得漂白液,其有效成分是 ,请写出该反应的离子方程式
,请写出该反应的离子方程式______
| 族 周期 | IA | 0 | ||||||
| 1 | IIA | IIIA | IVA | VA | VIA | VIIA | ||
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | |||||
(2)②、③两种元素中,非金属性较强的是
(3)①、②、④三种元素中,原子半径最大的是
(4)④、⑤两种元素中最高价氧化物对应的水化物,属于两性氢氧化物的是
(5)常温下,将元素⑥的单质通入
 溶液中可制得漂白液,其有效成分是
溶液中可制得漂白液,其有效成分是 ,请写出该反应的离子方程式
,请写出该反应的离子方程式
您最近一年使用:0次
2023-06-08更新
|
164次组卷
|
2卷引用:云南省普通高中2021-2022学年高一下学期期末学业水平考试化学试题
2021高一·全国·专题练习
解题方法
3 . 定义:按照元素在周期表中的___________ 给元素编号,得到原子序数。
您最近一年使用:0次
解题方法
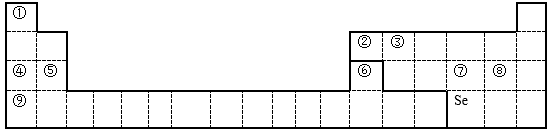
4 . 硒是人体必需的微量元素,有无机硒和有机硒之分。
(1)硒与硫在元素周期表中的相对位置如图所示,硒在元素周期表中的位置是_______ ;硒化氢的电子式为_______ 。
(2)二硫化硒(SeS2)具有抗真菌、抗皮脂溢出作用,常用作洗发香波中的去屑剂。SeS2中硫化素的化合价为负价,请从原子结构角度解释原因:_______ 。
(3)硒与硫相似,可形成多种盐。写出含不同价态硒元素的钠盐的化学式_______ (至少两种)。
(4)一种有机硒化合物的结构简式为: ,其分子式为
,其分子式为_______ ,其分子间脱水时形成的官能团的名称是_______ 。
(5)工业上提取硒的过程如下:
第一步(未配平):X+Se+H2SO4→Na2SO4+H2SeO3+ClO2↑+H2O
已知该反应中氧化产物与还原产物的物质的量之比为1:4,则X的化学式为_______ 。
第二步:向H2SeO3溶液中通入SO2,可析出固体Se,则反应化学方程式为_______ 。
| S |
| Se |
(1)硒与硫在元素周期表中的相对位置如图所示,硒在元素周期表中的位置是
(2)二硫化硒(SeS2)具有抗真菌、抗皮脂溢出作用,常用作洗发香波中的去屑剂。SeS2中硫化素的化合价为负价,请从原子结构角度解释原因:
(3)硒与硫相似,可形成多种盐。写出含不同价态硒元素的钠盐的化学式
(4)一种有机硒化合物的结构简式为:
 ,其分子式为
,其分子式为(5)工业上提取硒的过程如下:
第一步(未配平):X+Se+H2SO4→Na2SO4+H2SeO3+ClO2↑+H2O
已知该反应中氧化产物与还原产物的物质的量之比为1:4,则X的化学式为
第二步:向H2SeO3溶液中通入SO2,可析出固体Se,则反应化学方程式为
您最近一年使用:0次
名校
解题方法
5 . 下表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白。
(1)在这些元素中,化学性质最不活泼的元素的原子结构示意图为___ 。
(2)④与⑤两种元素相比较,原子半径较大的是___ (填元素符号);在非金属元素的最高价氧化物所对应的水化物中,酸性最强的化合物是___ (填化学式)。在金属元素氧化物所对应的水化物中,碱性最强的化合物是___ (填化学式),具有两性的化合物是___ (填化学式)。
(3)④,⑤,⑥,⑦四种元素形成的简单离子,半径由大到小的顺序为___ (填化学式)。
(4)元素①和元素⑦形成化合物属于___ 化合物(填“离子”或者“共价”)。请用电子式表示⑥和④组成化合物的形成过程:________ 。
(5)由②和氢元素形成的两种多原子分子,A为10电子结构B为18电子结构,B可由A与次氯酸钠反应制得,该反应的离子方程式为:______________ 。
| 主族\周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | O |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)④与⑤两种元素相比较,原子半径较大的是
(3)④,⑤,⑥,⑦四种元素形成的简单离子,半径由大到小的顺序为
(4)元素①和元素⑦形成化合物属于
(5)由②和氢元素形成的两种多原子分子,A为10电子结构B为18电子结构,B可由A与次氯酸钠反应制得,该反应的离子方程式为:
您最近一年使用:0次
6 . 下图为元素周期表的一部分,请参照①~⑨在表中的位置,回答下列问题:
(1)②的元素符号是__________ ,⑥在周期表中的位置是___________ 。
(2)⑦、⑧两元素比较,非金属性强的是(填元素符号)_______ ,从原子结构角度解释原因_________ 。
(3)④-⑥这三种元素中,写出最高价氧化物对应水化物两两之间能反应的离子方程式____________________ 。
(4)写出工业冶炼元素⑤单质的化学方程式_________ ,不选择热还原法冶炼这种活泼金属的原因是___________________ 。
(5)元素①和③可以组成很多种物质,写出其中原子个数比为1:4的物质的电子式______ ,请从化学键角度解释该物质中原子个数比为1:4的原因________________ 。
(6)已知Se在周期表中的位置如图所示,请画出Se的原子结构示意图________ 。
请任意写出三种Se物质的化学式,预测其性质(一条即可),并说明预测依据,完成在下列表格中。________

(1)②的元素符号是
(2)⑦、⑧两元素比较,非金属性强的是(填元素符号)
(3)④-⑥这三种元素中,写出最高价氧化物对应水化物两两之间能反应的离子方程式
(4)写出工业冶炼元素⑤单质的化学方程式
(5)元素①和③可以组成很多种物质,写出其中原子个数比为1:4的物质的电子式
(6)已知Se在周期表中的位置如图所示,请画出Se的原子结构示意图
请任意写出三种Se物质的化学式,预测其性质(一条即可),并说明预测依据,完成在下列表格中。
| 含Se物质化学式 | 性质 | 预测依据 |
您最近一年使用:0次
解题方法
7 . 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于_____ 晶体;Ni元素在元素周期表中的位置是第________ 周期,第________ 族;镍有54Ni和58 Ni两种原子,它们互称为__________ 。
(2)如图所示配合物分子内的作用力有________ (填编号)。
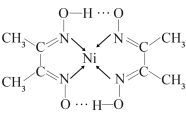
E.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③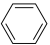 、④HCHO等,其中分子属于平面结构的有
、④HCHO等,其中分子属于平面结构的有______ (填物质序号),预测HCHO分子的立体结构为______ 形。
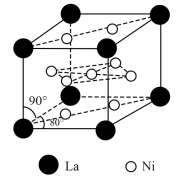
(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为______ 。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于
(2)如图所示配合物分子内的作用力有

| A.氢键 |
| B.离子键 |
| C.共价键 |
| D.金属键 |
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③
 、④HCHO等,其中分子属于平面结构的有
、④HCHO等,其中分子属于平面结构的有(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为

您最近一年使用:0次
9-10高一下·广东佛山·期末
解题方法
8 . 填写下列空白:
(1)表示含有17个质子、20个中子的原子的化学符号是___________________ 。
(2)第三周期0族元素的原子结构示意图为_______________ 。
(3)周期表中被称为第Ⅷ族的元素位于第_____________________ 纵行。
(4)周期表中最活泼的非金属元素位于第__________ 周期、第_________ 族。
(5)所含元素超过18种的周期是第__________ 、_________ 周期。
(1)表示含有17个质子、20个中子的原子的化学符号是
(2)第三周期0族元素的原子结构示意图为
(3)周期表中被称为第Ⅷ族的元素位于第
(4)周期表中最活泼的非金属元素位于第
(5)所含元素超过18种的周期是第
您最近一年使用:0次



