名校
1 . 1869年俄国科学家门捷列夫绘制出了第一张元素周期表,成为化学史上的里程碑之一,且大大地促进了化学学科的快速发展。下表是现代元素周期表的一部分,请据表回答下列问题:___________ ,金属性最强的元素是___________ (填元素符号)。
(2)①②⑤三种元素原子半径由大到小的顺序为___________ (填序号)。
(3)元素⑦的单质的一种用途是___________ (填写“制造玻璃”或“制造计算机芯片”)。
(4)元素⑧⑨⑩最高价氧化物的水化物中酸性最强的是___________ (填化学式)。
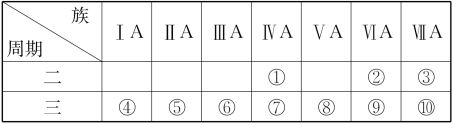
(2)①②⑤三种元素原子半径由大到小的顺序为
(3)元素⑦的单质的一种用途是
(4)元素⑧⑨⑩最高价氧化物的水化物中酸性最强的是
您最近一年使用:0次
2024-02-24更新
|
235次组卷
|
6卷引用:湖南省长沙市长郡中学2020-2021学年高一下学期期中考试化学试题
名校
2 . 下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
(1)元素①的原子结构示意图是______ 。
(2)从元素原子得失电子的角度看,元素⑤具有_______ (填“氧化性”或“还原性”)。
(3)元素②形成的单质气体含有_______ (填“极性”或“非极性”)共价键。
(4)元素③,⑨与H原子以原子个数比为1:1:1形成的化合物的电子式为______ 。
(5)第三周期中元素的最高价氧化物对应水化物中碱性最强的是_______ (填化学式,下同),最高价氧化物对应的水化物具有两性的物质是_______ ,这两种物质反应的离子方程式为_______ 。
(6)元素③,⑤,⑨形成简单离子的半径由大到小的顺序是______ (填离子符号)。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)从元素原子得失电子的角度看,元素⑤具有
(3)元素②形成的单质气体含有
(4)元素③,⑨与H原子以原子个数比为1:1:1形成的化合物的电子式为
(5)第三周期中元素的最高价氧化物对应水化物中碱性最强的是
(6)元素③,⑤,⑨形成简单离子的半径由大到小的顺序是
您最近一年使用:0次
3 . 元素周期表是元素周期律的具体表现形式,是学习和研究化学的重要工具,下图是元素周期表的一部分。

(1)氧元素在周期表中的位置是第_______ 周期_______ 族,氧原子的电子式为_______ 。
(2)某元素的结构示意图为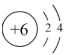 ,请在上图相应位置填入该元素的元素符号
,请在上图相应位置填入该元素的元素符号_______ 。
(3)元素性质呈现周期性变化的根本原因是_______。

(1)氧元素在周期表中的位置是第
(2)某元素的结构示意图为
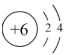 ,请在上图相应位置填入该元素的元素符号
,请在上图相应位置填入该元素的元素符号(3)元素性质呈现周期性变化的根本原因是_______。
| A.元素相对原子质量的递增 |
| B.元素原子半径呈现周期性变化 |
| C.元素原子核外电子排布呈现周期性变化 |
| D.元素金属性和非金属性呈现周期性变化 |
您最近一年使用:0次
解题方法
4 . 下表列出了9种元素在元素周期表中的位置示意图。
(1)考古工作者利用元素②的一种核素测定一些文物的年代,这种核素的符号是_______________ 。
(2)画出元素⑧形成的简单离子的结构示意图_______________ 。
(3)写出元素④和⑥的单质在加热条件下反应,所得产物的电子式为_______________ 。
(4)⑥元素的最高价氧化物对应的水化物含有的化学键是_______________ 。
(5)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最强的是______________ (填化学式),写出元素⑤的单质与水反应的化学方程式_______________ ,写出一个能证明元素⑧比元素⑨非金属性强的反应事实的离子方程式_______________ 。
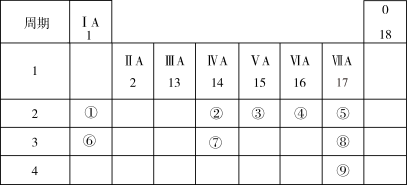
(1)考古工作者利用元素②的一种核素测定一些文物的年代,这种核素的符号是
(2)画出元素⑧形成的简单离子的结构示意图
(3)写出元素④和⑥的单质在加热条件下反应,所得产物的电子式为
(4)⑥元素的最高价氧化物对应的水化物含有的化学键是
(5)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最强的是
您最近一年使用:0次
2024-01-07更新
|
306次组卷
|
2卷引用:内蒙古自治区赤峰市2020-2021学年高一下学期期末联考化学试题
5 . Al在周期表中的位置是________ 。基态C原子核外最外层电子的轨道表示式是______ ,Zn是第30号元素,则基态Zn的价层电子排布式是________ 。
您最近一年使用:0次
名校
6 . 肼(N2H4)是重要的化工原料,能与水、乙醇等混溶;它是一种二元弱碱,在水中的电离方式与氨相似,室温下电离常数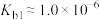 ;在碱性溶液中,N2H4是强还原剂。
;在碱性溶液中,N2H4是强还原剂。
(1)写出N元素在元素周期表中的位置___________ 。
(2)写出N2H4与过量硫酸反应形成的酸式盐的化学式___________ 。
(3)N2H4可通过NH3和NaClO反应制得,总反应主要分为两步,
已知第一步: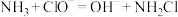
①写出第二步反应的离子方程式___________ 。
②请设计实验,检验总反应中产物的主要阴离子(假设反应物完全反应)___________ 。
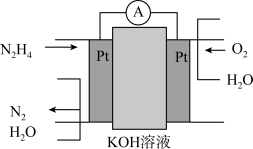
(4)N2H4是一种高能燃料,可用于燃料电池,原理如图,电池的负极反应式为___________ 。
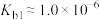 ;在碱性溶液中,N2H4是强还原剂。
;在碱性溶液中,N2H4是强还原剂。(1)写出N元素在元素周期表中的位置
(2)写出N2H4与过量硫酸反应形成的酸式盐的化学式
(3)N2H4可通过NH3和NaClO反应制得,总反应主要分为两步,
已知第一步:
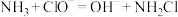
①写出第二步反应的离子方程式
②请设计实验,检验总反应中产物的主要阴离子(假设反应物完全反应)
(4)N2H4是一种高能燃料,可用于燃料电池,原理如图,电池的负极反应式为
您最近一年使用:0次
2023-12-23更新
|
135次组卷
|
2卷引用:浙江省舟山中学2023-2024学年高二上学期11月期中考试化学试题
7 . 人体必需的一些元素在周期表中的分布情况如下:

(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是___________ 。H2O2是一种绿色氧化剂,电子式为___________ 。
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为___________ 。
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是___________ ,原子序数为___________ 。
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为___________ 。
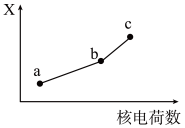
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是___________(填字母)。

(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是___________(填字母)。

| A.若a、b、c表示氧族元素,则X表示对应氢化物的稳定性 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示第IA族元素,则X表示对应离子的氧化性 |
| D.若a、b、c表示第IIA族元素,则X表示最高价氧化物对应水化物的碱性 |
您最近一年使用:0次
2023-12-05更新
|
275次组卷
|
3卷引用:湖北省宜城市第一中学等六校2023-2024学年高二上学期期中考试化学试题
解题方法
8 . NaOH被大量用于制皂、造纸和纺织品生产。回答下列问题。
(1)H元素位于元素周期表的第________ 周期第IA族。
(2)Na元素位于第IA族H元素下方,Na的原子半径比H的______ (填“大”或“小”)。
(3)NaOH所含的两种非金属元素中,非金属性较强的是_______ (填“H”或“O”)。
(1)H元素位于元素周期表的第
(2)Na元素位于第IA族H元素下方,Na的原子半径比H的
(3)NaOH所含的两种非金属元素中,非金属性较强的是
您最近一年使用:0次
2023-09-23更新
|
194次组卷
|
3卷引用:黑龙江省七台河市第六中学2022-2023学年高一上学期期末考试化学试题
黑龙江省七台河市第六中学2022-2023学年高一上学期期末考试化学试题(已下线)【精品卷】4.2.2 元素周期表和元素周期律的应用课堂例题-人教版2023-2024学年必修第一册4.2.1 元素性质的周期性变化规律(基础)
9 . 元素周期表中周期与族的划分与原子结构的哪部分有关_____ ?
您最近一年使用:0次
10 . 每一周期都是从活泼金属开始以惰性气体结束吗_____ ?
您最近一年使用:0次



