解题方法
1 . 已知钛元素是22号元素。
(1)钛元素位于第___________ 周期,有___________ 个电子层。
(2)如果原子轨道上都排满电子,前三个电子层最多容纳的电子数分别为___________ 、___________ 、___________ 。如果前两个电子层排满,可以判断第三层电子___________ (填“排满”或“没排满”)
(1)钛元素位于第
(2)如果原子轨道上都排满电子,前三个电子层最多容纳的电子数分别为
您最近一年使用:0次
名校
2 . 德米特里·伊万诺维奇·门捷列夫是著名的俄国化学家,他对化学的发展作出了卓越的贡献。请回答下列问题:
(1)门捷列夫的突出贡献是________
(2)某元素的原子L层电子数比K层电子数多3个,与该元素同一主族的短周期元素是___________ 。
(3)C、O、Na的原子半径从大到小的顺序为___________ 。
(4)请你根据原子结构示意图,分别指出这些原子所含的质子数、元素周期表中的位置。___________ ,周期表中位置:___________ 。
(5)请将短周期元素或其化合物填入下列表格
①金属性最强的元素是___________ (填元素符号);
②形成化合物种类最多的元素是___________ (填元素符号);
③第三周期中,简单气态氢化物热稳定性最好的是___________ (填写分子式)。
(1)门捷列夫的突出贡献是________
| A.提出原子学说 | B.发现元素周期律 |
| C.提出分子学说 | D.发现氧气 |
(3)C、O、Na的原子半径从大到小的顺序为
(4)请你根据原子结构示意图,分别指出这些原子所含的质子数、元素周期表中的位置。

(5)请将短周期元素或其化合物填入下列表格
①金属性最强的元素是
②形成化合物种类最多的元素是
③第三周期中,简单气态氢化物热稳定性最好的是
您最近一年使用:0次
名校
3 . 某种牛奶的营养成分表如下所示(NRV%是指每100g食品中营养素的含量占该营养素每日摄入量的比例)。
回答下列问题。
(1)成分表中含有的元素有Na、Ca、H、C、N、O,其中位于同周期的元素是___________ (填元素名称)。
(2)Na在元素周期表中的位置是___________ ,它与氧元素形成的常见化合物中含有非极性共价键,其电子式为___________ 。
(3)比较下列物质的性质,用“>”或“<”填空。
①半径:r(Na+)___________ r(O2-);②沸点:NH3___________ CH4
(4)设计实验证明Ca、Mg都能与水反应,且比较它们与水反应的难易程度。
(限选试剂与仪器:烧杯、小试管、胶头滴管、酚酞、蒸馏水、钙、镁条、砂纸)
| 营养成分表 | ||
| 项目 | 每100g | NRV% |
| 能量 | 309kJ | 4% |
| 蛋白质 | 3.6g | 4% |
| 脂肪 | 4.4g | 7% |
| 碳水化合物 | 5.0g | 2% |
| 钠 | 65mg | 3% |
| 钙 | 120mg | 15% |
(1)成分表中含有的元素有Na、Ca、H、C、N、O,其中位于同周期的元素是
(2)Na在元素周期表中的位置是
(3)比较下列物质的性质,用“>”或“<”填空。
①半径:r(Na+)
(4)设计实验证明Ca、Mg都能与水反应,且比较它们与水反应的难易程度。
(限选试剂与仪器:烧杯、小试管、胶头滴管、酚酞、蒸馏水、钙、镁条、砂纸)
| Ca | Mg | |
| 操作 | 取绿豆大小的一块钙投入盛有水的 | 将打磨后的镁条投入盛有冷水的试管中。 |
| 现象 | 钙先沉入水中,表面产生大量气体,一段时间后上浮,溶液变浑浊。 | 一段时间后,镁条表面有细小气泡产生。 |
| 描述或推测 | ①钙密度比水大; ②溶液中产生的沉淀主要是 | 由细小气泡猜测Mg可能与水发生反应,还需要补充的实验操作及现象是 |
| 结论 | 钙能与水反应生成沉淀和氢气,且反应剧烈。 | 镁能与水缓慢反应,化学方程式为 |
您最近一年使用:0次
2023-07-07更新
|
152次组卷
|
2卷引用:四川省成都市2022-2023学年高二下学期期末零诊测试化学试卷
4 . 元素周期律是对元素性质的规律性总结,元素周期表是这种规律的呈现形式。利用元素周期律可以推测一些未知元素可能的性质。根据你所学的周期律,回答下列问题:
(1)元素周期表有几个周期,几个主族。正确选项是
(2)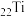 被誉为21世纪明星金属,其最外层电子数为___________(填序号)。
被誉为21世纪明星金属,其最外层电子数为___________(填序号)。
(3)元素周期表中,第三电子层有一个未成对电子的元素有___________种(填序号)。
(1)元素周期表有几个周期,几个主族。正确选项是
| A.6,7 | B.7,7 | C.7,18 | D.7,14 |
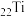 被誉为21世纪明星金属,其最外层电子数为___________(填序号)。
被誉为21世纪明星金属,其最外层电子数为___________(填序号)。| A.1个 | B.2个 | C.3个 | D.5个 |
| A.2 | B.3 | C.4 | D.5 |
您最近一年使用:0次
5 . 分析下列图表,回答问题。
(1)N、Al、Si、Ge四种元素中,某种元素的电离能数据如下:
则该元素是_______ (填写元素符号)。
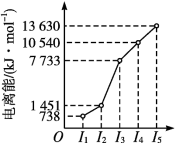
(2)短周期某主族元素M的电离能情况如图所示。则M元素位于周期表的第_______ 族。
(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
锰元素位于第四周期第ⅦB族。请写出基态Mn2+的价层电子排布式:_______ ,比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是_______ 。
(1)N、Al、Si、Ge四种元素中,某种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | …… |
| In/( kJ∙mol−1) | 578 | 1 817 | 2 745 | 11 575 | …… |
(2)短周期某主族元素M的电离能情况如图所示。则M元素位于周期表的第

(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
| 元素 | Mn | Fe | |
| I1 | 717 | 759 | |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
您最近一年使用:0次
6 . 合成氨是人类科学技术发展史上的一项重大成就,是化学和技术对社会发展与进步的巨大贡献。
(1)基态氮原子中,能量最高的电子的电子云在空间有_______ 个伸展方向。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“ ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为_______ 。
(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有 、
、 、CaO、MgO、
、CaO、MgO、 等氧化物中的几种。
等氧化物中的几种。
①Cr原子的价电子排布图为_______ ;第四周期ds区元素中,与基态Cr原子最外层电子数目相同的元素的元素符号为_______ 。
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有_______ (填元素符号)
(4)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨工业的温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①Mn在元素周期表中的位置_______ ,基态Mn原子未成对的电子数为_______ 。
②第三电离能
_______ 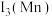 (填“>”或“<”),原因是
(填“>”或“<”),原因是_______ 。
(1)基态氮原子中,能量最高的电子的电子云在空间有
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“
 ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为
”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子数的代数和为(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有
 、
、 、CaO、MgO、
、CaO、MgO、 等氧化物中的几种。
等氧化物中的几种。①Cr原子的价电子排布图为
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有
(4)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨工业的温度,压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①Mn在元素周期表中的位置
②第三电离能

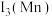 (填“>”或“<”),原因是
(填“>”或“<”),原因是
您最近一年使用:0次
2023-02-14更新
|
670次组卷
|
3卷引用:山东省泰安市2022-2023学年高二上学期期末考试化学试题
名校
7 . 下表列出9种元素在元素周期表(元素周期表只给出部分)中的位置
请回答下列问题:
(1)考古工作者利用某元素的一种核素测定一些文物的年代,这种核素的元素符号是_______ 。
(2)写出由元素②和元素④形成原子个数比为1∶2的化合物的电子式:_______ 。
(3)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式为_______
(4)③、④、⑤三种元素的简单氢化物稳定性顺序是_______ (填化学式;用“>”连接)。
(5)表中的ⅠA族、ⅡA族元素全部是金属元素,这种判断_______ (填“正确”或“错误”);根据元素周期律,自然界中最强的碱是_______ (填化学式)。
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | |||||
| 4 | ⑨ |
(1)考古工作者利用某元素的一种核素测定一些文物的年代,这种核素的元素符号是
(2)写出由元素②和元素④形成原子个数比为1∶2的化合物的电子式:
(3)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式为
(4)③、④、⑤三种元素的简单氢化物稳定性顺序是
(5)表中的ⅠA族、ⅡA族元素全部是金属元素,这种判断
您最近一年使用:0次
2023-01-16更新
|
427次组卷
|
4卷引用:山东省莘县多校2022-2023学年高一上学期期末线上联考化学试题
山东省莘县多校2022-2023学年高一上学期期末线上联考化学试题(已下线)【知识图鉴】单元讲练测必修第一册第四单元03巩固练安徽省六安市金寨县青山中学2023-2024学年高一下学期第一次月考化学试题江西省宜春市万载县万载二中 2023?2024 学年高一上学期期末模拟考试化学试卷
8 . 下表列出了①~④四种元素在周期表中的位置.
回答下列问题:
(1)①的元素符号为_____________ 。
(2)②的基态原子电子排布式为__________________________ 。
(3)③和④中原子半径较大的是_____________ (填元素符号)。
(4)如图是③原子中s电子和p电子的电子云轮廓图。s电子的电子云形状为_____________ 形;每个p能级都有_____________ 个相互垂直的电子云。

| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | |||||||
| 3 | ② | ③ | ||||||
| 4 | ④ |
回答下列问题:
(1)①的元素符号为
(2)②的基态原子电子排布式为
(3)③和④中原子半径较大的是
(4)如图是③原子中s电子和p电子的电子云轮廓图。s电子的电子云形状为

您最近一年使用:0次
21-22高二下·全国·单元测试
解题方法
9 . 元素周期表:_______ 的表格,元素周期系只有一个,元素周期表多种多样。
您最近一年使用:0次
10 . 三张有重要历史意义的周期表
(1)门捷列夫周期表:门捷列夫周期表又称_______ 周期表,重要特征是从第_______ 周期开始每个周期截成_______ 截,第_______ 族分_______ 族,第_______ 族称为过渡元素。
(2)维尔纳周期表
维尔纳周期表是_______ ,每个周期一行,各族元素、过渡金属、稀有气体、镧系和锕系,各有各的位置,同族元素_______ ,它确定了前_______ 个周期的元素种类。
(3)玻尔元素周期表
玻尔元素周期表特别重要之处是把21~28、39~46等元素用_______ 框起,这说明他已经认识到,这些框内元素的原子新增加的_______ 是填入_______ 的,他已经用原子结构解释元素周期系了,玻尔元素周期表确定了第_______ 周期为_______ 种元素。
(1)门捷列夫周期表:门捷列夫周期表又称
(2)维尔纳周期表
维尔纳周期表是
(3)玻尔元素周期表
玻尔元素周期表特别重要之处是把21~28、39~46等元素用
您最近一年使用:0次



