名校
解题方法
1 . 下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
(1)元素②的原子结构示意图是___________ ,形成化合物种类最多的元素是___________ 。(填元素符号)
(2)元素⑨在周期表中所处位置___________ ,从元素原子得失电子的角度看,元素⑨具有___________ (填“氧化性”或“还原性”)。
(3)元素③与元素⑤形成原子个数比为1:1的化合物的电子式为___________ ,该化合物中存在的化学键类型有___________ 、___________ 。
(4)第三周期元素除⑩外原子半径最大的是___________ (填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是___________ (填化学式,下同),具有两性的是___________ ,这两种物质反应的离子方程式为___________ 。
(5)元素④、⑤、⑥形成简单离子的半径由大到小的顺序是___________ 。(填离子符号)
 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)元素⑨在周期表中所处位置
(3)元素③与元素⑤形成原子个数比为1:1的化合物的电子式为
(4)第三周期元素除⑩外原子半径最大的是
(5)元素④、⑤、⑥形成简单离子的半径由大到小的顺序是
您最近一年使用:0次
2 . 下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区元素的是___________ (填元素符号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为___________ ;③和⑦形成的一种常见溶剂的化学式为___________ 。
(3)元素④的第一电离能___________ 元素⑤(选填“>”、“=”或“<”)的第一电离能;元素⑥的电负性___________ 元素⑦(选填“>”、“=”或“<”)的电负性。
(4)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:___________

请回答下列问题:
(1)表中属于d区元素的是
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为
(3)元素④的第一电离能
(4)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:
您最近一年使用:0次
名校
解题方法
3 . 下表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①___________ ,⑦___________ 。
(2)画出原子的结构示意图:④___________ ,⑧___________ 。
(3)在①—⑫元素中,金属性最强的元素是___________ ,非金属性最强的元素是___________ ,最不活泼的元素是___________ 。(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是___________ (用元素符号表示),下列表述中能证明这一事实的是___________ 。
a.常温下⑦的单质和⑧的单质状态不同 b.⑧的氢化物比⑦的氢化物稳定 c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是___________ (填序号),跟它同周期原子半径最小的元素是___________ (填序号),它们可以形成 ___________ (填“离子”或“共价”)化合物,用电子式表示其形成过程如下:___________ 。
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,它可与⑧形成一种AB4型化合物,请写出该化合物的电子式:___________ 。
 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)画出原子的结构示意图:④
(3)在①—⑫元素中,金属性最强的元素是
(4)元素⑦与元素⑧相比,非金属性较强的是
a.常温下⑦的单质和⑧的单质状态不同 b.⑧的氢化物比⑦的氢化物稳定 c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,它可与⑧形成一种AB4型化合物,请写出该化合物的电子式:
您最近一年使用:0次
4 . 如图1是元素周期表的一部分。回答下列问题:
(1)硒是人体必需的微量元素。
①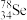 与
与 互称为
互称为_______ 。
②硒元素的气态氢化物的化学式为_______ 。
(2)溴被称为海洋元素。
①溴元素在周期表中的位置为_______ 。
②表中与溴同主族的元素中,最高价氧化物对应的水化物酸性最强的是_______ (填化学式)。
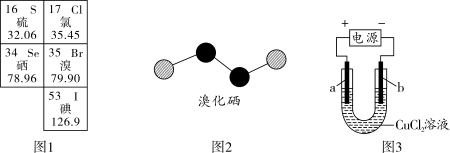
③溴化硒是一种重要的电子元件材料,其分子的球棍模型如图2所示。下列说法正确的是_______ (填字母)。
a.溴化硒属于离子化合物 b.原子半径:r(Se)>r(Br)
c.Se元素的非金属性比Br的强 d.溴化硒的相对分子质量为317.72
(3)氯是卤族元素之一,电解氯化铜溶液可以得到Cl2,实验装置如图3所示。(已知a、b均为石墨电极)
①分别用湿润的淀粉碘化钾试纸置于a、b上方,可观察到的现象是_______ 。
②a电极上的电极反应式为_______ 。
(4)下列事实不能说明氯的非金属性比硫强的是_______ (填字母)。
a.化合物SCl2中硫显正价而氯显负价
b.热稳定性:HCl>H2S
c.将氯气通入Na2S溶液中,有淡黄色沉淀生成
d.次氯酸的氧化性比稀硫酸的氧化性强

(1)硒是人体必需的微量元素。
①
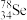 与
与 互称为
互称为②硒元素的气态氢化物的化学式为
(2)溴被称为海洋元素。
①溴元素在周期表中的位置为
②表中与溴同主族的元素中,最高价氧化物对应的水化物酸性最强的是
③溴化硒是一种重要的电子元件材料,其分子的球棍模型如图2所示。下列说法正确的是
a.溴化硒属于离子化合物 b.原子半径:r(Se)>r(Br)
c.Se元素的非金属性比Br的强 d.溴化硒的相对分子质量为317.72
(3)氯是卤族元素之一,电解氯化铜溶液可以得到Cl2,实验装置如图3所示。(已知a、b均为石墨电极)
①分别用湿润的淀粉碘化钾试纸置于a、b上方,可观察到的现象是
②a电极上的电极反应式为
(4)下列事实不能说明氯的非金属性比硫强的是
a.化合物SCl2中硫显正价而氯显负价
b.热稳定性:HCl>H2S
c.将氯气通入Na2S溶液中,有淡黄色沉淀生成
d.次氯酸的氧化性比稀硫酸的氧化性强
您最近一年使用:0次
2021高三·全国·专题练习
5 . (NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵)是一种重要的化工原料,用途广泛。完成下列填空:
(1)铁在元素周期表的第ⅦB和第ⅠB之间。铁位于第___ 周期___ 族。
(2)写出Fe与水反应的化学方程式:___ 。
(3)将(NH4)2Fe(SO4)2中非金属元素的简单阴离子按半径由小到大的顺序排列:___ 。
(4)同温度同浓度的FeSO4和(NH4)2Fe(SO4)2溶液中,c(Fe2+)是否相等___ ?为什么?___ 。
(5)设计实验,证明(NH4)2Fe(SO4)2·6H2O晶体中含有Fe2+___ 。
(6)已知:(NH4)2Fe(SO4)2·6H2O在200℃失去全部结晶水。将一定质量的粉末状该晶体置于坩埚中,保持200℃受热,经冷却、恒重等正确操作,计算得到的1mol晶体中结晶水含量总是偏低,偏低的可能原因是___ (写一条即可)。
(1)铁在元素周期表的第ⅦB和第ⅠB之间。铁位于第
(2)写出Fe与水反应的化学方程式:
(3)将(NH4)2Fe(SO4)2中非金属元素的简单阴离子按半径由小到大的顺序排列:
(4)同温度同浓度的FeSO4和(NH4)2Fe(SO4)2溶液中,c(Fe2+)是否相等
(5)设计实验,证明(NH4)2Fe(SO4)2·6H2O晶体中含有Fe2+
(6)已知:(NH4)2Fe(SO4)2·6H2O在200℃失去全部结晶水。将一定质量的粉末状该晶体置于坩埚中,保持200℃受热,经冷却、恒重等正确操作,计算得到的1mol晶体中结晶水含量总是偏低,偏低的可能原因是
您最近一年使用:0次
6 . 根据题给信息回答问题
(1)某元素原子的价电子构型为4s24p1,它属于第___________ 周期第___________ 族,属于___________ 区元素。
(2)在1~18号元素中,除稀有气体元素外,原子半径最大的元素是___________ (用元素符号表示,下同),电负性最大的元素是___________ ;第一电离能最大的元素是___________ 。第三周期原子半径最小的主族元素的价电子排布式为___________ 。
(3)写出Cu+的核外电子排布式:___________ 。按电子排布,可将周期表中的元素划分成五个区域,第四周期元素中属于s区的元素有___________ 种,
(4)某元素原子的3p轨道有1个未成对电子,该元素为___________ (用元素符号表示)。
(1)某元素原子的价电子构型为4s24p1,它属于第
(2)在1~18号元素中,除稀有气体元素外,原子半径最大的元素是
(3)写出Cu+的核外电子排布式:
(4)某元素原子的3p轨道有1个未成对电子,该元素为
您最近一年使用:0次
2021-07-20更新
|
499次组卷
|
5卷引用:吉林省通化县综合高级中学2020-2021学年高二下学期期末考试化学试题
吉林省通化县综合高级中学2020-2021学年高二下学期期末考试化学试题(已下线)第一章 原子结构与性质 章节过关检测-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)黑龙江省齐齐哈尔市第八中学2021-2022学年高二下学期开学考试化学试题广西钦州市第四中学2022-2023学年高二下学期2月考试化学试题(已下线)专题01 物质的结构与性质-备战2023-2024学年高二化学下学期期末真题分类汇编(辽宁、黑龙江、吉林专用)
7 . 根据下表回答问题:
(1)甲元素最高价氧化物对应的水化物呈___________ 性(填“酸、碱”),乙元素最高价氧化物对应的水化物的化学式为___________ 。
(2)比较这甲、乙、丁三种元素的原子半径大小:___________ (填元素符号)。
(3)丙在周期表的位置为___________ 。
(4)甲元素最高价氧化物对应水化物与丁元素最高价氧化物反应的化学方程式为___________ 。
| 元素 | 甲 | 乙 | 丙 | 丁 |
| 元素符号 | ① | Cl | O | Al |
原子结构示意图 | 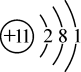 | 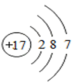 | 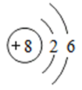 | 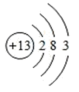 |
| 周期 | 三 | 三 | 二 | 三 |
| 族 | ⅠA | ⅦA | ③ | ⅢA |
(1)甲元素最高价氧化物对应的水化物呈
(2)比较这甲、乙、丁三种元素的原子半径大小:
(3)丙在周期表的位置为
(4)甲元素最高价氧化物对应水化物与丁元素最高价氧化物反应的化学方程式为
您最近一年使用:0次
8 . 下表是元素周期表的一部分。请按要求回答下列有关问题:
(1)元素⑨单质形成的晶体的晶体类型是___________ 。
(2)在这些主族元素中,原子半径最大的是___________ 。(填元素符号)
(3)最高价氧化物对应水化物酸性最强物质的化学式是___________ 。
(4)最高价氧化物对应的水化物中,碱性最强的物质与呈两性的氢氧化物反应的离子反应方程式为___________ 。
(5)证明⑧与⑫的单质活泼性强弱的离子方程式为___________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 四 | ⑩ | ⑪ | ⑫ |
(2)在这些主族元素中,原子半径最大的是
(3)最高价氧化物对应水化物酸性最强物质的化学式是
(4)最高价氧化物对应的水化物中,碱性最强的物质与呈两性的氢氧化物反应的离子反应方程式为
(5)证明⑧与⑫的单质活泼性强弱的离子方程式为
您最近一年使用:0次
2021-07-17更新
|
442次组卷
|
3卷引用:江苏省常州市武进区横山桥高级中学2020-2021学年高一下学期期中考试化学试题
江苏省常州市武进区横山桥高级中学2020-2021学年高一下学期期中考试化学试题(已下线)第四章 物质结构 元素周期律(A卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)新疆克孜勒苏柯尔克孜自治州阿克陶县2022-2023学年高一上学期11月期中考试化学试题
解题方法
9 . 下图为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
(1)表中非金属性最强的元素名称为_______ ,它在元素周期表中的位置_______ 。
(2)③、⑤、⑥的原子半径由大到小的顺序为_______ 。
(3)①分别与④、⑧形成的简单氢化物中,沸点较高的是_______ 。
(4)②、⑦、③的最高价氧化物对应水化物的酸性由强到弱的顺序是_______ 。
(5)①、③、⑤三元素形成的简单的化合物的电子式为_______ 。
(6)工业上,用②的单质在高温下还原SiO2制备Si单质的化学方程式为_______ 。
| ① | ||||||||||
| ② | ③ | ④ | ||||||||
| ⑤ | ⑥ | ⑦ | ⑧ |
(1)表中非金属性最强的元素名称为
(2)③、⑤、⑥的原子半径由大到小的顺序为
(3)①分别与④、⑧形成的简单氢化物中,沸点较高的是
(4)②、⑦、③的最高价氧化物对应水化物的酸性由强到弱的顺序是
(5)①、③、⑤三元素形成的简单的化合物的电子式为
(6)工业上,用②的单质在高温下还原SiO2制备Si单质的化学方程式为
您最近一年使用:0次
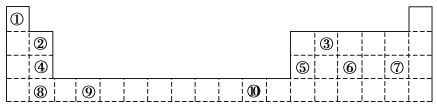
10 . 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,并回答下列问题:
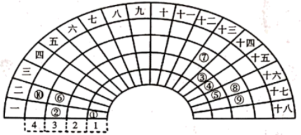
(1)元素②的名称为___________ ;元素⑩在常见周期表中的位置是___________ 。
(2)元素③、④、⑤形成的简单氢化物,稳定性最强的是___________ (填化学式,下同);元素④、⑧、⑨的最高价氧化物对应的水化物,酸性最强的是___________ 。
(3)元素⑥、⑦、⑧对应的简单离子的半径由大到小的顺序为___________ (用离子符号表示)。
(4)元素①、⑤和元素①、⑧均能形成18电子的化合物,这两种化合物发生反应的化学方程式为___________ 。
(5)请设计简单实验,比较元素②、⑦的金属性强弱。

(1)元素②的名称为
(2)元素③、④、⑤形成的简单氢化物,稳定性最强的是
(3)元素⑥、⑦、⑧对应的简单离子的半径由大到小的顺序为
(4)元素①、⑤和元素①、⑧均能形成18电子的化合物,这两种化合物发生反应的化学方程式为
(5)请设计简单实验,比较元素②、⑦的金属性强弱。
| 实验步骤 | 实验现象 | 实验结论 |
| 金属性:②>⑦ |
您最近一年使用:0次



