1 . Ⅰ.中国学者姜雪峰、雷晓光入选国际纯粹与应用化学联合会(IUPAC)发起的“化学家元素周期表”的征集提名,分别成为“S”、“N”元素的代言人。硒与硫最外层电子数相同,已知硒的原子结构示意图如图所示 ,试回答下列问题:
,试回答下列问题:
(1)硒在元素周期表中的位置为___________ 。
(2)结合元素周期律,比较并解释硒与硫元素的非金属性强弱:___________ 。
(3)下列说法正确的是___________ (填字母字号)。
a.热稳定性: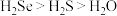 b.
b.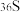 与
与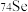 的中子数之和为60
的中子数之和为60
c.酸性: d.还原性:
d.还原性: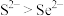
(4)试比较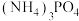 中各元素的原子半径大小
中各元素的原子半径大小___________ (用元素符号由大到小表示)。
Ⅱ.以金红石(主要成分为 )为原料,,制取Ti的工艺流程如图所示:
)为原料,,制取Ti的工艺流程如图所示:

(5)①Ⅰ在高温条件下进行,产物中有一种可燃性无色气体。Ⅰ中反应的化学方程式为___________ 。
②Ⅱ中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为___________ ℃。

③Ⅱ中氩气的作用是___________ 。
④海绵钛除杂时得到的 可以循环使用,在上述工艺流程中可循环使用的物质还有
可以循环使用,在上述工艺流程中可循环使用的物质还有___________ (填化学式)。
 ,试回答下列问题:
,试回答下列问题:(1)硒在元素周期表中的位置为
(2)结合元素周期律,比较并解释硒与硫元素的非金属性强弱:
(3)下列说法正确的是
a.热稳定性:
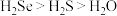 b.
b.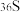 与
与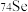 的中子数之和为60
的中子数之和为60c.酸性:
 d.还原性:
d.还原性: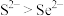
(4)试比较
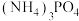 中各元素的原子半径大小
中各元素的原子半径大小Ⅱ.以金红石(主要成分为
 )为原料,,制取Ti的工艺流程如图所示:
)为原料,,制取Ti的工艺流程如图所示:
(5)①Ⅰ在高温条件下进行,产物中有一种可燃性无色气体。Ⅰ中反应的化学方程式为
②Ⅱ中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为

③Ⅱ中氩气的作用是
④海绵钛除杂时得到的
 可以循环使用,在上述工艺流程中可循环使用的物质还有
可以循环使用,在上述工艺流程中可循环使用的物质还有
您最近一年使用:0次
2 . 以粉煤灰(主要成分:Al2O3、SiO2、少量Fe2O3)为原料,制取Al2O3的部分工艺流程如下:

完成下列填空:
(1)铝原子核外有_______ 种不同能量的电子,最外层电子的轨道式是_______ ,上述流程涉及第二周期元素的原子半径由小到大的顺序是_______ 。
(2)“除铁”是将Fe3+转化为Fe(OH)3沉淀,反应的离子方程式为_______ ,检验溶液中Fe3+是否除尽的方法是_______ 。
(3)解释“结晶”过程中向AlCl3浓溶液中通入HCl气体的原因。_______
(4)上述流程可循环的物质是_______ 。
(5)工业上是通过电解熔化状态下Al2O3,而不是电解熔化状态下AlCl3来获得铝,其原因是_______ 。

完成下列填空:
(1)铝原子核外有
(2)“除铁”是将Fe3+转化为Fe(OH)3沉淀,反应的离子方程式为
(3)解释“结晶”过程中向AlCl3浓溶液中通入HCl气体的原因。
(4)上述流程可循环的物质是
(5)工业上是通过电解熔化状态下Al2O3,而不是电解熔化状态下AlCl3来获得铝,其原因是
您最近一年使用:0次
名校
3 . 回答下列问题
(1)锂在元素周期表的位置是___________ 。锂原子核外能量最高的电子所处的轨道是___________ 。
(2)写出一条判断锂与相邻同主族金属元素金属性强弱的实验依据。___________
(3)氢化锂(LiH)是离子化合物,写出其电子式___________ ,LiH中阴离子半径大于阳离子半径,其原因是___________ 。
LiBr可作锂电池中电解质材料。用 、荌水和液溴制备
、荌水和液溴制备 的流程如下:
的流程如下:

(4)合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:___________
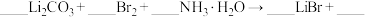
写出该反应所涉及物质中属于非电解质的电子式___________ 。
溴化锂的溶解度随温度变化曲线如图所示。
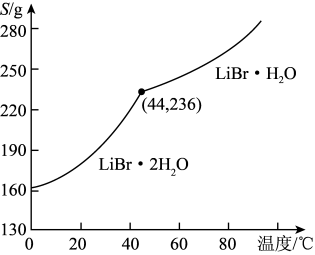
(5)从溶液中得到 晶体的实验步骤依次为:
晶体的实验步骤依次为:___________ ,___________ ,过滤,用乙醇洗涤,干燥。
(1)锂在元素周期表的位置是
(2)写出一条判断锂与相邻同主族金属元素金属性强弱的实验依据。
(3)氢化锂(LiH)是离子化合物,写出其电子式
LiBr可作锂电池中电解质材料。用
 、荌水和液溴制备
、荌水和液溴制备 的流程如下:
的流程如下:
(4)合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:
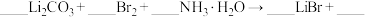
写出该反应所涉及物质中属于非电解质的电子式
溴化锂的溶解度随温度变化曲线如图所示。

(5)从溶液中得到
 晶体的实验步骤依次为:
晶体的实验步骤依次为:
您最近一年使用:0次
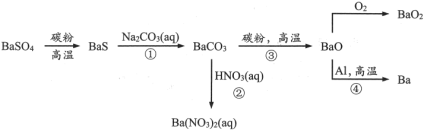
4 . 重晶石( )作为原料制备金属钡及其他含钡化合物的方法如下图:
)作为原料制备金属钡及其他含钡化合物的方法如下图:
完成下列填空:
(1)Ba在元素周期表中位于第_______ 族,最外层电子的电子云形状是_______ 。图中涉及的第二周期元素原子半径由大到小的顺序是_______ ,可以判断其中两种元素非金属性强弱的反应是_______ (选填流程中的反应编号)。
(2)配平BaS与稀硝酸反应的化学方程式:_______ 。
_______ _______
_______ _______
_______ _______
_______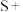 _______
_______ _______
_______
检验溶液中BaS是否完全反应的方法是:取少量反应液,加入_______ (填试剂),有黑色沉淀生成,则BaS未反应完全。
(3)工业上,利用反应①②而不用BaS直接与稀硝酸反应制 的原因是
的原因是_______ 。
(4)元素的金属性:Al_______ Ba(选填“>”或“<”);已知:沸点Al>Ba,反应④在真空容器中可以发生的理由是_______ 。
 )作为原料制备金属钡及其他含钡化合物的方法如下图:
)作为原料制备金属钡及其他含钡化合物的方法如下图:
完成下列填空:
(1)Ba在元素周期表中位于第
(2)配平BaS与稀硝酸反应的化学方程式:
_______
 _______
_______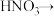 _______
_______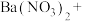 _______
_______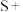 _______
_______ _______
_______
检验溶液中BaS是否完全反应的方法是:取少量反应液,加入
(3)工业上,利用反应①②而不用BaS直接与稀硝酸反应制
 的原因是
的原因是(4)元素的金属性:Al
您最近一年使用:0次
解题方法
5 . 发蓝工艺是将钢铁浸入热的NaNO2碱性溶液中,在其表面形成一层四氧化三铁薄膜。其中铁经历了如下转化:

其中②的化学方程式为:Na2FeO2+NaNO2+H2O Na2Fe2O4+NH3↑+NaOH(未配平)。
Na2Fe2O4+NH3↑+NaOH(未配平)。
完成下列填空:
(1)Na原子核外有_______ 种能量不同的电子,其中能量最高的电子所占的电子亚层符号为_______ 。将反应②中涉及的短周期元素,按原子半径由大到小顺序排列。_______
(2)NH3分子的结构式为_______ 。从原子结构的角度解释氮元素的非金属性比氧元素弱的原因。_______
(3)配平反应②的化学方程式______ 。若反应生成11.2 L(标准状态)氨气,则电子转移的数目为_______ 。
(4)反应③中Na2FeO2与Na2Fe2O4的物质的量之比为_______ 。写出Fe→Fe3O4的置换反应的化学方程式_______

其中②的化学方程式为:Na2FeO2+NaNO2+H2O
 Na2Fe2O4+NH3↑+NaOH(未配平)。
Na2Fe2O4+NH3↑+NaOH(未配平)。完成下列填空:
(1)Na原子核外有
(2)NH3分子的结构式为
(3)配平反应②的化学方程式
(4)反应③中Na2FeO2与Na2Fe2O4的物质的量之比为
您最近一年使用:0次
名校
6 . 因在航空、核能、电池等高技术领域的重要作用——锂被称为“21世纪的能源金属”。
(1)锂在元素周期表中的位置_______ 。锂的很多化学性质与镁相似,请依据元素周期律进行解释:_______ 。
(2)氢化锂(LiH)是离子化合物,写出其电子式_______ ,LiH中阴离子半径大于阳离子半径,其原因是_______ 。
工业上用 制取锂的化合物及金属锂。
制取锂的化合物及金属锂。
(3)碳原子核外电子有_______ 种不同能量的电子,其中有两个电子的能量最高且能量相等,这两个电子所处的轨道是_______ 。
(4)用 、氨水和液溴制备
、氨水和液溴制备 的流程如下:
的流程如下:

①合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:_______ 。
_______ +_______
+_______ _______
_______
 _______
_______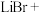 _______
_______
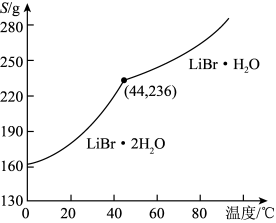
②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到 晶体的实验步骤:
晶体的实验步骤:_______ 、过滤、用乙醇洗涤,干燥。
(1)锂在元素周期表中的位置
(2)氢化锂(LiH)是离子化合物,写出其电子式
工业上用
 制取锂的化合物及金属锂。
制取锂的化合物及金属锂。(3)碳原子核外电子有
(4)用
 、氨水和液溴制备
、氨水和液溴制备 的流程如下:
的流程如下:
①合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:
_______
 +_______
+_______ _______
_______
 _______
_______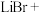 _______
_______②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到
 晶体的实验步骤:
晶体的实验步骤:
您最近一年使用:0次
解题方法
7 .  是一种重要的无机化合物,可作为食盐中的补碘剂。利用“
是一种重要的无机化合物,可作为食盐中的补碘剂。利用“ 氧化法”制备
氧化法”制备 工艺流程如图所示:
工艺流程如图所示:
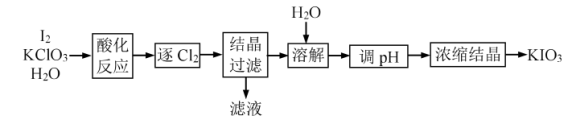
已知:“酸化反应”所得产物有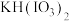 、
、 和
和 。
。
回答下列问题:
(1) 在元素周期表中的位置是
在元素周期表中的位置是_______ ; 的电子式为
的电子式为_______ ; 中两种离子的半径大小关系为
中两种离子的半径大小关系为_______ 。
(2)将“酸化反应”的化学方程式补充完整。
______
(3)“逐 ”采用的方法是
”采用的方法是_______ 。
(4)“滤液”中的溶质主要是_______ 。
(5)“调 ”时,加入的试剂为
”时,加入的试剂为_______ 溶液。
(6)“ 氧化法”的明显不足之处有
氧化法”的明显不足之处有_______ (任写一条)。
 是一种重要的无机化合物,可作为食盐中的补碘剂。利用“
是一种重要的无机化合物,可作为食盐中的补碘剂。利用“ 氧化法”制备
氧化法”制备 工艺流程如图所示:
工艺流程如图所示:
已知:“酸化反应”所得产物有
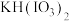 、
、 和
和 。
。回答下列问题:
(1)
 在元素周期表中的位置是
在元素周期表中的位置是 的电子式为
的电子式为 中两种离子的半径大小关系为
中两种离子的半径大小关系为(2)将“酸化反应”的化学方程式补充完整。

(3)“逐
 ”采用的方法是
”采用的方法是(4)“滤液”中的溶质主要是
(5)“调
 ”时,加入的试剂为
”时,加入的试剂为(6)“
 氧化法”的明显不足之处有
氧化法”的明显不足之处有
您最近一年使用:0次
2013·上海闵行·三模
解题方法
8 . 海洋是资源的宝库,海水中几乎存在所有的天然元素。海洋资源化学就是研究从海洋中提取化学物质的学科,除了研究从海洋中提取常量元素外,还研究从海洋中提取微量元素(浓度小于1mg/L)。
(1)海洋中含量最高的卤素元素在周期表中的位置为__________ ;与其同周期相邻且单质为固体的元素原子的核外电子排布式为_________ 。
(2)海洋中元素含量位于前列的元素有氧、氯、钠、镁、硫,其离子半径从大到小的顺序为_______________________ (用离子符号表示),其中形成的化合物中能发生潮解的是___________ (用电子式表示)。
(3)微量元素铍在海水中主要以Be(OH)+形式存在,其性质与铝元素相似,目前是从绿宝石(主要成分为铍铝硅酸盐Be3Al2Si6O18)中提取,由于铍是航空、电子、汽车等工业不可替代的战略金属材料,因此海水提铍会成为海洋资源化学新的研究方向。请写出:
(i)铍铝硅酸盐的氧化物形式的化学式:_____________ 。
(ii)Be(OH)+与强碱溶液反应的离子方程式:___________ 。
(4)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是______ (选填编号)。
a 海水提溴:海水浓缩
 溴蒸气
溴蒸气
 液溴
液溴
b 海水提镁:海滩贝壳
 石灰乳
石灰乳
 MgO
MgO 镁
镁
c 海带提碘:海带灼烧
 滤液
滤液 含碘有机溶液
含碘有机溶液 碘晶体
碘晶体
d 海盐提纯:海盐
 精盐
精盐

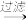 滤液
滤液
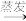 食盐晶体
食盐晶体
(1)海洋中含量最高的卤素元素在周期表中的位置为
(2)海洋中元素含量位于前列的元素有氧、氯、钠、镁、硫,其离子半径从大到小的顺序为
(3)微量元素铍在海水中主要以Be(OH)+形式存在,其性质与铝元素相似,目前是从绿宝石(主要成分为铍铝硅酸盐Be3Al2Si6O18)中提取,由于铍是航空、电子、汽车等工业不可替代的战略金属材料,因此海水提铍会成为海洋资源化学新的研究方向。请写出:
(i)铍铝硅酸盐的氧化物形式的化学式:
(ii)Be(OH)+与强碱溶液反应的离子方程式:
(4)下列从海洋中提取或提纯物质的生产或实验流程中,不合理的是
a 海水提溴:海水浓缩
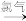
 溴蒸气
溴蒸气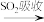
 液溴
液溴b 海水提镁:海滩贝壳
 石灰乳
石灰乳
 MgO
MgO 镁
镁c 海带提碘:海带灼烧

 滤液
滤液 含碘有机溶液
含碘有机溶液 碘晶体
碘晶体d 海盐提纯:海盐
 精盐
精盐

 滤液
滤液
 食盐晶体
食盐晶体
您最近一年使用:0次
9 . 金属镓有“电子工业脊梁”的美誉,它与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如下图所示:

(1)元素Ga位于Al的下一周期,写出镓(Ga)的原子结构示意图为____________ CO2的电子式为_____________________
(2)下列有关Al、Ga的说法不正确的是______
A.由流程图可知酸性:Al(OH)3>Ga(OH)3 B.Ga2O3可与盐酸反应生成GaCl3
C.Ga(OH)3可由Ga2O3与水反应得到 D.与酸反应的剧烈程度:Al<Ga
(3)图中涉及到的Al、Na、O三种元素简单离子半径由大到小的顺序_____________
(4)步骤二中不能通入过量的CO2,理由_________________ (用离子方程式表示)
(5)工业上通常用电解精炼法提纯镓。某待提纯的粗镓内含Zn、Fe、Cu杂质,以NaOH水溶液为电解质溶液。在电流作用下使粗镓溶解进入电解质溶液,通过某种离子迁移技术到达阴极,并在阴极放电析出高纯镓。(离子氧化性顺序为:Zn2+<Ga3+<Fe2+)
①下列有关电解精炼说法正确的是_______
A.阳极发生氧化反应,其主要电极反应式:Ga-3e- ═ Ga3+
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.在阴极除了析出高纯度的镓之外,还有H2产生
D.电解后,电解槽底部的阳极泥中只有Cu和Fe
②阴极析出高纯度镓的电极反应式__________________________________
(6)氮化镓在电和光的转化方面性能突出,是迄今理论上光电转化效率最高的材料。氮化镓(GaN)的一种制备方法是采用GaCl3与NH3在一定条件下反应,写出该反应的化学方程式__________________

(1)元素Ga位于Al的下一周期,写出镓(Ga)的原子结构示意图为
(2)下列有关Al、Ga的说法不正确的是
A.由流程图可知酸性:Al(OH)3>Ga(OH)3 B.Ga2O3可与盐酸反应生成GaCl3
C.Ga(OH)3可由Ga2O3与水反应得到 D.与酸反应的剧烈程度:Al<Ga
(3)图中涉及到的Al、Na、O三种元素简单离子半径由大到小的顺序
(4)步骤二中不能通入过量的CO2,理由
(5)工业上通常用电解精炼法提纯镓。某待提纯的粗镓内含Zn、Fe、Cu杂质,以NaOH水溶液为电解质溶液。在电流作用下使粗镓溶解进入电解质溶液,通过某种离子迁移技术到达阴极,并在阴极放电析出高纯镓。(离子氧化性顺序为:Zn2+<Ga3+<Fe2+)
①下列有关电解精炼说法正确的是
A.阳极发生氧化反应,其主要电极反应式:Ga-3e- ═ Ga3+
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.在阴极除了析出高纯度的镓之外,还有H2产生
D.电解后,电解槽底部的阳极泥中只有Cu和Fe
②阴极析出高纯度镓的电极反应式
(6)氮化镓在电和光的转化方面性能突出,是迄今理论上光电转化效率最高的材料。氮化镓(GaN)的一种制备方法是采用GaCl3与NH3在一定条件下反应,写出该反应的化学方程式
您最近一年使用:0次
2019-04-01更新
|
758次组卷
|
4卷引用:【校级联考】天津市十二重点中学2019届高三下学期毕业班联考(一)化学试题
【校级联考】天津市十二重点中学2019届高三下学期毕业班联考(一)化学试题2020届高三化学二轮每周大题必练— —— 无机物制备实验流程(已下线)第五单元 元素周期表和元素周期律测试题-2021年高考化学一轮复习名师精讲练黑龙江省哈尔滨师范大学青冈实验中学校2020-2021学年高二上学期开学考试化学试题



