名校
解题方法
1 .  是9种中学化学中常见的元素。
是9种中学化学中常见的元素。
(1)原子结构与元素性质
①基态氢原子中,核外电子的电子云轮廓图形状为________ 。
②3种元素 中,离子半径最小的是
中,离子半径最小的是______ (填离子符号)。
③基态 的价层电子轨道表示式为
的价层电子轨道表示式为________ 。
(2)微粒间相互作用与物质性质
①胆矾( )的结构示意图如下所示。
)的结构示意图如下所示。 与
与 与
与 的作用力分别为
的作用力分别为______ 和______ 。
② 的VSEPR模型为
的VSEPR模型为______ , 的分子空间构型为
的分子空间构型为________ , 是
是________ (填“极性”或“非极性”)分子。
③写出 电子式:
电子式:________ , 形成过程的电子式:
形成过程的电子式:______ 。
④比较 分子中的键角大小并给出相应解释:
分子中的键角大小并给出相应解释:_______ 。
⑤相同条件下, 在水中的溶解度大于
在水中的溶解度大于 的,理由是
的,理由是_________ 。
 是9种中学化学中常见的元素。
是9种中学化学中常见的元素。(1)原子结构与元素性质
①基态氢原子中,核外电子的电子云轮廓图形状为
②3种元素
 中,离子半径最小的是
中,离子半径最小的是③基态
 的价层电子轨道表示式为
的价层电子轨道表示式为(2)微粒间相互作用与物质性质
①胆矾(
 )的结构示意图如下所示。
)的结构示意图如下所示。
 与
与 与
与 的作用力分别为
的作用力分别为②
 的VSEPR模型为
的VSEPR模型为 的分子空间构型为
的分子空间构型为 是
是③写出
 电子式:
电子式: 形成过程的电子式:
形成过程的电子式:④比较
 分子中的键角大小并给出相应解释:
分子中的键角大小并给出相应解释:⑤相同条件下,
 在水中的溶解度大于
在水中的溶解度大于 的,理由是
的,理由是
您最近一年使用:0次
真题
解题方法
2 . 氮和氧是构建化合物的常见元素。
(1)某化合物的晶胞如图,其化学式是_______ ,晶体类型是_______ 。
(2)下列说法正确的是_______。
(3)① ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为_______ ;比较键角 中的
中的
_______  中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由_______ 。
②将 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
_______  (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式_______ 。
已知: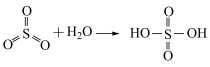
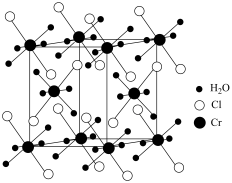
(1)某化合物的晶胞如图,其化学式是
(2)下列说法正确的是_______。
A.电负性: | B.离子半径: |
C.第一电离能: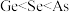 | D.基态 2+的简化电子排布式: 2+的简化电子排布式: |
(3)①
 ,其中
,其中 的N原子杂化方式为
的N原子杂化方式为 中的
中的
 中的
中的 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由②将
 与
与 按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是
按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是 。比较氧化性强弱:
。比较氧化性强弱:
 (填“>”、“<”或“=”);写出A中阴离子的结构式
(填“>”、“<”或“=”);写出A中阴离子的结构式
您最近一年使用:0次
名校
解题方法
3 . N、P及其化合物在工业生产中起着重要的作用。回答下列问题:
(1)由磷原子核形成的三种微粒:a.([Ne]3s23p3)、b.([Ne]3s23p2)、c.([Ne]3s23p24s1),半径由大到小的顺序为___________ (填标号,下同);再失去一个电子所需最低能量由大到小的顺序为___________ 。
(2)已知HSCN的结构有两种,这两种分子结构中除氢外各原子均满足八电子稳定结构(无配位键),请画出沸点高的分子的结构式___________ 。
(3)杂环化合物咪唑结构如图,其分子中的大π键可表示为 ,则其结合质子能力更强的氮原子是
,则其结合质子能力更强的氮原子是___________ (填“①”或“②”),其原因是___________ 。

(4)氮、铜形成的一种化合物,为立方晶系晶体,晶胞参数为apm,沿体对角线投影如下图所示。已知该晶胞中原子的分数坐标如下:Cu:(0,0, );(0,
);(0, ,0);(
,0);( ,0,0);N:(0,0,0),其中与Cu原子等距且最近的Cu原子有
,0,0);N:(0,0,0),其中与Cu原子等距且最近的Cu原子有___________ 个,则该化合物的化学式为___________ 。

(5)PCl5是一种白色晶体,其晶胞如图所示。该晶体熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。

①写出PCl5熔融时的电离方程式___________ 。
②若晶胞参数为anm,则晶体的密度为___________  (列出计算式)。
(列出计算式)。
(1)由磷原子核形成的三种微粒:a.([Ne]3s23p3)、b.([Ne]3s23p2)、c.([Ne]3s23p24s1),半径由大到小的顺序为
(2)已知HSCN的结构有两种,这两种分子结构中除氢外各原子均满足八电子稳定结构(无配位键),请画出沸点高的分子的结构式
(3)杂环化合物咪唑结构如图,其分子中的大π键可表示为
 ,则其结合质子能力更强的氮原子是
,则其结合质子能力更强的氮原子是
(4)氮、铜形成的一种化合物,为立方晶系晶体,晶胞参数为apm,沿体对角线投影如下图所示。已知该晶胞中原子的分数坐标如下:Cu:(0,0,
 );(0,
);(0, ,0);(
,0);( ,0,0);N:(0,0,0),其中与Cu原子等距且最近的Cu原子有
,0,0);N:(0,0,0),其中与Cu原子等距且最近的Cu原子有
(5)PCl5是一种白色晶体,其晶胞如图所示。该晶体熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。

①写出PCl5熔融时的电离方程式
②若晶胞参数为anm,则晶体的密度为
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2024-01-22更新
|
667次组卷
|
2卷引用:山东省高中名校2023-2024学年高三上学期12月统一调研考试化学试题
名校
解题方法
4 . 钛酸钙是最典型的钙钛矿型化合物,该类化合物具有特殊的理化性质。
(1)基态 的核外电子排布式为
的核外电子排布式为____________ 。
(2)钛酸钙的晶胞如下图所示。
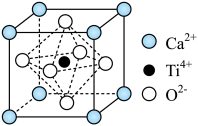
①每个 周围等距且紧邻的
周围等距且紧邻的 有
有______ 个。
②比较 和
和 的离子半径大小并说明理由
的离子半径大小并说明理由____________ 。
(3)钛酸钙的阴、阳离子均可被半径相近的其它离子替代,从而衍生出多种钙钛矿型化合物。
①已知钛酸钙晶胞中距离最近的 和
和 之间的距离为
之间的距离为 ,则钛酸钙晶体密度
,则钛酸钙晶体密度
______  (列出计算式)。
(列出计算式)。
②若忽略离子替代时的体积变化,下列钙钛矿型化合物中,密度大于钛酸钙的是______ (填字母序号)。
a. b.
b.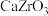 c.
c.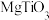
(4)通过离子替代可获得具有优异光电性能的有机钙钛矿型化合物 。其中有机阳离子
。其中有机阳离子 可由甲胺(
可由甲胺( )制得。
)制得。
① 中N的杂化方式为
中N的杂化方式为____________ 。
请从化学键的角度解释由甲胺形成 的过程:
的过程:____________ 。
(1)基态
 的核外电子排布式为
的核外电子排布式为(2)钛酸钙的晶胞如下图所示。

①每个
 周围等距且紧邻的
周围等距且紧邻的 有
有②比较
 和
和 的离子半径大小并说明理由
的离子半径大小并说明理由(3)钛酸钙的阴、阳离子均可被半径相近的其它离子替代,从而衍生出多种钙钛矿型化合物。
①已知钛酸钙晶胞中距离最近的
 和
和 之间的距离为
之间的距离为 ,则钛酸钙晶体密度
,则钛酸钙晶体密度
 (列出计算式)。
(列出计算式)。②若忽略离子替代时的体积变化,下列钙钛矿型化合物中,密度大于钛酸钙的是
a.
 b.
b.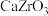 c.
c.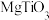
(4)通过离子替代可获得具有优异光电性能的有机钙钛矿型化合物
 。其中有机阳离子
。其中有机阳离子 可由甲胺(
可由甲胺( )制得。
)制得。①
 中N的杂化方式为
中N的杂化方式为请从化学键的角度解释由甲胺形成
 的过程:
的过程:
您最近一年使用:0次
名校
5 . 电气石是一种具有保健作用的天然石材,其中含有的主要元素为 等元素。
等元素。
(1)上述元素中,原子半径最小的是_______ (用元素符号表示),与硫同周期的元素中简单离子半径最小的是_______ (用离子符号表示);
(2)用轨道表示式表示氧元素原子核外电子的运动状态_______ ;氧元素原子核外有_______ 种不同能量的电子;
(3) 分子中
分子中 为
为_______ 杂化,键角等于_______ ,可以判断出 分子为
分子为_______ 分子(选填“极性”或“非极性”); 晶体的熔点比
晶体的熔点比 晶体
晶体_______ (选填“高”、“低”),原因为_______ 。
 等元素。
等元素。(1)上述元素中,原子半径最小的是
(2)用轨道表示式表示氧元素原子核外电子的运动状态
(3)
 分子中
分子中 为
为 分子为
分子为 晶体的熔点比
晶体的熔点比 晶体
晶体
您最近一年使用:0次
2023高三·全国·专题练习
6 . 我国科学家使用了新的铝铍埋藏测年法测量北京猿人的生存年代。这种方法的测量对象是石英(二氧化硅),它是砂石的主要成分。当宇宙射线打到地面时,会将石英中的硅原子和氧原子打破,生成铝和铍的同位素。只要测出一块石头中26Al和10Be的含量,就能推算出它被埋入地下的时间。完成下列填空:
(1)画出Be的核外价电子排布轨道式___________ 。Be所在的周期中,最外层有2个未成对电子的元素的符号是___________ 、___________ 。
(2)写出Al的最外层电子排布式___________ 。铝原子核外有___________ 种运动状态不同的电子;铝原子核外有___________ 种能量不同的电子。有一种与26Al中子数相同的硅的核素,写出该核素符号___________ ,该硅电负性___________ (填“大于”或“小于”)Al 。
(3)比较Al3+、S2-和Cl-半径由大到小的顺序___________ ;这3种元素最高价氧化物对应的水化物中酸性最强的是___________ (写化学式)。
(4)铝单质在氧气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:___________ 。
(1)画出Be的核外价电子排布轨道式
(2)写出Al的最外层电子排布式
(3)比较Al3+、S2-和Cl-半径由大到小的顺序
(4)铝单质在氧气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:
您最近一年使用:0次
2023高三·全国·专题练习
7 . 有位于前四周期的A、B、C、D、E、F、G七种元素(无稀有气体),它们的核电荷数依次增大。其中C、F、G是金属元素:A和F属同族,它们原子的最外层电子排布式为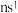 。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。G元素原子共有3个价电子,其中一个价电子位于第三能层d轨道。请回答下列问题:
。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。G元素原子共有3个价电子,其中一个价电子位于第三能层d轨道。请回答下列问题:
(1)G是___________ (用元素符号回答,下同),其最高化合价为___________ 。
(2)元素E的电子所占据的最高能级的原子轨道呈___________ 形。D、E可分别与A形成的最简分子,前者的稳定性弱于后者,从化学键的角度解释的原因是___________ ;
(3)B、C、D、F的简单离子半径由大到小的顺序为:___________ 。
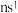 。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。G元素原子共有3个价电子,其中一个价电子位于第三能层d轨道。请回答下列问题:
。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。G元素原子共有3个价电子,其中一个价电子位于第三能层d轨道。请回答下列问题:(1)G是
(2)元素E的电子所占据的最高能级的原子轨道呈
(3)B、C、D、F的简单离子半径由大到小的顺序为:
您最近一年使用:0次
解题方法
8 . 锂是最轻的活泼金属,其单质及其化合物有广泛的用途。回答下列问题:
(1)在元素周期表中,与
 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是___________ ,该元素基态原子中,占据最高能级电子的电子云轮廓图形状为___________ 。
(2)LiH是一种储氢材料。
(i)Li与H中第一电离能较小的元素是___________ 。
(ii)离子半径:Li+___________ H-(填“>”“=”或“<”)。
(3)已知金属锂晶体为FCC(面心立方晶格),面心立方紧密堆积结构示意图如下:
(i)晶胞中锂的配位数为___________ 。
(ii)若锂原子的半径为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则锂晶体密度为
,则锂晶体密度为___________  (列出含有
(列出含有 、
、 的计算式即可)。
的计算式即可)。
(1)在元素周期表中,与
 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是(2)LiH是一种储氢材料。
(i)Li与H中第一电离能较小的元素是
(ii)离子半径:Li+
(3)已知金属锂晶体为FCC(面心立方晶格),面心立方紧密堆积结构示意图如下:

(i)晶胞中锂的配位数为
(ii)若锂原子的半径为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则锂晶体密度为
,则锂晶体密度为 (列出含有
(列出含有 、
、 的计算式即可)。
的计算式即可)。
您最近一年使用:0次
2023-10-28更新
|
93次组卷
|
2卷引用:山西省大同市2023-2024学年高三上学期10月月考化学试题
解题方法
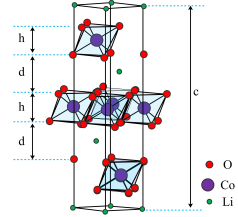
9 . 钴酸锂(LiCoO2)是常见的锂离子电池正极材料,其晶胞结构示意图如图。晶体中O围绕Co形成八面体,八面体共棱形成带负电的层状空间结构,与Li+层交替排列。在充放电过程中,Li+在层间脱出或嵌入。
(1)下列Li原子电子排布图表示的状态中,能量最低的是______ 。
(2)Li+与H-具有相同的电子构型,离子半径r(Li+)小于r(H-)的主要原因是______ 。
(3)观察该晶胞图示,其中Li处于晶胞顶点或晶胞内部,Co处于晶胞内部或晶胞侧棱上,而O的位置不易观察。结合钴酸锂(LiCoO2)化学式,可推断该晶胞中O的个数为______ 。
(4)晶胞底面为菱形,晶胞高度为cnm,Co和O组成八面体层高度为hnm,计算两层间的距离d=______ nm。(列出计算式)
(5)Li+在______ (填“充电”或“放电”)过程中会从八面体层间脱出。该过程会导致晶胞高度c变大,解释原因:______ 。

(1)下列Li原子电子排布图表示的状态中,能量最低的是
A.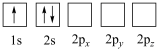 | B.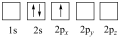 |
C.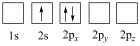 | D. |
(2)Li+与H-具有相同的电子构型,离子半径r(Li+)小于r(H-)的主要原因是
(3)观察该晶胞图示,其中Li处于晶胞顶点或晶胞内部,Co处于晶胞内部或晶胞侧棱上,而O的位置不易观察。结合钴酸锂(LiCoO2)化学式,可推断该晶胞中O的个数为
(4)晶胞底面为菱形,晶胞高度为cnm,Co和O组成八面体层高度为hnm,计算两层间的距离d=
(5)Li+在
您最近一年使用:0次
名校
解题方法
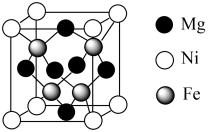
10 . 一种新型硫酸盐功能电解液由 和
和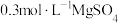 混合组成,电化学测试表明该电解液构建的
混合组成,电化学测试表明该电解液构建的 、
、 电池可以稳定循环500次以上。
电池可以稳定循环500次以上。
(1) 中三种原子的半径由小到大的顺序是
中三种原子的半径由小到大的顺序是_____ (用元素符号表示),其中电负性最大的元素是_____ (填名称)。
(2)第一电离能 的原因是
的原因是_____ 。
(3) 中,基态
中,基态 核外电子的空间运动状态有
核外电子的空间运动状态有_____ 种, 中
中 键和
键和 键的数目之比为
键的数目之比为_____ 。
(4) 中磷原子的杂化类型是
中磷原子的杂化类型是_____ 。
(5)N、O两种元素形成的简单氢化物的键角:
_____  (填“>”“<”或“=”),其原因是
(填“>”“<”或“=”),其原因是_____ 。
(6) 的立方晶胞结构如图所示。已知晶胞的边长为npm,设
的立方晶胞结构如图所示。已知晶胞的边长为npm,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
①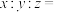
_____ 。
②该晶体密度是_____  (用含n、
(用含n、 的代数式表示)。
的代数式表示)。
 和
和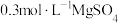 混合组成,电化学测试表明该电解液构建的
混合组成,电化学测试表明该电解液构建的 、
、 电池可以稳定循环500次以上。
电池可以稳定循环500次以上。(1)
 中三种原子的半径由小到大的顺序是
中三种原子的半径由小到大的顺序是(2)第一电离能
 的原因是
的原因是(3)
 中,基态
中,基态 核外电子的空间运动状态有
核外电子的空间运动状态有 中
中 键和
键和 键的数目之比为
键的数目之比为(4)
 中磷原子的杂化类型是
中磷原子的杂化类型是(5)N、O两种元素形成的简单氢化物的键角:

 (填“>”“<”或“=”),其原因是
(填“>”“<”或“=”),其原因是(6)
 的立方晶胞结构如图所示。已知晶胞的边长为npm,设
的立方晶胞结构如图所示。已知晶胞的边长为npm,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
①
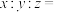
②该晶体密度是
 (用含n、
(用含n、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2023-09-21更新
|
111次组卷
|
2卷引用:四川省绵阳南山中学2023-2024学年高三上学期第二次综合演练理综化学试题



