1 . W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3与WZ相遇会产生白烟。下列叙述正确的是
| A.非金属性:W> X>Y> Z | B.原子半径:Z>Y>X>W |
| C.元素X的含氧酸均为强酸 | D.Y的氧化物水化物为强碱 |
您最近一年使用:0次
2020-07-09更新
|
15924次组卷
|
63卷引用:上海市上海交通大学附属中学2020-2021学年高二上学期期中考试试题
上海市上海交通大学附属中学2020-2021学年高二上学期期中考试试题 山西省长治市第二中学校2020-2021学年高二上学期第二次月考化学试题贵州省遵义市务川县汇佳中学2020-2021学年高二下学期第三次月考化学试题云南省峨山彝族自治县第一中学2021-2022学年高二上学期12月月考化学试题(已下线)第07练 以元素“位—构—性”综合推断突破元素周期表、律-2022年【暑假分层作业】高二化学(2023届一轮复习通用)上海市格致中学2022-2023学年高三上学期期中考试化学试题上海市实验学校2023届高三下学期3月月考化学试题云南省大理州实验中学2021-2022学年高二上学期化学期中考试题2020年全国统一考试化学试题(新课标Ⅲ)陕西省延安市吴起高级中学2019-2020学年高一下学期第四次质量检测(期末)化学试题贵州省兴仁市凤凰中学2019-2020学年高一下学期期末考试化学试题贵州省铜仁市伟才学校2019-2020学年高一下学期期末考试化学(理)试题(已下线)专题06 物质结构 元素周期律-2020年高考真题和模拟题化学分项汇编(已下线)第18讲 元素周期律和元素周期表(精讲)——2021年高考化学一轮复习讲练测(已下线)第17讲 原子结构 化学键(精讲)——2021年高考化学一轮复习讲练测河南省郑州市巩义市第四高级中学2021届高三上学期期中考试化学试题重庆市第七中学2021届高三上学期第一次月考化学试题(已下线)小题必刷22 元素周期表(律)及其应用——2021年高考化学一轮复习小题必刷(通用版)海南省北京师范大学万宁附属中学2019-2020学年高一下学期期末考试化学试题黑龙江省哈尔滨市第三十二中学2021届高三上学期期末考试化学试题 内蒙古四子王旗第一中学2021届高三上学期1月月考化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 C高考挑战区(已下线)热点7 物质结构与元素周期律-2021年高考化学专练【热点·重点·难点】(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)专题04 物质结构和元素周期律——备战2021年高考化学纠错笔记(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练广西壮族自治区蒙山中学2020-2021学年高一下学期第一次月考化学试题河南省郑州市中牟县2020-2021学年高一下学期期中考试化学试题(已下线)押全国卷理综第10题 元素周期表元素周期律-备战2021年高考化学临考题号押题(课标全国卷)天津市实验中学滨海学校2021届高三上学期第一次月考化学试题云南省楚雄天人中学2020-2021学年高一下学期3月月考化学(A)试题广西钦州市2020-2021学年高一下学期期末考试化学(文)试题(已下线)第16讲 元素周期律和元素周期表(精练)-2022年高考化学一轮复习讲练测(已下线)课时25 原子结构-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第13讲 原子结构 化学键(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第14讲 元素周期律和元素周期表(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向16 元素周期表 元素周期律-备战2022年高考化学一轮复习考点微专题(已下线)专题04 物质结构与元素周期律—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)专题04 物质结构与元素周期律—2022年高考化学二轮复习讲练测(全国版)-练习2020年全国卷Ⅲ化学真题变式题广西梧州市2020-2021学年高一下学期第一次月考化学试题(已下线)卷08 元素周期律-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)押全国卷理综第10题 元素周期表 元素周期律-备战2022年高考化学临考题号押题(课标全国卷)(已下线)查补易混易错点06 物质结构 元素周期律-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题06物质结构元素周期律-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题06物质结构元素周期律-三年(2020~2022)高考真题汇编(全国卷)(已下线)考点07 元素周期律和元素周期表-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第13讲 原子结构 化学键(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第14讲 元素周期律和元素周期表(讲)-2023年高考化学一轮复习讲练测(新教材新高考)内蒙古巴彦淖尔市临河区第三中学2021-2022学年高三上学期第二次阶段性测试理综化学试题四川省广元市八二一中学2021-2022学年高一下学期期中考试化学试题陕西省黄陵中学2021-2022学年高一下学期期中考试化学试题四川省成都东部新区养马中学2020-2021学年高一下学期期中考试化学试题(已下线)专题07 元素周期律与元素周期表(练)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)第一部分 二轮专题突破 专题9 “位—构—性”综合推断(已下线)专题12 元素周期律推断-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型77 基于物质性质考查元素周期律山东省菏泽市单县第二中学2022-2023学年高一下学期3月段考化学试题(已下线)专题07 元素周期表与元素周期律(已下线)第2讲 元素素周期表 元素周期律福建省漳州市第五中学2023-2024学年高一下学期第一次月考化学试卷
名校
解题方法
2 . 百余种不同的元素,是构成大千世界中所有物质的“基石”。科学家们根据元素的性质递变规律、电子排布规律等对元素进行编排设计元素周期表。请根据所学内容回答下列问题:
(1)地壳中含量最多的元素的基态原子的轨道表示式是___________ ,能量最高的电子所在的轨道呈___________ 形。
(2) 、
、 是工业生产中重要的两种金属,将乙醇蒸气通过赤热的氧化铜粉末,发生的反应的化学方程式是
是工业生产中重要的两种金属,将乙醇蒸气通过赤热的氧化铜粉末,发生的反应的化学方程式是___________ 。
(3)研究发现,正离子的颜色与未成对电子数有关。例如: 、
、 、
、 等。
等。 呈无色,其原因是
呈无色,其原因是___________ 。
(4)当原子、分子或离子内有单电子存在时,能被外磁场吸引,表现出顺磁性。则铬元素的基态原子是否具有磁性?填___________ (填“有”或“无”)该元素在元素周期表中的位置:第___________ 周期,第___________ 族,该周期共有___________ 种元素。
(5)随着科技的不断发展,人类对原子结构的认识不断深入,新型材料层出不穷。下表中列出了第三周期的几种元素的部分性质:
预测X值的区间:___________ ;上表中五种元素的第一电离能由大到小的顺序是___________ 。(写元素符号)
(6)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂、钛酸锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。基态 原子的外围电子排布式为
原子的外围电子排布式为___________ ; 位于周期表中
位于周期表中___________ 区,基态 、
、 离子中未成对的电子数之比为
离子中未成对的电子数之比为___________ 。
(7) 和
和 的第一电离能:
的第一电离能: ,原因是
,原因是___________ 。
(8)一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是___________。
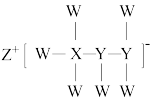
(1)地壳中含量最多的元素的基态原子的轨道表示式是
(2)
 、
、 是工业生产中重要的两种金属,将乙醇蒸气通过赤热的氧化铜粉末,发生的反应的化学方程式是
是工业生产中重要的两种金属,将乙醇蒸气通过赤热的氧化铜粉末,发生的反应的化学方程式是(3)研究发现,正离子的颜色与未成对电子数有关。例如:
 、
、 、
、 等。
等。 呈无色,其原因是
呈无色,其原因是(4)当原子、分子或离子内有单电子存在时,能被外磁场吸引,表现出顺磁性。则铬元素的基态原子是否具有磁性?填
(5)随着科技的不断发展,人类对原子结构的认识不断深入,新型材料层出不穷。下表中列出了第三周期的几种元素的部分性质:
| 元素编号 | a | b | c | d | e |
| 电负性 | 3.0 | 2.5 | X | 1.5 | 0.9 |
| 主要化合价 |  , , |  , , |  , , |  |  |
(6)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂、钛酸锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。基态
 原子的外围电子排布式为
原子的外围电子排布式为 位于周期表中
位于周期表中 、
、 离子中未成对的电子数之比为
离子中未成对的电子数之比为(7)
 和
和 的第一电离能:
的第一电离能: ,原因是
,原因是(8)一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是___________。
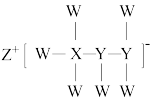
| A.该化合物中,W、X、Y之间均为共价键 |
| B.Z的单质既能与水反应,也可与甲醇反应 |
| C.Y的最高化合价氧化物的水化物为强酸 |
D.X的氟化物 中原子均为8电子稳定结构 中原子均为8电子稳定结构 |
您最近一年使用:0次
名校
解题方法
3 . W、X、Y、Z、Q五种元素的原子结构与性质如表所示,其中前四种是常见的短周期主族元素。回答下列问题:
(1)W在元素周期表中的位置为___________ ,写出其基态原子的轨道表示式___________ 。
(2) 与足量的
与足量的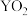 的水溶液发生反应生成两种强酸,该反应的化学方程式为
的水溶液发生反应生成两种强酸,该反应的化学方程式为___________ 。将足量单质X通入含有2mol 溶液中充分反应,转移电子的数目为
溶液中充分反应,转移电子的数目为___________ ( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(3)与Q同周期的元素的基态原子中,最外层电子数与Q原子相同的元素有哪些?___________
(4)将W、X、Y、Z的简单离子,按照微粒半径由小到大的顺序排列___________ (用元素符号表示)
(5)关于元素Z的判断,正确的是___________
(6)Z元素的一种相邻元素,其基态原子的轨道表示式是下图中的___________ (填序号),另一轨道表示式不能作为基态原子的轨道表示式是因为它不符合___________ (填字母)。

A.能量最低原理 B.泡利原理 C.洪特规则 D.构造原理
(7)对于基态Q原子,下列叙述正确的是___________。
(8)阅读以下核电荷数为21-25的元素的最高正化合价,回答下列问题:
对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律是___________
| 元素编号 | 元素的性质与原子结构 |
| W | 基态原子有5个原子轨道填充有电子,有3个未成对电子 |
| X | 最外层电子数为奇数的第三周期元素,其气态氢化物遇W的气态氢化物产生大量白烟 |
| Y | 基态原子有16个不同运动状态的电子 |
| Z | 周期数=族序数,简单离子最外层电子数为8 |
| Q | 基态原子在前四周期中未成对电子数最多 |
(2)
 与足量的
与足量的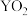 的水溶液发生反应生成两种强酸,该反应的化学方程式为
的水溶液发生反应生成两种强酸,该反应的化学方程式为 溶液中充分反应,转移电子的数目为
溶液中充分反应,转移电子的数目为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。(3)与Q同周期的元素的基态原子中,最外层电子数与Q原子相同的元素有哪些?
(4)将W、X、Y、Z的简单离子,按照微粒半径由小到大的顺序排列
(5)关于元素Z的判断,正确的是___________
| A.Z元素的焰色反应为黄色 |
| B.Z元素最高价氧化物对应水化物为强碱 |
| C.Z元素的第一电离能高于同周期左右相邻元素 |
| D.Z元素在失去第三个电子之后,电离能发生突变 |

A.能量最低原理 B.泡利原理 C.洪特规则 D.构造原理
(7)对于基态Q原子,下列叙述正确的是___________。
| A.因为轨道处于半充满时体系总能量低,所以Q核外电子排布结果中未成对电子数最多。 |
| B.因为4s电子能量较高,一定在比3s电子离核更远的地方运动 |
| C.Q电负性比钾高,原子对键合电子的吸引力比钾大 |
| D.Q的价电子排布与钾原子相同 |
| 元素名称 | 钪 | 钛 | 钒 | 铬 | 锰 |
| 元素符号 | Sc | Ti | V | Cr | Mn |
| 核电荷数 | 21 | 22 | 23 | 24 | 25 |
| 最高正价 | +3 | +4 | +5 | +6 | +7 |
您最近一年使用:0次
真题
名校
4 . X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是
| A.X的原子半径一定大于Y的原子半径 |
| B.X与Y的简单离子不可能具有相同的电子层结构 |
| C.两元素形成的化合物中,原子个数比不可能为1 :1 |
| D.X2Y可能是离子化合物,也可能是共价化合物 |
您最近一年使用:0次
2019-01-30更新
|
2132次组卷
|
48卷引用:上海市交通大学附属中学2017-2018学年高二上学期第一次月考化学试题1
上海市交通大学附属中学2017-2018学年高二上学期第一次月考化学试题1上海市交通大学附属中学2017-2018学年高二上学期第一次月考化学试题2上海交通大学附属中学2017-2018学年高二上学期第一次月考化学试题上海市交通大学附属中学2017-2018学年高二上学期第一次月考化学试题3上海市高二上学期第二章《初识元素周期律》综合测试题(已下线)上海市上海交通大学附属中学2017-2018学年高二10月月考化学试题上海市曹杨第二中学2021-2022学年高二上学期期末考试化学试题(已下线)2014届上海市长宁区高三上学期期末(一模)考试化学试卷2015-2016学年山西省右玉一中高二5月月考化学试卷2015-2016学年山西省朔州市右玉一中高二下5月月考化学试卷安徽省池州市东至二中2020-2021学年高二下学期开年考化学试题2007年普通高等学校招生全国统一考试(北京卷)理综化学部分(已下线)2010-2011学年辽宁省师大附中高一下学期期中考试化学试卷(已下线)2010-2011年北京市师大附中高一下学期期中考试化学试卷(已下线)2011-2012学年福建省南安一中高一下学期期末考试化学试卷(已下线)2011-2012学年甘肃省武威五中高一下学期期末考试化学试卷(已下线)2012-2013学年北京市房山区房山中学高一下学期期中考试化学试卷(已下线)2012-2013学年云南省昆明三中高一下学期期末考试文科化学试卷(已下线)2012-2013学年山东省菏泽市牡丹区高一下学期期末考试化学试卷(已下线)2012-2013学年北京市西城区(南区)高一下学期期末考试化学试卷2014-2015陕西省宝鸡市扶风高中高一4月月考化学试卷2016届河北省行唐启明中学高三上学期12月月考化学试卷2015-2016学年福建省厦门六中高一下学期期中化学试卷2015-2016学年河北省唐山一中高一下期中化学试卷2015-2016学年河北省广平县一中高一下学期期中考试化学试卷2015-2016学年江苏省宿迁市沭阳县高一下学期期中考试化学试卷2015-2016学年山西省长治一中高一平行班下期中化学试卷2015-2016学年重庆一中高一下期末化学试卷12015-2016学年陕西省西安七十中高一下学期期末化学试卷2015-2016学年重庆一中高一下期末化学试卷22015-2016学年福建省南平市建瓯二中高一下学期第一次月考化学试卷2017届河北省定州中学高三上第一次月考化学试卷河北省张家口市第一中学2016-2017学年高一下学期期中考试(实验班、普通班)(文)化学试题宁夏石嘴山市第三中学2016-2017学年高一下学期第二次(5月)月考化学试题陕西省西安市碑林区西安建筑科技大学附属中学2016-2017学年高一下学期期末考试化学试题山东省惠民县第一中学2018-2019学年高一下学期联考化学试题湖南省湘南中学2018-2019学年高一下学期期中考试化学试题吉林省长春市九台区第四中学2018-2019学年高一下学期期中考试化学试题河北省宣化市第一中学2019-2020学年高一11月月考化学试题2020届高三化学选修三二轮专题复习—— 离子键、离子化合物专题1微观结构与物质的多样性易错疑难集训(二)河北省唐山遵化市2018-2019学年高一下学期期中考试化学试题安徽省滁州市明光市明光中学2019-2020高一下学期第二次月考化学试题高一必修第一册(苏教2019版)专题5 易错疑难集训(二)(已下线)第1章 物质结构 元素周期律(基础过关卷)-2020-2021学年高一化学必修2章末集训必刷卷(人教版)江西省抚州市南城一中2020-2021学年高一下学期5月月考化学试题(已下线)专题5 微观结构与物质的多样性 综合评价(2)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)四川省眉山市仁寿县2023-2024学年高一上学期1月期末化学试题
名校
解题方法
5 . 图中是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )


| A.原子半径:Z>Y>X |
| B.气态氢化物稳定性:R<W |
| C.WX3和水反应生成的化合物是离子化合物 |
| D.Y和Z两者最高价氧化物对应的水化物能相互反应 |
您最近一年使用:0次
2020-03-25更新
|
684次组卷
|
47卷引用:2015-2016学年上海市理工大学附属中学高二上学期期中测试化学试卷
2015-2016学年上海市理工大学附属中学高二上学期期中测试化学试卷上海市向明中学2018-2019学年高二第一学期期末考试化学试题(已下线)2012-2013学年湖北省黄冈中学高二上学期期中考试化学试卷(已下线)2012-2013学年山西省晋中市昔阳中学高二下学期期末考试化学试卷(已下线)2014届上海市长宁区高三上学期期末(一模)考试化学试卷2016-2017学年上海市金山区高三上期期末质量调研化学试卷云南省腾冲市第八中学2018-2019学年高二上学期期中考试化学试题吉林省长春汽车经济开发区第三中学2018-2019学年高二下学期4月月考化学试题(已下线)【新东方】2020-82(已下线)上海市宝山区2014届高三上学期期末教学质量监测化学试题上海市宝山区交大附中2017-2018学年高三上学期期中考试化学试题上海市行知中学2021届高三下学期3月月考化学试题(已下线)2011-2012年黑龙江龙东地区高一下学期期末考试化学试卷(已下线)2011-2012学年吉林省长春市十一高中高一下学期期末考试化学试卷(已下线)2013届黑龙江省大庆实验中学高三上学期开学考试化学试卷(已下线)2012-2013学年四川省成都外国语学校高一下学期期中考试化学试卷(已下线)2013届山东省泰安市高三第二轮复习质量检测理综化学试卷(已下线)2014年高考化学一轮复习课后规范训练5-2练习卷(已下线)2014届江西省南昌一中、南昌十中高三上学期联考化学试卷(已下线)2013-2014湖北省黄石市三中高一下学期期中考试化学试卷2014-2015学年河北省广平县第一中学高一4月月考理科化学试卷2014-2015学年吉林省长春市十一中高一下期中化学试卷2014-2015学年内蒙古霍林郭勒市第三中学高一下期中考试化学试卷2014-2015学年福建省永春美岭中学高一下学期期中考试化学试卷2015-2016学年江苏省清江中学高一下学期周练化学试卷2015-2016学年河北省定兴三中高一下3月月考(文)化学试卷辽宁省葫芦岛高级中学2015-2016学年高一下第一次月考化学卷2015-2016学年陕西西安长安一中高一下第一次月考化学卷2015-2016学年河南省周口市商水一中高一下学期期中考试化学试卷2015-2016学年福建省清流一中高一实验班下第三段测化学试卷2016-2017学年重庆第二外国语学校高一下学期3月份月考化学试卷2016-2017学年江西省南昌市第二中学高一下学期第一次月考化学试卷河北省石家庄市第一中学2016-2017学年高一下学期期中考试化学试题山西省大同市第一中学2017-2018学年高一3月月考化学试题福建省莆田第六中学2017-2018学年高一6月月考B化学试题山西省实验中学2017-2018学年高一下学期第一次月考化学试题安徽省砀山县第二中学2018-2019学年高一下学期第一次月考化学试题江苏省苏州市西安交通大学苏州附属中学2019-2020学年高一下学期自主检测化学试题山西省运城市永济涑北中学2019-2020学年高一下学期3月月考化学试题广东省茂名市信宜中学2019-2020学年高一下学期级线上段考化学试题北京市东城区北京景山学校2019~2020学年高一下学期期末考试化学试题贵州省铜仁市伟才学校2019-2020学年高一下学期期末考试化学(理)试题(已下线)5.1.2 元素周期表 元素周期表的应用练习(2)——《高中新教材同步备课》(苏教版 必修第一册)(已下线)第04章 物质结构 元素周期律(A卷基础强化篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)(已下线)第18讲 元素周期律和元素周期表(精练)-2021年高考化学一轮复习讲练测甘肃省会宁县第一中学2020-2021学年高一下学期期中考试化学试题河南省洛阳市2021-2022学年高一上学期期末考试化学试题
名校
6 . 1869年,俄国化学家门捷列夫编制了一份元素周期表,随着不断地研究和修正,现代的元素周期表逐渐发展大家所熟知的这种常见形式。
(1)一种药物的分子结构如图所示,其中X、Y、Z、W、M是原子序数依次增大的短周期主族元素,M的原子序数为W的两倍。下列说法中错误的是_____ (单选)。

(2)下列关于元素周期表的说法正确的是_____ (单选)。
I.海水中含有大量的氯化钠,是生活中和人体内不可或缺的,也被用来生产各种含氯和含钠的制品,为人们的日常生活和化学工业提供重要的原料。氯元素的“价类二维图”的部分信息如图。

(3)写出Cl2和水反应生成Z的离子方程式______ 。
(4)用化学方程式表示84消毒液在空气中的漂白原理______ 。
Ⅱ.为探究原电池和电解池的工作原理,某研究性小组分别用如图所示装置进行实验。

(5)甲装置中,a电极的反应式为______ 。
(6)乙装置对应的氯碱工业中,使用阳离子交换膜的好处是______ 。
(7)用如图示的方法可以保护钢质闸门。下列说法正确的是______ (不定项)

(1)一种药物的分子结构如图所示,其中X、Y、Z、W、M是原子序数依次增大的短周期主族元素,M的原子序数为W的两倍。下列说法中错误的是

| A.YM2的键角为180° |
| B.X、Z、W只能形成共价化合物 |
| C.第一电离能:Z>W>Y |
| D.Z、W分别与X形成的最简单化合物中,W所形成的化合物热稳定性最高 |
| A.IA族元素全部是金属元素,称为碱金属元素 |
| B.元素周期表第15列全为非金属元素 |
| C.元素周期表中电负性最强的元素是Cl |
| D.在过渡元素区域可以寻找优良的催化剂 |
I.海水中含有大量的氯化钠,是生活中和人体内不可或缺的,也被用来生产各种含氯和含钠的制品,为人们的日常生活和化学工业提供重要的原料。氯元素的“价类二维图”的部分信息如图。

(3)写出Cl2和水反应生成Z的离子方程式
(4)用化学方程式表示84消毒液在空气中的漂白原理
Ⅱ.为探究原电池和电解池的工作原理,某研究性小组分别用如图所示装置进行实验。

(5)甲装置中,a电极的反应式为
(6)乙装置对应的氯碱工业中,使用阳离子交换膜的好处是
(7)用如图示的方法可以保护钢质闸门。下列说法正确的是

| A.当a、b间用导线连接时,X可以是锌棒,X上发生氧化反应 |
| B.当a、b间用导线连接时,X可以是锌棒,电子经导线流入X |
| C.当a、b与外接电源相连时,a应连接电源的正极 |
| D.当a、b与外接电源相连时,阴极的电极反应式:2Cl--2e-=Cl2↑ |
您最近一年使用:0次
解题方法
7 . 下表为部分短周期元素的性质或原子结构
下列说法正确的是
| 元素编号 | 元素性质或原子结构 |
X | 原子核外p电子数比s电子数多1 |
Y | 最高价氧化物对应水化物为一元强酸 |
Z | 所形成的的离子与氖原子核外电子排布相同且带2个单位电荷 |
| A.若原子半径X<Y,则相应气态氢化物的热稳定性一定有X>Y |
| B.若原子序数X>Z,则相应简单离子半径一定有X<Z |
| C.若Y与Z位于同一周期,则原子半径一定有Y<Z |
| D.若X与Z位于同一周期,则原子核外未成对电子数一定有X<Z |
您最近一年使用:0次
名校
解题方法
8 . A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如图所示。A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素。下列说法错误的是
| B | C |
| D |
| A.简单离子的半径大小关系:B>C>E |
| B.C元素的气态氢化物比D元素的气态氢化物稳定是氢键的缘故 |
C.由A、B两种元素组成的离子化合物 中,阴、阳离子个数比为1:1 中,阴、阳离子个数比为1:1 |
| D.由C、D、E三种元素组成的某种化合物,其水溶液能与盐酸反应产生沉淀 |
您最近一年使用:0次
2021-05-28更新
|
206次组卷
|
10卷引用:上海市华东师大二附中2016-2017学年高二(上)月考化学试卷(12月份)
上海市华东师大二附中2016-2017学年高二(上)月考化学试卷(12月份)四川省成都外国语学校2020-2021学年高二4月月考化学试题福建省南安市柳城中学2020-2021学年高二下学期期中考试化学试题(已下线)化学(上海B卷)-学易金卷:2023年高考第一次模拟考试卷广东番禺中学2022-2023学年高二下学期科开学考试化学试题天津市2022-2023学年高二下学期期末练习化学试题四川省眉山市仁寿第一中学南校区2022-2023学年高二下学期期末模拟理科综合化学试题(已下线)2014届浙江省温州市高三第一次适应性测试理综化学试卷2015-2016学年浙江省温州中学高一下期末化学试卷【全国百强校】浙江省杭州市第二中学2019届高三第二学期选考模拟卷化学试题
名校
9 . 已知X、Y、Z、W、M均为短周期主族元素。25℃时,各元素最高价氧化物对应水化物溶液(浓度均为0.01mol/L)的pH和原子半径的关系见下图。下列判断错误的是


| A.非金属性:W>Z | B.最高正价:Y<Z |
| C.单质熔点:X<Y | D.简单离子半径:X>M |
您最近一年使用:0次
2020-12-29更新
|
312次组卷
|
3卷引用:上海市黄浦区格致中学2020-2021学年高二上学期期末化学试题
名校
10 . 有4种短周期主族元素X、Y、Z和Q的原子序数依次增大,相关信息如表:
下列说法正确的是
| 元素 | 相关信息 |
| X | 最外层电子数等于次外层电子数 |
| Y | 与X在同一主族 |
| Z | 单质为淡黄色固体,常存在于火山喷口附近 |
| Q | 同周期主族元素中原子半径最小 |
| A.X的金属性比Y强 | B.Y的离子半径是同周期中最小的 |
| C.Q的气态氢化物比Z的气态氢化物定 | D.Q的含氧酸是最强酸 |
您最近一年使用:0次



