名校
解题方法
1 . X、Y、Z、W四种短周期主族元素的原子序数依次增大。其中仅有X、Y与Z位于同一周期,且只有X、Y元素相邻。基态X原子核外有2个未成对电子,W原子的原子半径在同周期中最大。下列说法正确的是
| A.最简单氢化物沸点:X>Y | B.第一电离能:Y>Z>X |
| C.电负性:Z>Y>X>W | D.X、Y、Z均有对应的最高价含氧酸 |
您最近一年使用:0次
2024-04-02更新
|
203次组卷
|
2卷引用:宁夏吴忠市青铜峡市宁朔中学2023-2024学年高二下学期3月月考化学试题
名校
2 . 短周期主族元素W、X、Y、Z的原子序数依次增加。K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一、丙溶液为二元强酸,上述物质的转化关系如图所示。下列说法正确的是
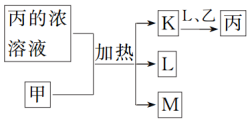
| A.W、X、Y、Z可形成四种常见的具有漂白性的单质或化合物,包含了三种漂白原理 |
| B.K、L、M中键角大小为:K>L>M |
| C.元素的非金属性:Z>Y>X |
| D.丙不能由无单质参加的化合反应制得 |
您最近一年使用:0次
2024-02-29更新
|
104次组卷
|
2卷引用:宁夏银川市贺兰县第一中学2023-2024学年高二下学期第一阶段考试化学试卷
名校
解题方法
3 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请回答下列问题。
(1)A在元素周期表中的位置为___________ ,画出基态B原子的轨道表示式___________ 。
(2)B的简单气态氢化物的沸点___________ (填“高于”或“低于”)PH3,原因是___________ 。
(3)A、B、C三种元素的电负性由高到低的排列次序为___________ (用元素符号表示)。
(4)已知元素A、B形成的 链状分子中所有的原子都满足8电子稳定结构,则其分子中
链状分子中所有的原子都满足8电子稳定结构,则其分子中 键与
键与 键数目之比为
键数目之比为___________ 。
(5)G元素可形成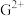 、
、 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是___________ 。
(6)短周期元素 与元素
与元素 在周期表中的位置呈现对角线关系,已知元素
在周期表中的位置呈现对角线关系,已知元素 、
、 的电负性分别为1.5和3.0,预测它们形成的化合物是
的电负性分别为1.5和3.0,预测它们形成的化合物是___________ (填“离子”或“共价”)化合物。推测 的最高价氧化物对应的水化物
的最高价氧化物对应的水化物___________ (填“能”或“不能”)与 的最高价氧化物对应水化物发生反应。
的最高价氧化物对应水化物发生反应。
| A | 原子核外有6个电子 |
| B | 原子序数比 大1 大1 |
| C | 基态原子中 电子总数与p电子总数相等 电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子价层电子排布式为3s23p1 |
| F | 基态原子的最外层p 轨道有2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 生活中使用最多的一种金属,其高价氯化物的盐溶液常用于刻蚀铜制印刷电路板 |
(2)B的简单气态氢化物的沸点
(3)A、B、C三种元素的电负性由高到低的排列次序为
(4)已知元素A、B形成的
 链状分子中所有的原子都满足8电子稳定结构,则其分子中
链状分子中所有的原子都满足8电子稳定结构,则其分子中 键与
键与 键数目之比为
键数目之比为(5)G元素可形成
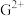 、
、 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是(6)短周期元素
 与元素
与元素 在周期表中的位置呈现对角线关系,已知元素
在周期表中的位置呈现对角线关系,已知元素 、
、 的电负性分别为1.5和3.0,预测它们形成的化合物是
的电负性分别为1.5和3.0,预测它们形成的化合物是 的最高价氧化物对应的水化物
的最高价氧化物对应的水化物 的最高价氧化物对应水化物发生反应。
的最高价氧化物对应水化物发生反应。
您最近一年使用:0次
2022-07-25更新
|
962次组卷
|
3卷引用:宁夏石嘴山市第三中学2023-2024学年高二下学期3月月考化学试题
名校
4 . 四种常见元素的性质或结构信息如表所示,请问答下列问题。
(1)R的基态原子价层电子排布式为_______ ,这四种元素的电负性由大到小的顺序为_______ (写元素符号)。
(2)A、B、D均可形成多种氢化物,其中分子构型为三角锥的氢化物分子式为_______ ,分子构型为正四面体的氢化物分子式为_______ ,中心原子存在 、
、 两种杂化类型的物质的结构式为
两种杂化类型的物质的结构式为_______ 。与A的常见单质互为等电子体的上述元素的氧化物分子式为_______ 。
| 元素 | A | B | R | D |
| 相关信息 | 基态原子核外电子占据3个能级且最高能级上有3个电子 | B的单质是最常见半导体材料 | 位于第四周期ⅠB族 | 是非金属元素,其形成的某种单质是电的良导体,有的分子形状似足球 |
(2)A、B、D均可形成多种氢化物,其中分子构型为三角锥的氢化物分子式为
 、
、 两种杂化类型的物质的结构式为
两种杂化类型的物质的结构式为
您最近一年使用:0次
名校
解题方法
5 . X、Y、Z、W四种短周期元素位于三个不同的周期,Y、Z同周期且四种元素原子序数依次增大。它们能形成结构如图所示的分子,下列推断错误的是


| A.X、Z原子之间形成的是极性共价键 |
| B.Z的氢化物分子间存在氢键,沸点一定高于Y的氢化物 |
| C.Y、Z、W分别与X可形成18电子分子 |
| D.最高价含氧酸的酸性:W> Y |
您最近一年使用:0次
2022-02-20更新
|
242次组卷
|
3卷引用:宁夏六盘山高级中学2021-2022学年高二下学期第一次月考化学试题
名校
6 . 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示。R原子最外层电子数是电子层数的2倍。Y与Z能形成Z2Y、Z2Y2型离子化合物。Z与T形成的化合物Z2T能破坏水的电离平衡。下列推断正确的是
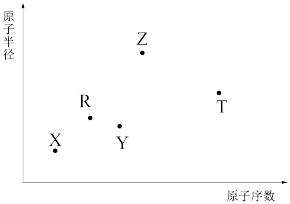

| A.离子半径由小到大顺序:X<Y<Z<T |
| B.氢化物沸点一定存在:Y>R |
| C.最高价氧化物对应水化物酸性:T>R |
| D.由X、T、Y、Z四种元素组成的化合物水溶液一定显碱性 |
您最近一年使用:0次
2022-01-10更新
|
67次组卷
|
2卷引用:宁夏平罗中学2022-2023学年高二下学期期末考试(重点班)化学试题
名校
解题方法
7 . X、Y、Z、W为原子序数依次增大的短周期主族元素,Y、Z同周期,W、Z同主族,X和Z可形成一种常温常压下无色无味的液体,Y是形成化合物种类最多的元素。下列说法正确的是
| A.Y的氢化物的沸点一定小于Z的氢化物沸点 |
| B.W的氧化物对应的水化物是一种强酸 |
| C.Y可分别与Z、W形成含极性键的非极性分子 |
| D.Y和W所形成的单质均具有较高的硬度和熔点 |
您最近一年使用:0次
2021-12-03更新
|
319次组卷
|
3卷引用:宁夏石嘴山市平罗中学2021-2022学年高二上学期期末考试化学试题
宁夏石嘴山市平罗中学2021-2022学年高二上学期期末考试化学试题重庆市第一中学2021-2022学年高三上学期半期考试化学试题(已下线)专题33 元素的综合推断-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
8 . X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)元素X的原子中能量最高的是_______ 电子,它的氢化物的电子式是_______ 。
(2)元素Y位于元素周期表的第三周期_______ 族,该原子的价电子轨道表示式为_______ 。
(3)元素Z的原子最外层共有_______ 种不同运动状态的电子。
(4)W的基态原子核外电子排布式是_______ 。
(5)元素Y与元素Z相比,非金属性较强的是_______ (用元素符号表示),下列表述中能证明这一事实的是_______ 。
a.常温下,Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.Z的电负性大于Y
d.Z的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
f.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且最高能级是半充满状态 |
| Y | 第三周期元素,它的单质是良好的半导体材料 |
| Z | Z和Y同周期,Z是本周期原子半径最小的主族元素 |
| W | W的一种核素的质量数为63,中子数为34 |
(2)元素Y位于元素周期表的第三周期
(3)元素Z的原子最外层共有
(4)W的基态原子核外电子排布式是
(5)元素Y与元素Z相比,非金属性较强的是
a.常温下,Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.Z的电负性大于Y
d.Z的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
f.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
您最近一年使用:0次
名校
9 . 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为产生温室效应的主要气体。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24, ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为_______ 。
(2)B的氢化物分子的立体构型是_______ 其中心原子采取_______ 杂化。
(3)写出化合物AC2的电子式_______ ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为_______ 。
(4)E的核外电子排布式是_______ ,ECl3形成的配合物的化学式为_______ 。
(5)元素A的原子核外共有_______ 种不同运动状态的电子,有_______ 种不同能级的电子,能量最高的是_______ 电子
(1)A、B、C的第一电离能由小到大的顺序为
(2)B的氢化物分子的立体构型是
(3)写出化合物AC2的电子式
(4)E的核外电子排布式是
(5)元素A的原子核外共有
您最近一年使用:0次
名校
10 . 已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价的绝对值相等,Z的核电荷数是Y的2倍,W的最外层电子数是最内层电子数的3倍。下列说法不正确 的是
| A.化合物YR4中各原子均满足8电子稳定结构 |
| B.对应的离子半径:Z<R<W |
| C.W与X、W与Y形成的化合物化学键类型完全相同 |
| D.R的氧化物对应的水化物是强酸 |
您最近一年使用:0次
2021-04-22更新
|
121次组卷
|
2卷引用:宁夏吴忠中学2020-2021学年高二下学期期中考试化学试题



