名校
解题方法
1 . 元素周期表被认为是“科学共同的语言”,它的发现使化学学习和研究变得有规律可循。其简洁有序的背后,是众多科学家艰苦奋斗的结果。下图是元素周期表的一部分。请按要求回答下列问题:
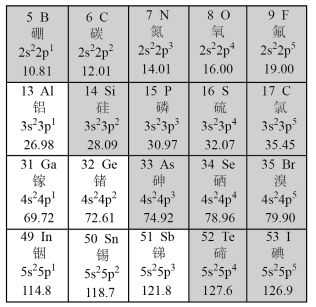
(1)317年左右,东晋炼丹家葛洪在炼丹时分离出了砷。砷在周期表中的位置是___________ 。我国“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。原子半径:Ga___________ As(填“>”或“<”)。
(2)1787年,法国化学家拉瓦锡首次发现硅存在于岩石中。根据硅元素在周期表中的位置请写出硅单质的一种用途___________ 。
(3)1817年瑞典化学家贝采利乌斯发现硒元素。硒元素和溴元素最高价氧化物水化物酸性较强的是___________ (填化学式)。
(4)1825年,丹麦化学家奥斯特首次分离出了铝的单质。铝是地壳中含量最高的金属元素,但铝的利用却比铜和铁晚得多,可能的原因是___________ 。往氯化铝溶液中滴入过量氨水,写出该反应的离子方程式___________ 。
(5)目前,世界上还有许多科学家为发现新元素孜孜不倦地努力。可能存在的第119号元素,有人称“类钫”,位于元素周期表第八周期ⅠA族。有关“类钫”的预测正确的是_____
(6)小赵同学在研究元素周期表时发现,碳元素有“2s22p2”这一信息。观察元素周期表后,寻找规律,推测某元素“nsxnpy”中x+y可能的含义是___________ 。

(1)317年左右,东晋炼丹家葛洪在炼丹时分离出了砷。砷在周期表中的位置是
(2)1787年,法国化学家拉瓦锡首次发现硅存在于岩石中。根据硅元素在周期表中的位置请写出硅单质的一种用途
(3)1817年瑞典化学家贝采利乌斯发现硒元素。硒元素和溴元素最高价氧化物水化物酸性较强的是
(4)1825年,丹麦化学家奥斯特首次分离出了铝的单质。铝是地壳中含量最高的金属元素,但铝的利用却比铜和铁晚得多,可能的原因是
(5)目前,世界上还有许多科学家为发现新元素孜孜不倦地努力。可能存在的第119号元素,有人称“类钫”,位于元素周期表第八周期ⅠA族。有关“类钫”的预测正确的是_____
| A.“类钫”在化合物中显+1价 | B.“类钫”单质具有强氧化性 |
| C.“类钫”最高价氧化物对应的水化物为弱碱 | D.“类钫”单质能与冷水剧烈反应 |
您最近一年使用:0次
名校
2 . 下表是元素周期表的一部分,请参照元素①~⑤在表中的位置,回答下列问题:
(1)⑧的最高价氧化物的水化物的化学式是___________ 。
(2)④、⑤、⑥、⑦四种元素的离子半径由大到小排序___________ (写离子符号)。
(3)元素③、④形成的简单气态氢化物的稳定性中较大的是___________ (填化学式)。
(4)⑤和③的最高价氧化物的水化物之间发生反应的离子方程式为___________ 。
(5)下列事实能判断⑤和⑥的金属性强弱的是___________ (填字母,下同)。
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
(6)硒(Se)位于第四周期,与④同主族。下列推断正确的是___________ 。
a. 只具有还原性
只具有还原性
b.Se的最低负化合价是-2价
c.Se的最高价氧化物对应水化物的酸性比 强
强
(7)同温同压下,0.2mol的⑤、⑥、⑦单质分别与100mL1mol/L的盐酸充分反应,产生氢气的体积比为___________ 。
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)④、⑤、⑥、⑦四种元素的离子半径由大到小排序
(3)元素③、④形成的简单气态氢化物的稳定性中较大的是
(4)⑤和③的最高价氧化物的水化物之间发生反应的离子方程式为
(5)下列事实能判断⑤和⑥的金属性强弱的是
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
(6)硒(Se)位于第四周期,与④同主族。下列推断正确的是
a.
 只具有还原性
只具有还原性 b.Se的最低负化合价是-2价
c.Se的最高价氧化物对应水化物的酸性比
 强
强(7)同温同压下,0.2mol的⑤、⑥、⑦单质分别与100mL1mol/L的盐酸充分反应,产生氢气的体积比为
您最近一年使用:0次
名校
3 . 离子液体在合成与催化、电化学、功能助剂、溶剂、分离过程、分析测试、功能材料等领域广泛应用,一种由短周期主族元素构成的典型离子液体阴离子结构如图所示,其中Y、X、Q、W是原子序数依次增大的同一周期元素。下列说法正确的是


| A.该阴离子中所有原子均达到8电子稳定结构 |
| B.该阴离子中X、Y两种原子的杂化方式相同 |
| C.氢化物的沸点:Y<Z<W |
| D.Y、X、Q三种元素的第一电离能:Q>X>Y |
您最近一年使用:0次
2023-12-06更新
|
420次组卷
|
2卷引用:福建省福州第一中学2023-2024学年高三上学期期末考试化学试题
解题方法
4 . 下表是元素周期表的一部分,表中所列的每个序号分别代表某一元素。
(1)元素①在周期表中的位置为___________ 。
(2)元素②最简单氢化物的电子式为___________ 。
(3)元素③、④、⑤简单离子半径由小到大的顺序是___________ (填离子符号)。
(4)手机、电脑、电视屏幕使用的都是含铟(In)的导电玻璃。已知In元素与元素⑤同主族,下列关于In的说法中正确的是___________ 。
a.最外层有5个电子 b.最高价氧化物对应的水化物碱性比⑤强
c.失电子能力比⑤弱 d.可与稀硫酸反应产生氢气
(5)元素⑥的最高价氧化物是我国研究量子态远程传输的核心材料,该物质属于___________ (填“离子”或“共价”)化合物,写出其与元素④的最高价氧化物对应的水化物反应的化学方程式为___________ 。
| ① | ② | ③ | ||||||
| ④ | ⑤ | ⑥ | ⑦ | |||||
(2)元素②最简单氢化物的电子式为
(3)元素③、④、⑤简单离子半径由小到大的顺序是
(4)手机、电脑、电视屏幕使用的都是含铟(In)的导电玻璃。已知In元素与元素⑤同主族,下列关于In的说法中正确的是
a.最外层有5个电子 b.最高价氧化物对应的水化物碱性比⑤强
c.失电子能力比⑤弱 d.可与稀硫酸反应产生氢气
(5)元素⑥的最高价氧化物是我国研究量子态远程传输的核心材料,该物质属于
您最近一年使用:0次
5 . 元素周期表部分结构如下,根据表中给出的6种元素,按要求作答:
(1)元素Z的原子结构示意图为___________ 。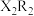 的电子式为
的电子式为___________ 。
(2)R、Y、T所形成的简单离子半径由大到小顺序为___________ (用离子符号表示)。
(3)R、T的简单气态氢化物中,较稳定的是___________ (填化学式,下同),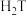 溶液在空气中变质的化学方程式为
溶液在空气中变质的化学方程式为___________ 。
(4)最高价氧化物对应水化物中,酸性最强的是___________ (填化学式)。
(5)Y与Q形成的化合物类型为___________ (填“离子化合物”或“共价化合物”)。
(6)Z的氧化物与Y的最高价氧化物对应水化物反应的离子方程式为_______ 。
(7)不能说明非金属性R强于T的事实是_______ 。
A.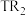 中T元素显正价
中T元素显正价
B. 的沸点比
的沸点比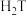 的沸点高
的沸点高
C.R、T的单质与 反应分别生成
反应分别生成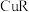 与
与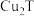
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | X | |||||||
| 2 | R | |||||||
| 3 | Y | Z | T | Q | ||||
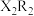 的电子式为
的电子式为(2)R、Y、T所形成的简单离子半径由大到小顺序为
(3)R、T的简单气态氢化物中,较稳定的是
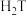 溶液在空气中变质的化学方程式为
溶液在空气中变质的化学方程式为(4)最高价氧化物对应水化物中,酸性最强的是
(5)Y与Q形成的化合物类型为
(6)Z的氧化物与Y的最高价氧化物对应水化物反应的离子方程式为
(7)不能说明非金属性R强于T的事实是
A.
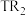 中T元素显正价
中T元素显正价B.
 的沸点比
的沸点比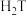 的沸点高
的沸点高C.R、T的单质与
 反应分别生成
反应分别生成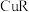 与
与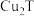
您最近一年使用:0次
解题方法
6 . 下表为元素周期表的一部分,请参照元素①~⑩在表中的位置,回答下列问题:
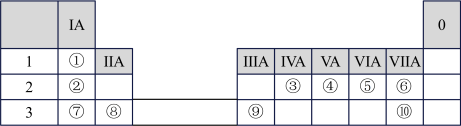
(1)自然界中,组成物质最多的元素在周期表中的位置是___________ 。上述元素中最高价氧化物对应的水化物碱性最强的是___________ (填化学式)。
(2)写出由①④⑩三种元素形成的一种盐的电子式___________ 。⑤⑦形成A2B2型化合物中所含的化学键类型为___________ 。
(3)⑥⑦⑨的简单离子半径由大到小的顺序为___________ (用离子符号表示)。
(4)根据对角线元素性质相似规则,写出②的最高价氧化物对应的水化物与稀硫酸反应的离子方程式:___________ 。
(5)①与④或⑤形成的两种10电子离子,在加热条件下能发生反应生成另两种10电子分子,写出对应的离子方程式:___________ 。
(6)⑥元素原子得电子能力强于⑩,请用原子结构知识解释其原因:___________ 。

(1)自然界中,组成物质最多的元素在周期表中的位置是
(2)写出由①④⑩三种元素形成的一种盐的电子式
(3)⑥⑦⑨的简单离子半径由大到小的顺序为
(4)根据对角线元素性质相似规则,写出②的最高价氧化物对应的水化物与稀硫酸反应的离子方程式:
(5)①与④或⑤形成的两种10电子离子,在加热条件下能发生反应生成另两种10电子分子,写出对应的离子方程式:
(6)⑥元素原子得电子能力强于⑩,请用原子结构知识解释其原因:
您最近一年使用:0次
7 . X、Y、Z、W、P、Q为短周期元素,其中Y的原子序数最小,它们的最高正价与原子半径关系如图所示。下列说法正确的是

| A.Y在元素周期表中位于p区 | B.第一电离能:Z>P>Q>X |
C.离子半径: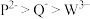 | D.氧化物对应水化物的酸性:Q>P>Z |
您最近一年使用:0次
2023-05-11更新
|
508次组卷
|
6卷引用:福建省福州市六校联考2022-2023学年高二下学期期末考试化学试题
福建省福州市六校联考2022-2023学年高二下学期期末考试化学试题湖南省郴州市2023-2024学年高二上学期期末教学质量监测化学试题新疆且末县第一中学2022-2023学年高二下学期6月期末考试化学试题福建省三明市第一中学2023-2024学年高二下学期3月月考化学试题山东烟台部分学校2023届高三下学期适应性练习(二)化学试题(已下线)第06练 元素“位—构—性”的综合推断 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)
名校
8 . 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为_______ (用元素符号表示)。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_______ (用分子式表示)。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的化学式_______ 。
(4)④和⑤形成的一种化合物若能与水发生化合反应,则该化合物电子式为_______ 。
(5)由表中两种元素的原子按1︰1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)_______ 。
a. b.
b. c.
c. d.
d.
(6)⑤、⑥各自的最高价氧化物对应水化物相互反应的离子方程式为:_______ 。
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的化学式
(4)④和⑤形成的一种化合物若能与水发生化合反应,则该化合物电子式为
(5)由表中两种元素的原子按1︰1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
a.
 b.
b. c.
c. d.
d.
(6)⑤、⑥各自的最高价氧化物对应水化物相互反应的离子方程式为:
您最近一年使用:0次
2023-02-27更新
|
244次组卷
|
2卷引用:福建省福州第一中学2022-2023学年高一上学期期末考试化学试题
9-10高二下·宁夏银川·期末
名校
解题方法
9 . 已知X、Y是主族元素,I为电离能,单位是kJ/mol。根据表中所列数据判断错误 的是
| 元素 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 578 | 1817 | 2745 | 11575 |
| A.元素X的常见化合价是+1价 |
| B.元素Y是ⅢA族的元素 |
| C.元素X与氯形成化合物时,化学式可能是XCl |
| D.若元素Y处于第3周期,它可与冷水剧烈反应 |
您最近一年使用:0次
2022-10-01更新
|
267次组卷
|
119卷引用:2015-2016学年福建省泉州市晋江市平山中学高二上期末化学试卷
2015-2016学年福建省泉州市晋江市平山中学高二上期末化学试卷福建省莆田市莆田第二十五中学2019-2020学年高二下学期期末考试化学试题(已下线)09~10年银川一中高二下学期期末考试化学卷(已下线)2010-2011学年福建省师大附中高二下学期期中考试化学试卷(已下线)2010—2011学年吉林省长春外国语学校高二下学期期末考试化学试卷理(已下线)2011-2012学年福建省厦门六中高二上学期期中考试化学(理)试卷(已下线)2014年7月山东省泰安市高二年级考试化学(物质结构与性质)试卷2014-2015福建省漳浦县三校高二下学期期中化学试卷2014-2015学年湖北省部分重点高中高二下期末考试化学试卷2014-2015学年山东省淄博市高二下学期期末统考化学试卷2015-2016学年福建省四地六校高二下学期第一次联考化学试卷2015-2016学年吉林省汪清六中高二下学期期末化学试卷2015-2016学年福建省漳州市芗城中学高二下期中理科化学试卷2016-2017学年福建省三明市第一中学高二下学期第一次月考化学试卷河南省西华县第一高级中学2017-2018学年高二下学期期末考试化学试题【全国校级联考】新疆昌吉市教育共同体四校2017-2018学年高二下学期期末联考化学试题陕西省西安中学2017-2018学年高二(平行班)下学期期末考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二上学期期末考试化学试题福建省莆田市第二十五中学2018-2019学年高二下学期第一次月考化学试题【校级联考】福建省龙岩市上杭县第一中学等六校2018-2019学年高二下学期期中考试化学试题福建省泉州市泉港区第一中学2018-2019学年高二下学期第二次月考化学试题广西蒙山县第一中学2017-2018学年高二下学期期末考试化学试题新疆石河子第二中学2018-2019学年高二下学期期末考试化学试题河北省邢台市第八中学2018-2019学年高二下学期期末考试化学试题陕西省西安中学2018-2019学年高二下学期期末考试化学试题宁夏石嘴山市第三中学2019-2020学年高二上学期期末考试化学试题黑龙江省哈尔滨市第六中学2019-2020学年高二上学期期末考试化学试题福建省泰宁第一中学2019-2020学年高二下学期第一次阶段考试化学试题陕西省宝鸡市渭滨区2019-2020学年高二下学期期末考试化学试题吉林省辽源市田家炳高级中学等友好学校2019-2020学年高二下学期期末考试化学试题福建省龙岩市武平县第一中学2021届高三上学期10月月考化学试题福建省泉州市四校(晋江磁灶中学等)2019-2020学年高二下学期期中联考化学试题福建省连城县第一中学2020-2021学年高二下学期第一次月考化学试题福建省永安市第三中学2020-2021学年高二3月月考化学试题福建省福州第一中学2020-2021学年高二下学期期中考试化学试题福建省南安市侨光中学2020-2021学年高二下学期期中阶段考试化学试题福建省南安市柳城中学2020-2021学年高二下学期期中考试化学试题黑龙江省饶河县高级中学2021-2022学年上学期期末考试化学试题湖南省长沙市周南中学2022-2023学年高二上学期期末考试化学试题宁夏吴忠中学2022-2023学年高二上学期期末考试化学试题.福建省三明第一中学2022-2023学年高二下学期期中考试化学试题山西省大同市云冈区汇林中学2022-2023学年高二下学期7月期末化学试题(已下线)2010年河南省郑州四十七中高三上学期第一次月考化学试题(已下线)2010-2011学年山东省兖州市高二下学期期中考试化学试卷(已下线)2011-2012学年河南许昌鄢陵一高高二下学期期中考试化学试卷(已下线)2012-2013学年江苏省启东中学高二下学期期中考试化学试卷(已下线)2014-2015学年四川成都树德协进中学高二10月阶段性考试化学试卷(已下线)2014-2015学年四川成都石室中学高二上10月考化学试卷2014-2015山西省太原市五中高二4月阶段形成检测化学试卷2014-2015学年河北省正定中学高二下第三次月考化学试卷2015-2016学年四川省雅安天全中学高二上学期11月月考化学试卷2015-2016学年山西太原五中高二下3月第二次周练化学卷2015-2016学年山东省淄博市高青一中高二4月月考化学试卷2015-2016学年吉林省辽源市田家炳高中高二下期中化学试卷2015-2016学年内蒙古元平煤高中高二实验班下期中化学卷安徽省蚌埠市第二中学2016-2017学年高二下学期期中考试化学试题四川省乐山沫若中学2017-2018学年高二上学期第一次月考化学试题【全国百强校】四川省南充高级中学2017-2018学年高二下学期期中化学试题【全国百强校】黑龙江省大庆市铁人中学2017-2018学年高二下学期期中考试化学试题黑龙江省鸡西市鸡东县第二中学2018-2019学年高二5月月考化学试题新疆乌鲁木齐市第四中学2018-2019学年高二下学期期中考试化学试题鲁科版高中化学选修三第一章《原子结构》单元测试题2020届高三化学二轮物质结构题型专攻——元素性质的递变规律【选择基础专练】2020届高三化学二轮物质结构题型专攻——元素性质的递变规律【选择提升专练】山东省烟台第二中学2019-2020学年高二上学期12月月考化学试题河南省林州市第一中学2019-2020学年高二3月线上调研考试(实验班)化学试题第1章 原子结构 易错疑难集训(二)——A学习区 夯实基础(鲁科版选修3)山东省泰安市肥城市泰西中学2019-2020学年高二下学期5月月考化学试题山西省忻州市第二中学2019-2020高二下学期3月考试化学试题吉林省通化市通化县综合高级中学2019-2020学年高二下学期期中考试化学试题甘肃省静宁县第一中学2019-2020学年高二下学期期中考试(第二次月考)化学试题(实验班)内蒙古通辽市2019-2020学年高二下学期期中考试化学试题山西省太原市山西大学附属中学2019-2020学年高二下学期5月化学试题天津地区2021届高三上学期期中考试模拟测化学试题鲁科版2019选择性必修2第1章 原子结构与元素性质 第3节 元素性质及其变化规律 第1课时 原子半径 元素的电离能(人教版2019)选择性必修2第一章 原子结构与性质 第二节 原子结构与元素的性质 第2课时 原子半径、元素的电离能及其变化规律(已下线)第一单元 原子结构(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)(已下线)1.3.1 电离能及其变化规律-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记宁夏吴忠市吴忠中学2020-2021学年高二3月月考化学试题山西省太原市第五中学2020-2021学年高二下学期4月阶段性检测化学试题吉林省长春市第二十九中学2020-2021学年高二下学期第一学程考试化学试题四川省邻水实验学校2020-2021学年高二下学期第一次月考化学试题四川省冕宁中学校2020—2021学年高二下学期半期考试化学试题宁夏银川市贺兰县景博高中2020-2021学年高二下学期期中考试化学试题山西省忻州市岢岚县中学2020-2021学年高二下学期4月月考化学试题宁夏长庆高级中学2020-2021学年高二上学期期中考试化学试卷甘肃省兰州二十七中学2020-2021学年高二下学期期中考试化学试题(已下线)作业02 原子结构与元素的性质-2021年高二化学暑假作业(人教版2019)(已下线)考点33 原子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)江西省九江市柴桑区第一中学2020-2021学年高二下学期5月月考化学试题(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)(已下线)第1章 原子结构与性质(章末检测)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)四川省广安代市中学校2020-2021学年高二下学期第一次月考化学试题辽宁省凌源市 2021-2022学年高二下学期开学考试化学试题陕西省宝鸡市长岭中学2021-2022学年高二下学期期中考试化学试题广东省江门市新会陈经纶中学2021-2022学年高二下学期期中考试化学试题内蒙古赤峰二中2021-2022学年高二下学期第二次月考化学试题吉林省长春市十一高中2021-2022学年高二下学期第二学程考试化学试题(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第38练 原子结构与元素的性质-2023年高考化学一轮复习小题多维练(全国通用)专题2 原子结构与元素性质 第二单元 元素性质的递变规律 第2课时 元素第一电离能和电负性的周期性变化新疆博尔塔拉蒙古自治州蒙古中学2020-2021学年高二下学期期中考试化学试题 第二节 原子结构与元素的性质 第2课时 元素周期律——原子半径、电离能、电负性的递变规律重庆市万州纯阳中学校2021-2022学年高二下学期期中考试化学试题安徽省滁州市定远县育才学校2021-2022学年高二下学期5月月考化学试题(已下线)第36讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第36讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(全国通用)河南省鄢陵县第一高级中学2021-2022学年高二下学期第三次考试化学试题四川省巴中市平昌县博雅学校2021-2022学年高二上学期第二次月考化学试题浙江省绍兴蕺山外国语学校2021-2022学年高二下学期第一次月考化学试题浙江省宁波效实中学2022-2023学年高二上学期期中考试化学试题陕西省武功县普集高级中学2022-2023学年高二下学期第一次月考化学试题新疆维吾尔自治区塔城地区2022-2023学年高二下学期5月期中化学试题广东省江门市开平市第二中学2021-2022学年高二下学期第7次段考化学试题2.2.2元素第一电离能和电负性的周期性变化 课中广东省湛江市第二中学2021-2022学年高二下学期第17周(6.11)周练化学试题 新疆生产建设兵团第二师八一中学2022-2023学年高二下学期期中考试化学试题(已下线)考点41 原子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
解题方法
10 . 部分含硫物质的分类与相应硫元素的化合价关系如图所示。下列说法正确的是
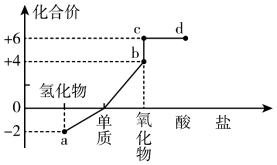

| A.a的稳定性弱于水 |
| B.S在过量氧气中燃烧可生成c |
| C.a、b都可用d的浓溶液干燥 |
| D.常温下,d的浓溶液与Fe反应可生成H2 |
您最近一年使用:0次
2022-10-01更新
|
167次组卷
|
2卷引用:福建省福州第四中学2022-2023学年高一上学期期末测试化学试题



