名校
1 . 一种用于合成治疗免疫疾病药物的物质,其结构如图所示,其中X、Y,Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述错误的是
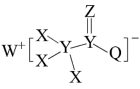
| A.上述物质中除X外均达到8电子稳定结构 |
| B.最高价氧化物对应的水化物的酸性:Q>Y |
| C.W与X、Z、Q形成的化合物中化学键类型均相同 |
| D.Z和X、Y、W、Q均形成至少两种二元化合物 |
您最近一年使用:0次
2024-05-07更新
|
127次组卷
|
2卷引用:广东省广州市第六中学2023-2024学年高一上学期期末考试化学试题
2 . W、X、Y为同一周期的四种主族元素,原子序数依次增大。基态Y原子的价电子排布为3s23p4,X的电离能数据如下表所示。
(1)Y在元素周期表中的位置是___________ 。
(2)为了进一步研究最高价氧化物对应水化物的酸碱性与元素金属性、非金属性的关系,查阅如下资料。
资料:ⅰ.某元素最高价氧化物对应的水化物脱水前的化学式通常可以表示为 ,该水化物中的M—O—H结构有两种断键方式:断M—O键在水中电离出OH-;断O—H键在水中离出H+。
,该水化物中的M—O—H结构有两种断键方式:断M—O键在水中电离出OH-;断O—H键在水中离出H+。
ⅱ.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一,水化物的M—O—H结构中,成键原子电负性差异越大,所形成的化学键越容易断。
①已知:O、H元素的电负性数值分别为3.5和2.1;某元素M的电负性数值为2.5,且电负性差异是影响M—O—H中化学键断裂难易程度的主要原因。该元素最高价氧化物对应的水化物呈___________ (填“酸”或“碱”)性,依据是___________ 。
②W和X的最高价氧化物对应的水化物中,碱性较强的是___________ (写化学式),结合资料说明理由:___________ 。
| 电离能 |  |  |  |  | … |
 | 738 | 1451 | 7733 | 10540 | … |
(2)为了进一步研究最高价氧化物对应水化物的酸碱性与元素金属性、非金属性的关系,查阅如下资料。
资料:ⅰ.某元素最高价氧化物对应的水化物脱水前的化学式通常可以表示为
 ,该水化物中的M—O—H结构有两种断键方式:断M—O键在水中电离出OH-;断O—H键在水中离出H+。
,该水化物中的M—O—H结构有两种断键方式:断M—O键在水中电离出OH-;断O—H键在水中离出H+。ⅱ.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一,水化物的M—O—H结构中,成键原子电负性差异越大,所形成的化学键越容易断。
①已知:O、H元素的电负性数值分别为3.5和2.1;某元素M的电负性数值为2.5,且电负性差异是影响M—O—H中化学键断裂难易程度的主要原因。该元素最高价氧化物对应的水化物呈
②W和X的最高价氧化物对应的水化物中,碱性较强的是
您最近一年使用:0次
2024-02-22更新
|
86次组卷
|
2卷引用:北京市汇文中学2023-2024学年高二上学期期末化学试题
名校
3 . 下面是元素周期表的一部分,表中的每个字母表示一种短周期元素,请回答下列问题: 在元素周期表中的位置是第三周期
在元素周期表中的位置是第三周期_____________ 族; 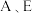 两种元素所形成的气态氢化物较稳定的是
两种元素所形成的气态氢化物较稳定的是_____________ (填化学式)。
(2)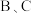 两元素的原子半径较小的是
两元素的原子半径较小的是_____________ (填元素符号)。
(3)非金属性最强的元素是_____________ (元素符号)。
(4) 是第四周期与
是第四周期与  同主族的元素。据此推测
同主族的元素。据此推测  不可能具有的性质是 (填字母)。
不可能具有的性质是 (填字母)。
(5)已知 元素位于元素周期表中第六周期第
元素位于元素周期表中第六周期第 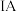 族,请回答下列问题:
族,请回答下列问题:
①铯的原子序数为_____________ 。
②铯单质与 反应的化学反应方程式为
反应的化学反应方程式为_____________ 。
③预测铯单质的还原性比钠单质的还原性_____________ (填“弱”或“强”)。
④下列推断正确的是_____________ (填字母)。
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子

 在元素周期表中的位置是第三周期
在元素周期表中的位置是第三周期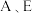 两种元素所形成的气态氢化物较稳定的是
两种元素所形成的气态氢化物较稳定的是(2)
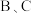 两元素的原子半径较小的是
两元素的原子半径较小的是(3)非金属性最强的元素是
(4)
 是第四周期与
是第四周期与  同主族的元素。据此推测
同主族的元素。据此推测  不可能具有的性质是 (填字母)。
不可能具有的性质是 (填字母)。A.在化合物中最高正化合价为  | B.单质可以与  气体反应并置换出单质 气体反应并置换出单质  |
| C.最高价氧化物对应水化物的酸性比硫酸弱 | D.单质在常温下可与氢气化合 |
(5)已知
 元素位于元素周期表中第六周期第
元素位于元素周期表中第六周期第 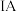 族,请回答下列问题:
族,请回答下列问题:①铯的原子序数为
②铯单质与
 反应的化学反应方程式为
反应的化学反应方程式为③预测铯单质的还原性比钠单质的还原性
④下列推断正确的是
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
您最近一年使用:0次
2024-02-22更新
|
82次组卷
|
2卷引用:黑龙江省哈尔滨市第一中学2023-2024学年高一上学期期末考试化学试题
名校
解题方法
4 . 短周期元素d、e、f、g、h、x都可能存在于某些食品添加剂中,其最高正化合价或最低负化合价与原子序数的关系如图所示,下列说法正确的是


| A.x、h、d三种元素组成的化合物只能为强酸 |
| B.f、g、h元素形成的简单离子的结构示意图相同 |
| C.f和h组成的化合物中只有离子键 |
| D.f与e、h的最高价氧化物对应的水化物均能反应 |
您最近一年使用:0次
名校
5 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
(1) A、B、C元素的第一电离能由小到大顺序为(写化学式,下同)___________ 。
(2)B元素所形成的单质分子中 键与
键与 键数目之比为
键数目之比为___________ 。
(3)D基态原子中能量最高的电子,原子轨道呈___________ 形。
(4)E基态原子的价电子的轨道表示式是___________ ,F元素的低价阳离子的离子结构示意图是___________ 。
(5)与D元素成对角线关系的某元素的最高价氧化物的水化物具有两性,写出该两性物质与NaOH反应的离子方程式:___________ 。
(6)G的单质和B的最高价氧化物的水化物的稀溶液可以反应,反应的离子方程式为:___________ 。
| 元素 | 相关信息 |
 | 原子核外有6种不同运动状态的电子 |
 | 基态原子中 电子总数与 电子总数与 电子总数相等的非金属元素 电子总数相等的非金属元素 |
 | 离子半径在同周期元素中最小 |
 | 基态原子的最外层 轨道有两个电子的自旋方向与其他电子的自旋方向相反 轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
 | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
 |  层全满, 层全满, 轨道上有1个电子 轨道上有1个电子 |
(2)B元素所形成的单质分子中
 键与
键与 键数目之比为
键数目之比为(3)D基态原子中能量最高的电子,原子轨道呈
(4)E基态原子的价电子的轨道表示式是
(5)与D元素成对角线关系的某元素的最高价氧化物的水化物具有两性,写出该两性物质与NaOH反应的离子方程式:
(6)G的单质和B的最高价氧化物的水化物的稀溶液可以反应,反应的离子方程式为:
您最近一年使用:0次
2024-02-19更新
|
120次组卷
|
2卷引用:安徽省六安第二中学2023-2024学年高二上学期期末考试化学试题
名校
6 . 已知X、Y为第三周期元素,且电负性X>Y,下列说法正确的是
| A.第一电离能Y一定小于X |
| B.简单气态氢化物的稳定性:X>Y |
| C.最高价含氧酸的酸性:Y>X |
| D.X和Y形成化合物时,X显正价,Y显负价 |
您最近一年使用:0次
2024-02-11更新
|
182次组卷
|
5卷引用:山东省菏泽市鄄城县第一中学2023-2024学年高二上学期1月期末化学试题
山东省菏泽市鄄城县第一中学2023-2024学年高二上学期1月期末化学试题(已下线)猜想01 原子结构与性质 【考题猜想】(8大题型)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)江西省部分学校2023-2024学年高二上学期1月期末化学试题(已下线)1.2.2 元素周期律课堂例题福建省南平市浦城第一中学2023-2024学年高二下学期4月期中考试化学试题
名校
7 . a、b、c、d、e、f、g、h是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息:a元素原子核外有6种不同运动状态的电子,c元素基态原子中s电子总数与p电子总数相等,d原子半径在同周期元素中最大,e元素基态原子最外层电子排布式为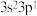 ,f元素的单质为黄绿色气体,可以制备用于杀菌消毒的消毒液,g元素的
,f元素的单质为黄绿色气体,可以制备用于杀菌消毒的消毒液,g元素的 价阳离子的
价阳离子的 能级为半充满状态,h元素的常见
能级为半充满状态,h元素的常见 价阳离子的硫酸盐水溶液呈蓝色,请完成下列各题:
价阳离子的硫酸盐水溶液呈蓝色,请完成下列各题:
(1)a元素在周期表中的位置是:________ 。
(2)b元素最简单氢化物与其最高价氧化物的水化物化合的产物是________ (填化学式)。0.1mol·L-1此溶液中各离子浓度由大到小的顺序是_________ 。
(3)f元素基态原子核外电子排布式是_________ ,其最高能级的电子云形状为_______ 。
(4)h元素的基态原子核外价层电子轨道表示式________ 。
(5)g元素的基态原子有___ 对成对电子,____ 个成单电子。
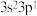 ,f元素的单质为黄绿色气体,可以制备用于杀菌消毒的消毒液,g元素的
,f元素的单质为黄绿色气体,可以制备用于杀菌消毒的消毒液,g元素的 价阳离子的
价阳离子的 能级为半充满状态,h元素的常见
能级为半充满状态,h元素的常见 价阳离子的硫酸盐水溶液呈蓝色,请完成下列各题:
价阳离子的硫酸盐水溶液呈蓝色,请完成下列各题:(1)a元素在周期表中的位置是:
(2)b元素最简单氢化物与其最高价氧化物的水化物化合的产物是
(3)f元素基态原子核外电子排布式是
(4)h元素的基态原子核外价层电子轨道表示式
(5)g元素的基态原子有
您最近一年使用:0次
2024-02-11更新
|
138次组卷
|
3卷引用:四川省合江县马街中学校2023-2024学年高二上学期1月期末化学试题
名校
8 . 随原子序数递增,八种短周期元素(用字母x、y等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。回答下列问题:

(1)d在元素周期表中的位置位于_____ ;写出z、d、e的简单离子半径由大到小的顺序______ (用离子符号表示)。
(2)金属 单质及其化合物的性质与
单质及其化合物的性质与 单质及其化合物的性质相似,写出鉴别
单质及其化合物的性质相似,写出鉴别 和
和 反应的化学方程式
反应的化学方程式_________ 。
(3)写出 的最简单氢化物的稳定性由强到弱的顺序
的最简单氢化物的稳定性由强到弱的顺序_____ (用化学式表示)。
(4) 与g相比,非金属性较强的是
与g相比,非金属性较强的是___ (用元素符号表示);得出该结论所依据的实验事实是_______ (只答一条)。
(5)用电子式表示 的最高价氧化物的形成过程:
的最高价氧化物的形成过程:________ 。
(6) 的一种氢化物分子
的一种氢化物分子 中既含非极性键又含极性键,其结构式为
中既含非极性键又含极性键,其结构式为____ 。

(1)d在元素周期表中的位置位于
(2)金属
 单质及其化合物的性质与
单质及其化合物的性质与 单质及其化合物的性质相似,写出鉴别
单质及其化合物的性质相似,写出鉴别 和
和 反应的化学方程式
反应的化学方程式(3)写出
 的最简单氢化物的稳定性由强到弱的顺序
的最简单氢化物的稳定性由强到弱的顺序(4)
 与g相比,非金属性较强的是
与g相比,非金属性较强的是(5)用电子式表示
 的最高价氧化物的形成过程:
的最高价氧化物的形成过程:(6)
 的一种氢化物分子
的一种氢化物分子 中既含非极性键又含极性键,其结构式为
中既含非极性键又含极性键,其结构式为
您最近一年使用:0次
2023-08-22更新
|
508次组卷
|
4卷引用:专题07 原子结构 化学键-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
(已下线)专题07 原子结构 化学键-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册) 山东省淄博实验中学2022-2023学年高一上学期期末考试化学试题(已下线)专题04 物质结构 元素周期律-【寒假自学课】2024年高一化学寒假提升学与练(人教版2019)(已下线)寒假作业11 化学键-【寒假分层作业】2024年高一化学寒假培优练(人教版2019必修第一册)
名校
解题方法
9 . Q、X、Y、Z是原子序数逐渐增大的短周期主族元素,其最外层电子数之和为15。X、Y、Z为同周期相邻元素,且均不与Q同族。下列说法正确的是
| A.非金属性:Z>Q | B.单质的导电性:Y<Z |
| C.原子半径半径:X<Z | D.最高价氧化物水化物的碱性:X>Y |
您最近一年使用:0次
2023-08-22更新
|
605次组卷
|
4卷引用:专题08 元素周期表与元素周期律-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
(已下线)专题08 元素周期表与元素周期律-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册) 山东省淄博实验中学2022-2023学年高一上学期期末考试化学试题(已下线)巩固测试卷01-【寒假自学课】2024年高一化学寒假提升学与练(人教版2019)(已下线)寒假作业10 元素周期律-【寒假分层作业】2024年高一化学寒假培优练(人教版2019必修第一册)
10 . 元素单质及其化合物有广泛用途,请根据周期表中第3周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是___________ 。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为___________ ,氧化性最弱的简单阳离子是___________ 。
(3)已知:
工业制镁时,电解MgCl2而不电解MgO的原因是___________ ;制铝时,电解Al2O3而不电解AlCl3的原因是___________ 。
(4)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是___________ 。
a.NH3 b.HI c.SO2 d.CO2
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
(4)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是
a.NH3 b.HI c.SO2 d.CO2
您最近一年使用:0次



