1 . 如图表示元素周期表中部分元素的某种性质(X值)随原子序数变化的关系示意图。___________ (填元素符号)。
(2)同主族内不同元素的X值变化的特点是___________ ;
(3)预测S元素与Se元素X值的大小关系为___________ ,X值最小的元素在元素周期表中的位置是___________ (放射性元素除外)。
(4)依据X值判断 是
是___________ (填共价化合物或离子化合物),如何通过实验来判断你的结论___________
(5)下列关于元素性质的说法正确的是___________ (填标号)。
a.X值可反映元素最高正化合价的变化规律
b.X值可反映元素在化合物中吸引电子的能力
c.X值的大小可用来判断元素金属性和非金属性的强弱

(2)同主族内不同元素的X值变化的特点是
(3)预测S元素与Se元素X值的大小关系为
(4)依据X值判断
 是
是(5)下列关于元素性质的说法正确的是
a.X值可反映元素最高正化合价的变化规律
b.X值可反映元素在化合物中吸引电子的能力
c.X值的大小可用来判断元素金属性和非金属性的强弱
您最近一年使用:0次
解题方法
2 . A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
请用化学用语填空:
(1)C元素和F元素的电负性比较,较小的是___________ 。
(2)B元素与宇宙中含量最丰富的元素形成的含有18 的分子的电子式为
的分子的电子式为___________ 。
(3)实验室用一种黄色溶液检验 时产生蓝色沉淀,该反应的离子方程式为
时产生蓝色沉淀,该反应的离子方程式为___________ ;与E元素成对角线关系的某元素的最高价氧化物的水化物具有两性,写出该两性物质与D元素的最高价氧化物的水化物反应的化学方程式:___________ 。
(4)氮、磷、砷等元素的单质及其化合物在生产生活中应用广泛。回答下列问题:
①处于下列状态的磷原子或离子失去最外层一个电子所需能量最高的是___________ (填标号)。
a. b.
b.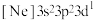 c.
c.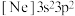 d.
d.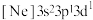
②M是氮杂氟硼二吡咯类物质,常用作光敏剂,其结构如图。 键,则该环N原子价层孤对电子填充在
键,则该环N原子价层孤对电子填充在___________ 轨道;M中存在的微粒间作用力有___________ (填标号)。
a.共价键 b.离子键 c.氢键 d.配位键
| 元素 | 相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 同周期元素原子的简单离子中半径最小 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
(1)C元素和F元素的电负性比较,较小的是
(2)B元素与宇宙中含量最丰富的元素形成的含有18
 的分子的电子式为
的分子的电子式为(3)实验室用一种黄色溶液检验
 时产生蓝色沉淀,该反应的离子方程式为
时产生蓝色沉淀,该反应的离子方程式为(4)氮、磷、砷等元素的单质及其化合物在生产生活中应用广泛。回答下列问题:
①处于下列状态的磷原子或离子失去最外层一个电子所需能量最高的是
a.
 b.
b.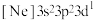 c.
c.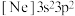 d.
d.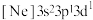
②M是氮杂氟硼二吡咯类物质,常用作光敏剂,其结构如图。

 键,则该环N原子价层孤对电子填充在
键,则该环N原子价层孤对电子填充在a.共价键 b.离子键 c.氢键 d.配位键
您最近一年使用:0次
3 . A、B、M、D、E、Q为周期表中前四周期元素,原子序数依次增大,A为周期表中电负性最大的元素,A-和D+的核外电子数相差为8,B与D同主族;M元素的阳离子半径在同周期元素中最小;E和Q的基态原子价电子层中的未成对电子数分别为4和2。用化学用语回答下列问题:
(1)元素Q在周期表中的位置___________ ;与Q同周期且具有相同的未成对电子数的元素有___________ 种。
(2)六种元素中第一电离能最小的是___________ (填元素符号),基态E原子的价电子排布式___________ 。
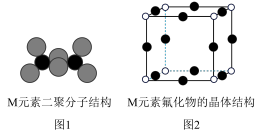
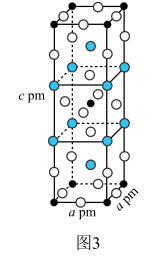
(3)元素M的氯化物常以二聚体的形式存在,其空间结构如图1所示,二聚体中M原子的轨道杂化类型为___________ 。元素M的氟化物的熔点为1090℃远高于其氯化物的熔点192℃,由此可以判断元素M的氟化物为___________ 晶体。元素M氟化物的晶体结构属立方晶系,晶胞如图2所示,F-的配位数为___________ 。
(4)A-、D+和Q2+三种离子形成的一种化合物的晶胞结构如图3所示(晶胞参数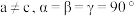 )该化合物的化学式为
)该化合物的化学式为___________ ,该晶体的密度为___________  (阿伏加德罗常数的值用
(阿伏加德罗常数的值用 表示)。
表示)。
(1)元素Q在周期表中的位置
(2)六种元素中第一电离能最小的是
(3)元素M的氯化物常以二聚体的形式存在,其空间结构如图1所示,二聚体中M原子的轨道杂化类型为

(4)A-、D+和Q2+三种离子形成的一种化合物的晶胞结构如图3所示(晶胞参数
 )该化合物的化学式为
)该化合物的化学式为 (阿伏加德罗常数的值用
(阿伏加德罗常数的值用 表示)。
表示)。
您最近一年使用:0次
解题方法
4 . 元素①~⑤在元素周期表中的位置如下表所示:
回答下列问题:
(1)原子半径最大的是___________ (填元素符号);简单离子半径最小的是___________ (填离子符号)。
(2)①、④简单气态氢化物的稳定性较强的是___________ (填化学式)。
(3)②、③最高价氧化物对应水化物之间反应的离子方程式为___________ 。
(4)④、⑤最高价氧化物对应水化物的酸性较强的是___________ (填化学式)。
| 周期 | 族 | |||||||
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ||||
(1)原子半径最大的是
(2)①、④简单气态氢化物的稳定性较强的是
(3)②、③最高价氧化物对应水化物之间反应的离子方程式为
(4)④、⑤最高价氧化物对应水化物的酸性较强的是
您最近一年使用:0次
名校
解题方法
5 . X、Y、Z、W、M、N是原子序数依次增大的前四周期元素,X的核外电子总数与其电子层数相同;Z和M同主族,且两者的单质室温下均为气体;W的原子序数为Y原子价电子数的3倍, 极易溶于水;基态
极易溶于水;基态 的d轨道半充满。由上述元素中的四种组成的两种化合物常用于合成阻燃材料,其结构简式如图所示。
的d轨道半充满。由上述元素中的四种组成的两种化合物常用于合成阻燃材料,其结构简式如图所示。

回答下列问题:
(1)基态W原子的价电子排布式为___________ ,其中电子占据最高能级的电子云轮廓图为___________ 形。写出N在周期表中的位置___________ 。
(2)W、M形成的一种化合物以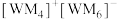 的形式存在,下列对
的形式存在,下列对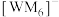 中心原子杂化方式推断合理的
中心原子杂化方式推断合理的___________ (填标号)。
a. b.
b. c.
c. d.
d.
(3)①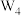 是W元素的常见单质,已知
是W元素的常见单质,已知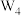 易溶于
易溶于 ,难溶于水,可能原因是
,难溶于水,可能原因是___________ 。
②W与M的第一电离能,W___________ M(填大于、小于或等于),从原子结构的角度解释原因___________ 。
(4)如果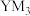 的水解产物是
的水解产物是 和HClO,则Y与M中电负性较大的是
和HClO,则Y与M中电负性较大的是___________ (填元素符号)。
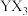 极易溶于水;基态
极易溶于水;基态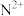 的d轨道半充满。由上述元素中的四种组成的两种化合物常用于合成阻燃材料,其结构简式如图所示。
的d轨道半充满。由上述元素中的四种组成的两种化合物常用于合成阻燃材料,其结构简式如图所示。
回答下列问题:
(1)基态W原子的价电子排布式为
(2)W、M形成的一种化合物以
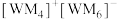 的形式存在,下列对
的形式存在,下列对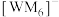 中心原子杂化方式推断合理的
中心原子杂化方式推断合理的a.
 b.
b. c.
c. d.
d.
(3)①
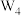 是W元素的常见单质,已知
是W元素的常见单质,已知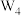 易溶于
易溶于 ,难溶于水,可能原因是
,难溶于水,可能原因是②W与M的第一电离能,W
(4)如果
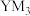 的水解产物是
的水解产物是 和HClO,则Y与M中电负性较大的是
和HClO,则Y与M中电负性较大的是
您最近一年使用:0次
6 . X、Y、Z、W、Q均为短周期主族元素。X是原子半径最小的元素;Y是地壳中含量最高的元素;Z是非金属性最强的元素,Z和W同主族;Q是短周期金属性最强的元素。回答下列问题:
(1)X与W形成化合物的电子式为_______ ;Y在元素周期表中的位置为_______ 。
(2) 属于
属于_______ (填“共价化合物”或“离子化合物”)。
(3)Z、W简单气态氢化物稳定性较强的是_______ (填化学式)。
(4)W、Q最高价氧化物对应水化物之间W、Q最高价氧化物对应水化物为_______ 。
(1)X与W形成化合物的电子式为
(2)
 属于
属于(3)Z、W简单气态氢化物稳定性较强的是
(4)W、Q最高价氧化物对应水化物之间W、Q最高价氧化物对应水化物为
您最近一年使用:0次
名校
7 . 现有原子序数依次递增且都小于36的X、Y、Z、Q、W五种元素,其中X是原子半径最小的元素,Y原子在基态时其最外层电子数是其内层电子数的2倍,Q原子在基态时其2p原子轨道上有2个未成对电子,W元素的原子中3d能级上有4个未成对电子。回答下列问题:
(1)化合物ZX3的沸点比化合物YX4的高,其主要原因是_______ 。
(2)元素W能形成多种配合物,其中W(CO)5在常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断W(CO)5晶体属于_______ (填晶体类型)晶体,该晶体中W的化合价为_______ 。
(3)下列说法正确的是_______ (填字母)。
A.分子晶体中,共价键的键能越大,该分子晶体的熔、沸点越高
B.电负性顺序:X<Y<Z<Q
C.因为CaO中的离子键比KCl的强,所以KCl比CaO的熔点低
(4)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图所示,与一个阴离子距离最近且相等的所有阳离子为顶点构成的几何体为_______ 。已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则晶胞边长为_______ cm。(用含ρ、NA的代数式表示)
(1)化合物ZX3的沸点比化合物YX4的高,其主要原因是
(2)元素W能形成多种配合物,其中W(CO)5在常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断W(CO)5晶体属于
(3)下列说法正确的是
A.分子晶体中,共价键的键能越大,该分子晶体的熔、沸点越高
B.电负性顺序:X<Y<Z<Q
C.因为CaO中的离子键比KCl的强,所以KCl比CaO的熔点低
(4)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图所示,与一个阴离子距离最近且相等的所有阳离子为顶点构成的几何体为

您最近一年使用:0次
名校
解题方法
8 .  是前四周期的六种元素,原子序数依次增大。
是前四周期的六种元素,原子序数依次增大。 三种元素分别位于不同短周期的不同主族。
三种元素分别位于不同短周期的不同主族。 对应的简单离子核外电子排布相同,
对应的简单离子核外电子排布相同, 元素可形成一种新型漂白剂(结构如图),E元素正三价阳离子的
元素可形成一种新型漂白剂(结构如图),E元素正三价阳离子的 轨道为半充满状态,F元素最外层只有一个电子,焰色反应为蓝绿色。
轨道为半充满状态,F元素最外层只有一个电子,焰色反应为蓝绿色。

回答下列问题:
(1)基态A原子电子占据最高能级的电子云轮廓图为___________ 形。D元素基态原子核外M层电子的自旋状态___________ (填“相同”或“相反”)。基态原子与F同周期且最外层电子数相等的元素还有___________ (填元素符号)。E元素位于元素周期表___________ 区。
(2)B元素名称是________ 。新型漂白剂中C元素的化合价为_______ 。C元素能形成两种常见单质,其中沸点高的是_________ (填分子式)
(3)元素E与F的第二电离能
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
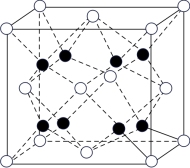
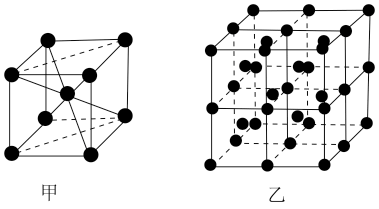
(4)E的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的截面图是_________(填字母序号)。
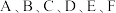 是前四周期的六种元素,原子序数依次增大。
是前四周期的六种元素,原子序数依次增大。 三种元素分别位于不同短周期的不同主族。
三种元素分别位于不同短周期的不同主族。 对应的简单离子核外电子排布相同,
对应的简单离子核外电子排布相同, 元素可形成一种新型漂白剂(结构如图),E元素正三价阳离子的
元素可形成一种新型漂白剂(结构如图),E元素正三价阳离子的 轨道为半充满状态,F元素最外层只有一个电子,焰色反应为蓝绿色。
轨道为半充满状态,F元素最外层只有一个电子,焰色反应为蓝绿色。
回答下列问题:
(1)基态A原子电子占据最高能级的电子云轮廓图为
(2)B元素名称是
(3)元素E与F的第二电离能

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)E的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的截面图是_________(填字母序号)。

A. | B.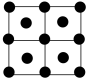 | C. | D.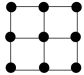 |
您最近一年使用:0次
解题方法
9 . 短周期主族元素第一电离能与原子半径的关系如图所示。回答下列问题:

(1)元素⑤在元素周期表中的位置为_______ ;元素②与⑭形成的化合物的电子式为_______ 。
(2)第一电离能在元素⑪处出现齿峰的原因是_______ 。
(3)元素⑩⑪⑫分别与元素①形成的简单化合物中,键角最大的是_______ (用化学式表示)。
(4)元素⑦与⑧的最高价氧化物对应水化物碱性较强的是_______ (用化学式表示)。
(5)元素⑬和⑮二者的最高价氧化物对应的水化物相互反应的离子方程式为_______ 。
(6)海水提溴工艺中,将溴单质吹入吸收塔中,用元素⑩的某种含氧酸盐对溴进行富集,该过程中反应的离子方程式为_______ 。
(7)用一个化学方程式表示元素③与⑩的非金属性强弱_______ 。

(1)元素⑤在元素周期表中的位置为
(2)第一电离能在元素⑪处出现齿峰的原因是
(3)元素⑩⑪⑫分别与元素①形成的简单化合物中,键角最大的是
(4)元素⑦与⑧的最高价氧化物对应水化物碱性较强的是
(5)元素⑬和⑮二者的最高价氧化物对应的水化物相互反应的离子方程式为
(6)海水提溴工艺中,将溴单质吹入吸收塔中,用元素⑩的某种含氧酸盐对溴进行富集,该过程中反应的离子方程式为
(7)用一个化学方程式表示元素③与⑩的非金属性强弱
您最近一年使用:0次
解题方法
10 . X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大。元素Z的单质常温下有Z2、Z3两种气体单质存在;在短周期中J元素的第一电离能最小;Q的最外层电子数与其电子总数之比为3∶8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一。请回答:
(1)Q元素在周期表中的位置为__ 。
(2)将这五种元素的原子半径从大到小排列,排在第三的元素是__ (填元素符号)。
(3)元素非金属性Z__ (填“>”或“<”)Q,用化学方程式证明这一事实__ 。
(4)用电子式表示化合物JX的形成过程__ 。
(5)Y、Z、Q的简单氢化物中,还原性最强的是(填化学式,下同)__ ,熔点最高的是__ ,键角最大的是__ 。
(6)将QZ2通入BaCl2溶液中,没有明显变化,再向其中加入J元素最高价氧化物对应的水化物溶液,所发生反应的离子方程式是__ 。
(1)Q元素在周期表中的位置为
(2)将这五种元素的原子半径从大到小排列,排在第三的元素是
(3)元素非金属性Z
(4)用电子式表示化合物JX的形成过程
(5)Y、Z、Q的简单氢化物中,还原性最强的是(填化学式,下同)
(6)将QZ2通入BaCl2溶液中,没有明显变化,再向其中加入J元素最高价氧化物对应的水化物溶液,所发生反应的离子方程式是
您最近一年使用:0次



