1 . 下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
(1)元素②的原子结构示意图是_______
(2)元素⑧在周期表中所处位置_______ ,从元素原子得失电子的角度看,元素⑤具有_______ (填“氧化性”或“还原性”)。
(3)元素④、⑤、⑥形成简单离子的半径由大到小的顺序是_______ 。(填离子符号)
(4)第三周期元素除⑩外原子半径最大的是_______ (填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是_______ (填化学式,下同),具有两性的是_______ ,这两种物质反应的离子方程式为_______ 。
(5)⑤和⑨它们可以形成_______ (填“离子”或“共价”)化合物。
 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)元素②的原子结构示意图是
(2)元素⑧在周期表中所处位置
(3)元素④、⑤、⑥形成简单离子的半径由大到小的顺序是
(4)第三周期元素除⑩外原子半径最大的是
(5)⑤和⑨它们可以形成
您最近一年使用:0次
名校
解题方法
2 . 下表是元素周期表的一部分,针对表中的①~⑩中元素,请用化学用语填空回答以下问题:

(1)化学性质最不活泼的元素原子的原子结构示意图为________ 。
(2)元素①、②的简单氢化物的稳定性更强的是______________ (用化学式表示,下同)。
(3)元素的最高价氧化物对应的水化物中酸性最强的是______ ,碱性最强的是____ ,呈两性的氢氧化物是_________ ,元素③的最高价氧化物对应水化物中含有的化学键类型为________ 。
(4)在③~⑦元素中,简单离子半径最小的是_________ 。
(5)元素③的过氧化物的电子式为_________ 。
(6)在⑦与⑩的单质中,氧化性较强的是_____ ,用化学反应方程式证明:______ 。

(1)化学性质最不活泼的元素原子的原子结构示意图为
(2)元素①、②的简单氢化物的稳定性更强的是
(3)元素的最高价氧化物对应的水化物中酸性最强的是
(4)在③~⑦元素中,简单离子半径最小的是
(5)元素③的过氧化物的电子式为
(6)在⑦与⑩的单质中,氧化性较强的是
您最近一年使用:0次
名校
3 . 元素周期表的表达形式有多种,但都能表示出元素的周期性变化规律,请回答下列问题:
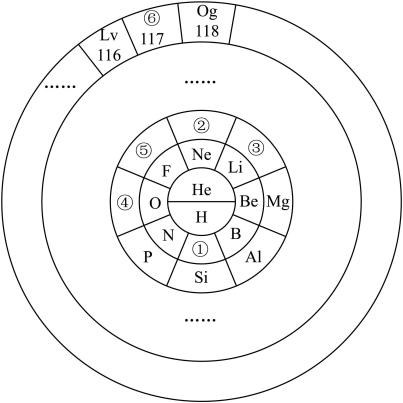
(1)①与④元素形成的化合物属于___________ 晶体。
(2)写出③的最高价氧化物对应水化物和Al的最高价氧化物的水化物相互反应的离子方程式:__________ 。
(3)②号元素为___________ (填元素符号)。请写出1个与②核外电子数相同的简单离子组成的化合物的化学式:___________ 。其中存在的化学键属于___________ 键,该物质在熔融状态下___________ 导电(填“能”或“不能”)。
(4)⑤的单质具有较强的氧化性,能与大多数金属发生反应,请写出⑤的单质与过量的铁粉反应的化学方程式:___________ ,将反应所得混合物溶于水,得到浅绿色的溶液,请写出相关的离子方程式:___________ 。
(5)其中非金属性④___________ ⑤(填“>”或“<”),请用一个化学方程式证明___________ 。
(6)⑥(原子序数117)的单质是一种具有放射性的卤族元素,它在元素周期表中的位置为___________ ,根据元素的周期性规律,以下推测正确的是________
A.单质在常温下为气体 B.气态氢化物的稳定性较好
C.离子具有强还原性 D.半径大于⑤

(1)①与④元素形成的化合物属于
(2)写出③的最高价氧化物对应水化物和Al的最高价氧化物的水化物相互反应的离子方程式:
(3)②号元素为
(4)⑤的单质具有较强的氧化性,能与大多数金属发生反应,请写出⑤的单质与过量的铁粉反应的化学方程式:
(5)其中非金属性④
(6)⑥(原子序数117)的单质是一种具有放射性的卤族元素,它在元素周期表中的位置为
A.单质在常温下为气体 B.气态氢化物的稳定性较好
C.离子具有强还原性 D.半径大于⑤
您最近一年使用:0次
4 . 我们已经学习了钠、氯、铁、铝等元素的单质及其化合物的相关性质,请回答下列问题:
(1)四种元素的单质中,氧化性和还原性最强的两种单质反应生成某种化合物,用电子式表示该化合物的形成过程:____ 。
(2)把8.3g铁铝合金的粉末放入过量的盐酸中,得到5.6L标况下的H2,则合金中铁的质量分数为:____ (保留三位有效数字)。
(3)配平Na2FeO4与盐酸反应的方程式:____Na2FeO4+____HCl=____NaCl+____FeCl3+____H2O+____Cl2↑____ ,Na2FeO4的电离方程式为____ 。该反应按方程式计量数关系,所得产物中离子键与共价键的个数比为:____ 。
(1)四种元素的单质中,氧化性和还原性最强的两种单质反应生成某种化合物,用电子式表示该化合物的形成过程:
(2)把8.3g铁铝合金的粉末放入过量的盐酸中,得到5.6L标况下的H2,则合金中铁的质量分数为:
(3)配平Na2FeO4与盐酸反应的方程式:____Na2FeO4+____HCl=____NaCl+____FeCl3+____H2O+____Cl2↑
您最近一年使用:0次
解题方法
5 . 元素周期表体现了元素位置、结构和性质的关系,揭示了元素的内在联系。下表列出了①到⑧八种元素在周期表中的位置。
回答下列问题:
(1)元素①形成单质的电子式为_______ 。
(2)元素②的单质与水反应的离子方程式为_______ 。
(3)元素④⑤⑥的简单离子半径最大的是_______ (用离子符号表示)。
(4)用电子式表示元素③和元素⑥组成化合物的形成过程_______ 。
(5)元素④的单质与元素②最高价氧化物的水化物反应可以用于管道疏通,其原理为_______ (用离子方程式表示)。
(6)下列对元素⑦的说法正确的是_______ (填序号)。
a.原子最外层有6个电子
b.元素的非金属性:⑧>⑦
c.能形成 价的氧化物,该氧化物既有氧化性又有还原性
价的氧化物,该氧化物既有氧化性又有还原性
(7)从原子结构的角度解释元素⑥的非金属性强于元素⑤的原因_______ 。
| 周期 | 族 | |||||||
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ⑥ | |||
| 4 | ⑦ | ⑧ | ||||||
(1)元素①形成单质的电子式为
(2)元素②的单质与水反应的离子方程式为
(3)元素④⑤⑥的简单离子半径最大的是
(4)用电子式表示元素③和元素⑥组成化合物的形成过程
(5)元素④的单质与元素②最高价氧化物的水化物反应可以用于管道疏通,其原理为
(6)下列对元素⑦的说法正确的是
a.原子最外层有6个电子
b.元素的非金属性:⑧>⑦
c.能形成
 价的氧化物,该氧化物既有氧化性又有还原性
价的氧化物,该氧化物既有氧化性又有还原性(7)从原子结构的角度解释元素⑥的非金属性强于元素⑤的原因
您最近一年使用:0次
6 . 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。表中列出了钙元素及a~f6种元素在周期表中的位置。
(1)a的元素符号是____ ;e的最高价氧化物是____ 。
(2)c、d的最高价氧化物对应的水化物中,碱性较弱的物质是____ (写化学式)。
(3)用电子式表示c与f组成的化合物的形成过程____ 。
(4)非金属性b强于e,用原子结构解释原因____ 。
(5)下列关于f及其化合物的推断中,正确的是____ (填字母)。
a.f的最高化合价均为+7价
b.f单质的氧化性在同主族中最强
c.f的最高价氧化物对应的水化物的溶液pH<7
(6)某种牛奶的营养成分表如表所示。
①营养成分表中,所含物质质量最大的是____ 。
②已知镁能与O2、H2O反应,对比钙与镁的原子结构和在元素周期表中的位置关系,你预测金属钙的性质是____ 。
③请结合钙的化学性质判断牛奶中钙的存在形式为____ (填“单质”或“化合物”)。
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | a | b | ||||||
| 3 | c | d | e | f | ||||
| 4 | Ca |
(2)c、d的最高价氧化物对应的水化物中,碱性较弱的物质是
(3)用电子式表示c与f组成的化合物的形成过程
(4)非金属性b强于e,用原子结构解释原因
(5)下列关于f及其化合物的推断中,正确的是
a.f的最高化合价均为+7价
b.f单质的氧化性在同主族中最强
c.f的最高价氧化物对应的水化物的溶液pH<7
(6)某种牛奶的营养成分表如表所示。
| 营养成分表 | ||
| 项目 | 每100g | NRV% |
| 能量 | 309kJ | 4% |
| 蛋白质 | 3.6g | 6% |
| 脂肪 | 4.4g | 7% |
| 碳水化合物 | 5.0g | 2% |
| 钠 | 65mg | 3% |
| 钙 | 120mg | 15% |
②已知镁能与O2、H2O反应,对比钙与镁的原子结构和在元素周期表中的位置关系,你预测金属钙的性质是
③请结合钙的化学性质判断牛奶中钙的存在形式为
您最近一年使用:0次
7 . 几种元素在周期表中的位置如下,用化学用语 回答下列问题:

(1)表中所列元素,化学性质最不活泼的是___________ 。
(2)上图中,元素a与b形成的10 e-的分子是___________ 。
(3)元素c在空气中燃烧的产物中所含化学键有___________ 。
(4)d、e、h三种元素最高价氧化物对应水化物碱性最弱的是___________ ,其中h与水反应的化学方程式为___________ 。
(5)f单质的电子式为___________ 。
(6)德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,相对原子质量是85。分析可知,铷在元素周期表中的位置是___________ ,关于铷的下列说法中正确的是___________ (填字母序号)。
a.与水反应比钠更剧烈b.单质具有很强氧化性
c. 在空气中易吸收水和二氧化碳d.RbOH的碱性比同浓度的NaOH弱
在空气中易吸收水和二氧化碳d.RbOH的碱性比同浓度的NaOH弱

(1)表中所列元素,化学性质最不活泼的是
(2)上图中,元素a与b形成的10 e-的分子是
(3)元素c在空气中燃烧的产物中所含化学键有
(4)d、e、h三种元素最高价氧化物对应水化物碱性最弱的是
(5)f单质的电子式为
(6)德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,相对原子质量是85。分析可知,铷在元素周期表中的位置是
a.与水反应比钠更剧烈b.单质具有很强氧化性
c.
 在空气中易吸收水和二氧化碳d.RbOH的碱性比同浓度的NaOH弱
在空气中易吸收水和二氧化碳d.RbOH的碱性比同浓度的NaOH弱
您最近一年使用:0次
名校
8 . 解答下列问题:
(1)2017年中科院某研究团队通过设计一种新型Na—Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+ O2(g)=H2O(l) ΔH1=-akJ·mol-1
O2(g)=H2O(l) ΔH1=-akJ·mol-1
C8H18(l)+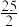 O2(g)=8CO2(g)+9H2O(l) ΔH2=-bkJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH2=-bkJ·mol-1
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式:___________ 。
(2)直接排放含SO2的烟气会形成酸雨,危害环境。工业上常用催化还原法和碱吸收法处理SO2气体。1molCH4完全燃烧生成气态水和1molS(g)燃烧的能量变化如下图所示:

在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式:___________ 。
(3)合成氨在工业生产中具有重要意义。在合成氨工业中I2O5常用于定量测定CO的含量。
已知2I2(s)+5O2(g)=2I2O5(s) ΔH=-76kJ·mol-1;
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1。
则该测定反应的热化学方程式为___________ 。
(4)化学反应原理研究物质转化过程中的规律并在生产生活中有广泛的应用。汽车排气管内的催化转化器可实现尾气无毒处理。
已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221.0kJ·mol-1
CO2(g)=C(s)+O2(g) ΔH=+393.5kJ·mol-1
则反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的ΔH=___________ kJ·mol-1。
(5)氮及其化合物与人类生产、生活密切相关。氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-bkJ·mol-1(b>0)
若用CO还原NO2至N2,当消耗标准状况下3.36LCO时,放出的热量为___________ kJ(用含有a和b的代数式表示)。
(6)氮元素、硫元素还能形成多种化合物。如汽车安全气囊中的填充物叠氮酸钠(NaN3),能用于处理废水中的重金属离子的硫代碳酸钠(Na2CS3)。根据所学化学知识分析, 晶体中所含化学键的类型有
晶体中所含化学键的类型有___________ ,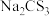 水溶液显
水溶液显___________ (填“酸性”、“碱性”或“中性”)。
(1)2017年中科院某研究团队通过设计一种新型Na—Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+
 O2(g)=H2O(l) ΔH1=-akJ·mol-1
O2(g)=H2O(l) ΔH1=-akJ·mol-1C8H18(l)+
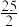 O2(g)=8CO2(g)+9H2O(l) ΔH2=-bkJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH2=-bkJ·mol-1试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式:
(2)直接排放含SO2的烟气会形成酸雨,危害环境。工业上常用催化还原法和碱吸收法处理SO2气体。1molCH4完全燃烧生成气态水和1molS(g)燃烧的能量变化如下图所示:

在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式:
(3)合成氨在工业生产中具有重要意义。在合成氨工业中I2O5常用于定量测定CO的含量。
已知2I2(s)+5O2(g)=2I2O5(s) ΔH=-76kJ·mol-1;
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1。
则该测定反应的热化学方程式为
(4)化学反应原理研究物质转化过程中的规律并在生产生活中有广泛的应用。汽车排气管内的催化转化器可实现尾气无毒处理。
已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221.0kJ·mol-1
CO2(g)=C(s)+O2(g) ΔH=+393.5kJ·mol-1
则反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的ΔH=
(5)氮及其化合物与人类生产、生活密切相关。氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-bkJ·mol-1(b>0)
若用CO还原NO2至N2,当消耗标准状况下3.36LCO时,放出的热量为
(6)氮元素、硫元素还能形成多种化合物。如汽车安全气囊中的填充物叠氮酸钠(NaN3),能用于处理废水中的重金属离子的硫代碳酸钠(Na2CS3)。根据所学化学知识分析,
 晶体中所含化学键的类型有
晶体中所含化学键的类型有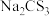 水溶液显
水溶液显
您最近一年使用:0次
9 . 下表为元素周期表的一部分,请回答下列问题:

(1)在①~⑩元素中:金属性最强的元素是_______ (填元素符号,下同),原子半径最小的是_______ ,化学性质最不活泼的是_______ 。
(2)中国学者雷晓光被国际组织推选为“元素①代言人”,元素①的原子结构示意图是_______ 。
(3)②~④三种元素分别形成的简单离子中,离子半径最小的是_______ (用离子符号表示)。
(4)⑤的最高价氧化物和④的最高价氧化物的水化物溶液反应的离子方程式为_______ 。
(5)用电子式表示⑥和⑨的简单离子间构成的化合物的形成过程为_______ 。
(6)砷化镓(GaAs)是一种优良的半导体材料。砷(As)与元素①同主族,原子序数为33,砷(As)在周期表中的位置是_______ 。镓与砷同周期,与元素⑤同主族。下列说法错误的是_______ (填标号)。
A.原子半径:Ga>Al B.热稳定性: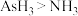
C.酸性: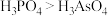 D.碱性:
D.碱性:
(7)设计一个实验方案来比较⑦、⑩单质氧化性的强弱(可供选择的试剂有:KBr溶液、 、新制氯水),你的实验方案是
、新制氯水),你的实验方案是_______ 。

(1)在①~⑩元素中:金属性最强的元素是
(2)中国学者雷晓光被国际组织推选为“元素①代言人”,元素①的原子结构示意图是
(3)②~④三种元素分别形成的简单离子中,离子半径最小的是
(4)⑤的最高价氧化物和④的最高价氧化物的水化物溶液反应的离子方程式为
(5)用电子式表示⑥和⑨的简单离子间构成的化合物的形成过程为
(6)砷化镓(GaAs)是一种优良的半导体材料。砷(As)与元素①同主族,原子序数为33,砷(As)在周期表中的位置是
A.原子半径:Ga>Al B.热稳定性:
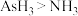
C.酸性:
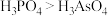 D.碱性:
D.碱性:
(7)设计一个实验方案来比较⑦、⑩单质氧化性的强弱(可供选择的试剂有:KBr溶液、
 、新制氯水),你的实验方案是
、新制氯水),你的实验方案是
您最近一年使用:0次
名校
10 . 下列关于元素周期表和元素性质的叙述正确的是
| A.质子数相同的微粒之间一定互称同位素 |
| B.I A族与ⅦA族元素间形成的化合物一定是离子化合物 |
| C.同主族元素的简单阴离子半径越大,其单质氧化性越弱 |
| D.同周期金属元素的化合价越高,其氢氧化物的碱性越强 |
您最近一年使用:0次
2016-12-09更新
|
1028次组卷
|
3卷引用:甘肃省兰州市第一中学2016-2017学年高一下学期期末考试化学试题
甘肃省兰州市第一中学2016-2017学年高一下学期期末考试化学试题(已下线)狂刷05 元素周期表和元素周期律的应用—《小题狂刷》2017-2018学年高一化学人教必修22020届高三化学选修三二轮专题复习—— 离子键、离子化合物



