解题方法
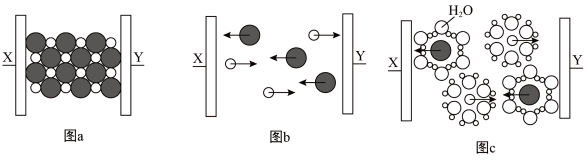
1 . 图a~c分别为氯化钠在不同状态下的导电实验(X、Y均表示石墨电极,X与电源正极相连,Y与电源负极相连)微观示意图。下列说法错误的是


| A.图示中●代表的离子是氯离子 |
| B.图a说明氯化钠固体不能导电 |
| C.图b能证明氯化钠中含有离子键 |
| D.图c表示带负电荷的水合氯离子向与电源负极相连的电极移动 |
您最近一年使用:0次
名校
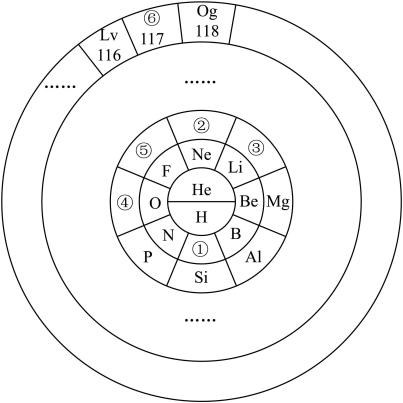
2 . 下图是元素周期表的一部分。按要求填写下列空白:

(1)元素⑦在周期表中的位置为_______ 。
(2)④、⑧、⑨的简单离子半径的大小顺序为_______ (填离子符号)。
(3)①~⑩元素的最高价氧化物对应的水化物中,酸性最强的是_______ (填化学式)。
(4)④⑧⑨三种元素形成的气态氢化物稳定性由大到小的顺序是_______ (用化学式表示)。
(5)⑤的最高价氧化物对应的水化物中所含的化学键为_______ ;③的氢化物的电子式为_______ 。
(6)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是_______ 。
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱

(1)元素⑦在周期表中的位置为
(2)④、⑧、⑨的简单离子半径的大小顺序为
(3)①~⑩元素的最高价氧化物对应的水化物中,酸性最强的是
(4)④⑧⑨三种元素形成的气态氢化物稳定性由大到小的顺序是
(5)⑤的最高价氧化物对应的水化物中所含的化学键为
(6)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
您最近一年使用:0次
2023-01-31更新
|
191次组卷
|
2卷引用:湖南省永州市第一中学2022-2023学年高一上学期期末阶段性考试化学试题
名校
解题方法
3 . 图 a~c 分别为氯化钠在不同状态下的导电实验(X、Y 均表示石墨电极)微观示意图。下列说法错误的是

A.图示中 代表的离子的电子式为 代表的离子的电子式为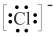 |
| B.图 a 中放入的是氯化钠固体,该条件下氯化钠不导电 |
| C.图 b 和图c 中发生的化学反应完全相同 |
| D.图 b 能证明氯化钠固体含有离子键 |
您最近一年使用:0次
2021-03-27更新
|
699次组卷
|
5卷引用:天津市南开区崇化中学2022-2023学年高一上学期期末质量检测化学试题
名校
4 . 元素周期表的表达形式有多种,但都能表示出元素的周期性变化规律,请回答下列问题:
(1)①与④元素形成的化合物属于___________ 晶体。
(2)写出③的最高价氧化物对应水化物和Al的最高价氧化物的水化物相互反应的离子方程式:__________ 。
(3)②号元素为___________ (填元素符号)。请写出1个与②核外电子数相同的简单离子组成的化合物的化学式:___________ 。其中存在的化学键属于___________ 键,该物质在熔融状态下___________ 导电(填“能”或“不能”)。
(4)⑤的单质具有较强的氧化性,能与大多数金属发生反应,请写出⑤的单质与过量的铁粉反应的化学方程式:___________ ,将反应所得混合物溶于水,得到浅绿色的溶液,请写出相关的离子方程式:___________ 。
(5)其中非金属性④___________ ⑤(填“>”或“<”),请用一个化学方程式证明___________ 。
(6)⑥(原子序数117)的单质是一种具有放射性的卤族元素,它在元素周期表中的位置为___________ ,根据元素的周期性规律,以下推测正确的是________
A.单质在常温下为气体 B.气态氢化物的稳定性较好
C.离子具有强还原性 D.半径大于⑤

(1)①与④元素形成的化合物属于
(2)写出③的最高价氧化物对应水化物和Al的最高价氧化物的水化物相互反应的离子方程式:
(3)②号元素为
(4)⑤的单质具有较强的氧化性,能与大多数金属发生反应,请写出⑤的单质与过量的铁粉反应的化学方程式:
(5)其中非金属性④
(6)⑥(原子序数117)的单质是一种具有放射性的卤族元素,它在元素周期表中的位置为
A.单质在常温下为气体 B.气态氢化物的稳定性较好
C.离子具有强还原性 D.半径大于⑤
您最近一年使用:0次
5 . 根据化学键,元素周期表和元素周期律知识判断,下列叙述不正确的是


A. 中只含有离子键 中只含有离子键 |
B.气态氢化物的稳定性: |
| C.金属元素和非金属元素分界线附近的元素多用于制造半导体材料 |
D.如图所示实验(左侧锥形瓶内有二氧化碳气体冒出,右侧试管中有硅酸产生)可证明元素的非金属性: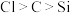 |
您最近一年使用:0次
6 . 1869年门捷列夫提出元素周期表,根据元素周期表和周期律,回答问题。
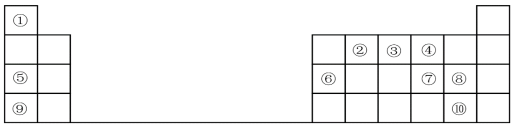
(1)元素⑦在周期表中的位置______ 。
(2)元素①和⑤形成的化合物中化学键类型是______ 。
(3)在①~⑧元素中,原子半径最大的是______ (填元素名称);其某种氧化物可用于潜水艇中的供氧剂,该氧化物中阴离子与阳离子个数比为______ 。
(4)元素⑦⑧⑨的简单离子半径由大到小的顺序是______ (用离子符号表示),元素⑨的最高价氧化物对应水化物与元素⑥的最高价氧化物对应的水化物反应的离子方程式为______ 。
(5)元素的非金属性⑩______ ⑧(填“>”或“<”);下列事实不能证明上述结论的是______ 。
A.元素⑧的单质与⑩的氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的氢化物的还原性比元素⑩的弱
C.元素⑧和⑩的氢化物受热分解,前者的分解温度高
D.元素⑧的最高价氧化物对应水化物的酸性比元素⑩的强
E.元素⑧的氢化物的水溶液的酸性比元素⑩的弱

(1)元素⑦在周期表中的位置
(2)元素①和⑤形成的化合物中化学键类型是
(3)在①~⑧元素中,原子半径最大的是
(4)元素⑦⑧⑨的简单离子半径由大到小的顺序是
(5)元素的非金属性⑩
A.元素⑧的单质与⑩的氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的氢化物的还原性比元素⑩的弱
C.元素⑧和⑩的氢化物受热分解,前者的分解温度高
D.元素⑧的最高价氧化物对应水化物的酸性比元素⑩的强
E.元素⑧的氢化物的水溶液的酸性比元素⑩的弱
您最近一年使用:0次
10-11高三上·湖北黄冈·阶段练习
名校
解题方法
7 . 下列性质中,可以证明某化合物中存在离子键的是
| A.可溶于水 | B.有较高的熔点 |
| C.水溶液能导电 | D.熔融状态能导电 |
您最近一年使用:0次
2022-11-26更新
|
833次组卷
|
86卷引用:2009—2010学年衡水中学高二下学期期末考试化学
(已下线)2009—2010学年衡水中学高二下学期期末考试化学(已下线)2010年福建省南安一中高一下学期期末考试化学试卷(已下线)2011-2012学年湖北武汉部分重点学校高二下学期期末统考化学卷(已下线)2011-2012学年福建省莆田一中高二下学期期末考试化学试卷(已下线)2012-2013学年福建省晋江市季延中学高二上学期期末考试化学试卷(已下线)2012-2013学年四川省资阳市高二上学期期末检测化学试卷2015-2016学年山西省临汾一中高一下期末化学试卷2016-2017学年四川省乐山市高二上学期期末化学试卷内蒙古阿拉善左旗高级中学2016-2017学年高二下学期期末考试化学试题甘肃省师大附中2017-2018学年下学期高一期末模拟化学试卷【全国市级联考】广东省潮州市2017-2018学年高一下学期期末考试化学试题【市级联考】四川省达州市2018-2019学年高二上学期期末检测化学试题上海市同济大学附属七一中学2018-2019学年高一第一学期期末试卷化学试题上海市浦东新区2016-2017学年高一上学期期末考试化学试题吉林省辽源市田家炳高级中学等友好学校2019-2020学年高二下学期期末考试化学试题上海中学东校2022学年高一上学期学期素质评估化学试题上海市进才中学2022-2023学年高一上学期期末考试化学试题(已下线)2010届湖北省黄冈中学高三11月月考化学测试卷(已下线)09~10学年延安实验中学高一下学期期中考试化学卷(已下线)2011届福建省周宁十中高三上学期第二次月考化学卷(已下线)2010年内蒙古赤峰市田家炳中学高二上学期期中考试化学试卷(已下线)2010-2011学年山东省兖州市高二下学期期中考试化学试卷(已下线)2010-2011学年甘肃省张掖中学高一下学期期中考试化学试卷(已下线)2011-2012年浙江宁波万里国际中学高一第二学期期中考试化学试卷(已下线)2012-2013学年江苏省江都区丁沟中学高一下学期期中考试化学试卷(已下线)2013-2014学年福建省厦门一中高二上学期期中考试化学试卷(已下线)2013-2014学年山东济宁市曲阜师大附中高二上学期期中考试化学试卷2013-2014学年江苏省射阳县盘湾中学高二上学期期中化学试卷2014-2015浙江省台州市书生中学高一下学期第一次月考化学试卷2014-2015浙江省严州中学高一4月阶段性测试化学试卷2014-2015学年安徽省淮北师大附属实验中学高一下期中化学试卷2015-2016学年河北省冀州市中学高一下首次月考化学试卷2015-2016学年甘肃天水一中高一下第一次月考化学试卷2015-2016学年河北省唐山市开滦一中高一下学期期中文科化学试卷2015-2016学年吉林省辽源市田家炳高中高一下期中化学试卷2015-2016学年河北省保定三中高一下4月月考化学试卷2016-2017学年河北省唐山市开滦第二中学高一3月月考化学试卷2016-2017学年陕西省西安市第一中学高一下学期第一次月考化学试卷福建省三明市第一中学2016-2017学年高一下学期半期考试化学试题黑龙江省鹤岗第一中学2016-2017学年高一下学期期中考试化学试卷辽宁省庄河市高级中学2016-2017学年高一下学期期中考试化学试题山东省烟台市第二中学2016-2017学年高一6月月考化学试题1山东省烟台市第二中学2016-2017学年高一6月月考化学试题2山东省德州市平原县第一中学2017-2018学年高一4月阶段性检测化学试题【全国市级联考】山东省菏泽市2017-2018学年高二下学期期中考试(B卷)化学试题【全国百强校】湖南省衡阳市衡阳县第一中学2018-2019学年高一下学期第一次月考化学试题【全国百强校】河北省张家口市第一中学2018-2019学年高一下学期4月月考化学试题湖北省襄阳市东风中学2018-2019学年高一下学期3月月考化学试题【全国百强校】河北省张家口市第一中学2018-2019学年高一下学期期中考试化学试题2广西壮族自治区柳州高中2018-2019学年高一(文)下学期期中考试化学试题山西省晋中市祁县二中2018-2019学年高二下学期期中考试化学试题【全国百强校】山东省济南市外国语学校三箭分校2018-2019学年高一下学期期中考试化学试题河北省滦州市第一中学2018-2019学年高一下学期期中考试化学试题上海市复兴高级中学2018-2019学年高一第一学期期中考试化学试题(已下线)【新东方】高中化学173山西省忻州市第一中学人教版高一化学必修二同步检测:1.3.1化 学 键上海市古美高中2016-2017学年高三上学期期中考试化学试题福建省福州市福建师范大学附属中学2017-2018学年高一下学期期中考试化学试题福建省福州市长乐高级中学2019-2020学年高一下学期5月复学线上教学诊断性考试化学试题陕西省西安市第一中学2019-2020学年高一下学期期中考试化学试题福建省南安市侨光中学2019-2020学年高二下学期第一次阶段考化学试题江苏省徐州市2019-2020学年高一下学期期中抽测化学试题山东省日照市莒县2018-2019学年高一下学期期中考试化学试题人教版(2019)高一必修第一册 第四章 物质结构 元素周期律 第三节 化学键 教材帮(已下线)浙江省嘉兴市七校2018-2019学年高一下学期期中考试化学试题高一必修第一册(苏教2019)专题5 第二单元 微粒之间的相互作用力1江苏省盐城市东台市创新学校2020-2021学年高二上学期9月份月检测化学试题(选修)(鲁科版2019)选择性必修2 第3章 不同聚集状态的物质与性质 第2节 几种简单的晶体结构模型鲁科版2019选择性必修2第3章 不同聚集状态的物质与性质 第2节 几种简单的晶体结构模型 第2课时 离子晶体(人教版2019)选择性必修2 第三章 晶体结构与性质 第三节 金属晶体与离子晶体 第2课时 离子晶体过渡晶体与混合型晶体湖北省竹山县第二中学2020-2021学年高一下学期第一次月考化学试题(已下线)第11讲 离子键-2020-2021学年秋季班高一上学期化学教材知识点精讲练(沪科版)(已下线)专题4.3.1 离子键(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(已下线)5.2.1 离子键-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)河北省唐山市第十一中学2021-2022学年高二上学期12月月考化学试题上海外国语大学附属浦东外国语学校2021-2022学年高一下学期线上诊断化学试题福建省上杭县第五中学、才溪中学2020-2021学年高二下学期期中联考化学试题云南省文山州广南县第二中学2021-2022学年高一上学期12月月考化学试题陕西省临潼区铁路中学2021-2022学年高一下学期第一次月考化学试题(已下线)第22讲 离子键与电子式-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )上海市宝山中学2022-2023学年高一上学期10月月考化学试题(已下线)4.3.1 离子键-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)2019版鲁科化学必修第二册第2章第1节 化学键与物质构成课后习题四川省广安代市中学校2020-2021学年高二下学期第二次月考化学试卷广东省深圳科学高中2021-2022学年高一下学期3月阶段测试化学试题3.3.1 金属晶体和离子晶体-课堂例题
名校
8 . 回答下列问题
(1)请用下列10种物质的序号填空:
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2
其中既含离子键又含非极性键的是_______ ;既含离子键又含极性键的是_______ 。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为_______ ;若XY2为共价化合物时(已知硫磺易溶于其中),其结构式为_______ 。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190 ℃,但在180 ℃就开始升华。据此判断,氯化铝是_______ (填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是_______ 。
(4)现有a~g 7种短周期元素,它们在元素周期表中的位置如图所示,请据此回答下列问题:
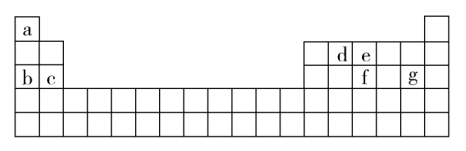
①元素的原子间反应最容易形成离子键的是_______ (填选项,下同),容易形成共价键的是_______ 。
A.c和f B.b和g C.d和g D.b和e
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式_______ 。
(5)a与e能形成氢化物的空间构型为_______ ,其所含化学键类型为_______ ,将其通入到炽热的黑色氧化铜粉末中,出现了红色固体,其他产物对环境友好,请写出相关方程:_______ 。
(1)请用下列10种物质的序号填空:
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2
其中既含离子键又含非极性键的是
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190 ℃,但在180 ℃就开始升华。据此判断,氯化铝是
(4)现有a~g 7种短周期元素,它们在元素周期表中的位置如图所示,请据此回答下列问题:

①元素的原子间反应最容易形成离子键的是
A.c和f B.b和g C.d和g D.b和e
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式
(5)a与e能形成氢化物的空间构型为
您最近一年使用:0次
2022-10-24更新
|
278次组卷
|
2卷引用:四川省宜宾市第四中学校2022-2023学年高一下学期6月期末考试化学试题
名校
解题方法
9 . 下列事实可以证明氯化钠中一定存在离子键的是
| A.水溶液能导电 | B.熔融状态下能导电 |
| C.具有较高的熔点 | D.常温下易溶于水 |
您最近一年使用:0次
2022-04-21更新
|
134次组卷
|
2卷引用:上海市第十中学2021-2022学年高一下学期期末考试化学试题
10 . 已知A、B、C、D、E、F为周期表中前四周期的六种元素。A是周期表中原子半径最小的元素;B的基态原子有2个不同的能级且各能级中电子数相等;C核外有五种运动状态不同的电子;D是电负性最大的元素; 离子与
离子与 离子具有相同的稳定电子层结构;F的基态原子的价电子排布式为
离子具有相同的稳定电子层结构;F的基态原子的价电子排布式为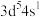 。请回答下列问题:
。请回答下列问题:
(1)B、C、D三种元素的第一电离能由大到小的顺序是___________ (填元素符号)。
(2)A、C、E可形成一种化合物M,M是有机合成中常用的还原剂,其阴离子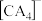 的空间构型是
的空间构型是___________ ,M中存在的作用力有___________ 填标号)。
a.离子键 b.氢键 c. 键 d.
键 d. 键
键
(3)B与Cl形成的化合物中,化学键具有明显的共价性,其蒸汽状态下以双聚分子存在。写出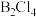 的结构式(用元素符号表示)
的结构式(用元素符号表示)___________ ,其中B的杂化类型为___________ 。
(4)第三周期元素与D形成的化合物的熔点如下表:
解释表中化合物熔点变化的原因:___________ 。
(5)现有含F(Ⅲ)的两种氯化物的有颜色晶体, 的配位数均为6,一种为紫色,一种为绿色,相关实验证明两种晶体的组成皆为
的配位数均为6,一种为紫色,一种为绿色,相关实验证明两种晶体的组成皆为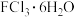 。为测定这两种晶体的化学式,设计了如下实验:
。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液﹔
b.分别往待测溶液中滴入 溶液,均产生白色沉淀﹔
溶液,均产生白色沉淀﹔
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与 溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。
溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。
试推断紫色晶体的化学式为___________ 。
(6)氢气是理想的清洁能源,镍(Ni)元素与镧(La)元素的合金可作储氢材料,该合金的晶胞如图所示 ﹐晶胞中心有一个Ni原子,其他Ni原子都在晶胞面上,则该晶体的化学式为
﹐晶胞中心有一个Ni原子,其他Ni原子都在晶胞面上,则该晶体的化学式为___________ ,已知该晶体的密度为 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则该晶胞的边长是
,则该晶胞的边长是___________ nm。
 离子与
离子与 离子具有相同的稳定电子层结构;F的基态原子的价电子排布式为
离子具有相同的稳定电子层结构;F的基态原子的价电子排布式为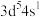 。请回答下列问题:
。请回答下列问题:(1)B、C、D三种元素的第一电离能由大到小的顺序是
(2)A、C、E可形成一种化合物M,M是有机合成中常用的还原剂,其阴离子
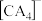 的空间构型是
的空间构型是a.离子键 b.氢键 c.
 键 d.
键 d. 键
键(3)B与Cl形成的化合物中,化学键具有明显的共价性,其蒸汽状态下以双聚分子存在。写出
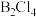 的结构式(用元素符号表示)
的结构式(用元素符号表示)(4)第三周期元素与D形成的化合物的熔点如下表:
| 化合物 | NaD | 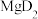 | 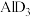 | 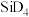 | 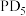 | 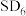 |
| 熔点/℃ | 993 | 1261 | 1291 | 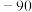 | 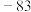 | 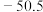 |
(5)现有含F(Ⅲ)的两种氯化物的有颜色晶体,
 的配位数均为6,一种为紫色,一种为绿色,相关实验证明两种晶体的组成皆为
的配位数均为6,一种为紫色,一种为绿色,相关实验证明两种晶体的组成皆为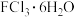 。为测定这两种晶体的化学式,设计了如下实验:
。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液﹔
b.分别往待测溶液中滴入
 溶液,均产生白色沉淀﹔
溶液,均产生白色沉淀﹔c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与
 溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。
溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。试推断紫色晶体的化学式为
(6)氢气是理想的清洁能源,镍(Ni)元素与镧(La)元素的合金可作储氢材料,该合金的晶胞如图所示
 ﹐晶胞中心有一个Ni原子,其他Ni原子都在晶胞面上,则该晶体的化学式为
﹐晶胞中心有一个Ni原子,其他Ni原子都在晶胞面上,则该晶体的化学式为 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则该晶胞的边长是
,则该晶胞的边长是
您最近一年使用:0次



