名校
解题方法
1 . 中国研究人员在金星大气中探测到了磷化氢( )气体。
)气体。 常作为一种熏蒸剂,在贮粮中用于防治害虫,一种制备
常作为一种熏蒸剂,在贮粮中用于防治害虫,一种制备 的流程如图所示:
的流程如图所示:

下列说法正确的是
 )气体。
)气体。 常作为一种熏蒸剂,在贮粮中用于防治害虫,一种制备
常作为一种熏蒸剂,在贮粮中用于防治害虫,一种制备 的流程如图所示:
的流程如图所示:
下列说法正确的是
A.白磷( )分子呈正四面体形,键角为 )分子呈正四面体形,键角为 |
B.白磷与浓NaOH溶液反应的化学方程式为 |
C.次磷酸的分子式为 ,属于三元酸 ,属于三元酸 |
D.上述过程中,每消耗1mol白磷,生成 |
您最近一年使用:0次
2023-03-27更新
|
663次组卷
|
4卷引用:湖南省长沙市湖南师范大学附属中学2022-2023学年高二下学期期中考试化学试题
湖南省长沙市湖南师范大学附属中学2022-2023学年高二下学期期中考试化学试题(已下线)2023年湖南卷高考真题变式题(选择题6-10)江苏省海安高级中学2022-2023学年高三下学期3月月考化学试题山东省青岛市第二中学2022-2023学年高二5月月考化学试题
名校
解题方法
2 . 高温煅烧黄铜矿(主要成分 )的反应为:
)的反应为: 。请回答:
。请回答:
(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的
表示,称为电子的自旋磁量子数。对于基态的 ,其价电子自旋磁量子数的代数和为
,其价电子自旋磁量子数的代数和为_______ 。
(2)当O原子的电子排布从 变成
变成 时,形成的光谱名称是
时,形成的光谱名称是_______ 光谱(选填“发射”或“吸收”)。
(3)高温煅烧时 变成更稳定的
变成更稳定的 ,原因是
,原因是_______ 。
(4) 分子的空间构型是
分子的空间构型是_______ 。键角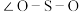
_______ 120°(选填“>”“<”或“=”)。
(5) 溶于水生成弱酸
溶于水生成弱酸 ,
, 氧化生成强酸
氧化生成强酸 ,试解析
,试解析 的酸性强于
的酸性强于 的原因
的原因_______ 。
(6)已知 的熔点是1370℃,
的熔点是1370℃, 的熔点是1194℃,
的熔点是1194℃, 熔点高于
熔点高于 的原因是
的原因是_______ 。
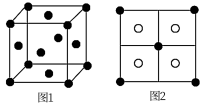
(7) 和
和 晶胞中的
晶胞中的 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的正四面体中心,它们的晶胞具有相同的侧视图(见图2)。
所构成的正四面体中心,它们的晶胞具有相同的侧视图(见图2)。 的晶胞参数为apm,阿伏加德罗常数为
的晶胞参数为apm,阿伏加德罗常数为 。下列说法正确的是_______(选填序号)。
。下列说法正确的是_______(选填序号)。
(8)已知 的晶胞如图3所示,其右上角表示
的晶胞如图3所示,其右上角表示 构成的八面体空隙内填充一个
构成的八面体空隙内填充一个 ,则该八面体内
,则该八面体内 与
与 的个数比
的个数比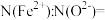
_______ 。 密度为
密度为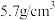 ,则晶胞内两个
,则晶胞内两个 间的最短距离为
间的最短距离为_______ pm(列式即可)。

 )的反应为:
)的反应为: 。请回答:
。请回答:(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的
表示,称为电子的自旋磁量子数。对于基态的 ,其价电子自旋磁量子数的代数和为
,其价电子自旋磁量子数的代数和为(2)当O原子的电子排布从
 变成
变成 时,形成的光谱名称是
时,形成的光谱名称是(3)高温煅烧时
 变成更稳定的
变成更稳定的 ,原因是
,原因是(4)
 分子的空间构型是
分子的空间构型是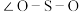
(5)
 溶于水生成弱酸
溶于水生成弱酸 ,
, 氧化生成强酸
氧化生成强酸 ,试解析
,试解析 的酸性强于
的酸性强于 的原因
的原因(6)已知
 的熔点是1370℃,
的熔点是1370℃, 的熔点是1194℃,
的熔点是1194℃, 熔点高于
熔点高于 的原因是
的原因是(7)
 和
和 晶胞中的
晶胞中的 的位置如图1所示,
的位置如图1所示, 位于
位于 所构成的正四面体中心,它们的晶胞具有相同的侧视图(见图2)。
所构成的正四面体中心,它们的晶胞具有相同的侧视图(见图2)。 的晶胞参数为apm,阿伏加德罗常数为
的晶胞参数为apm,阿伏加德罗常数为 。下列说法正确的是_______(选填序号)。
。下列说法正确的是_______(选填序号)。
A.利用X射线衍射实验可以区别 、 、 的晶胞 的晶胞 |
B. 晶胞中,Cu填充了晶胞中一半四面体空隙 晶胞中,Cu填充了晶胞中一半四面体空隙 |
C. 晶胞中, 晶胞中, 配位数为8 配位数为8 |
D. 晶胞的密度为 晶胞的密度为 |
 的晶胞如图3所示,其右上角表示
的晶胞如图3所示,其右上角表示 构成的八面体空隙内填充一个
构成的八面体空隙内填充一个 ,则该八面体内
,则该八面体内 与
与 的个数比
的个数比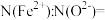
 密度为
密度为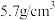 ,则晶胞内两个
,则晶胞内两个 间的最短距离为
间的最短距离为
您最近一年使用:0次
2022-06-30更新
|
214次组卷
|
2卷引用:湖南省常德市汉寿县第一中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
3 . 植物生长需要多种矿质元素,其中必需元素就多达14种,需要量比较大的有镁、硫、铁等元素。回答下列问题:
(1)基态Fe原子d轨道中成对电子数与未成对电子数之比为_______ 。
(2)第3周期中,第一电离能大于S的元素有_______ (填元素符号)。
(3)区分某固态物质是晶体还是非晶体最可靠的科学方法是对该固体进行_______ 试验。
(4)20世纪60年代美国化学家鲍林提出了一个经验规则:设含氧酸的化学式为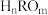 ,其中(
,其中(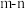 )为非羟基氧原子数。鲍林认为含氧酸的酸性强弱与非羟基氧原子数(
)为非羟基氧原子数。鲍林认为含氧酸的酸性强弱与非羟基氧原子数(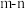 )的关系如表:
)的关系如表:
试简要回答下列问题:
①按此规则判断 、
、 、
、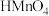 的酸性由弱到强的顺序为
的酸性由弱到强的顺序为_______ 。
②按此规则判断碳酸应属于_______ 酸,从电离常数来看,与通常认为的碳酸的酸性是否一致?_______ ,其可能的原因是_______ ,( :
: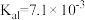 ;
; :
: )
)
(5)Mg与 在一定条件下可制得储氢物质X,其晶胞结构如图所示,晶胞棱边夹角均为90°,储氢物质X的化学式为
在一定条件下可制得储氢物质X,其晶胞结构如图所示,晶胞棱边夹角均为90°,储氢物质X的化学式为_______ ,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如C点原子的分数坐标为(1,0,0)。已知Mg—H键的键长为r pm,A点位于面对角线上,其原子分数坐标为_______ ,晶胞中A、B两个H之间的核间距d=_______ pm(用含a、c、r的代数式表示)。

(1)基态Fe原子d轨道中成对电子数与未成对电子数之比为
(2)第3周期中,第一电离能大于S的元素有
(3)区分某固态物质是晶体还是非晶体最可靠的科学方法是对该固体进行
(4)20世纪60年代美国化学家鲍林提出了一个经验规则:设含氧酸的化学式为
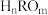 ,其中(
,其中(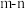 )为非羟基氧原子数。鲍林认为含氧酸的酸性强弱与非羟基氧原子数(
)为非羟基氧原子数。鲍林认为含氧酸的酸性强弱与非羟基氧原子数(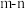 )的关系如表:
)的关系如表: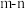 | 0 | 1 | 2 | 3 |
| 含氧酸酸性强弱 | 弱 | 中强 | 强 | 超强 |
| 实例 |  |  |  |  |
①按此规则判断
 、
、 、
、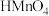 的酸性由弱到强的顺序为
的酸性由弱到强的顺序为②按此规则判断碳酸应属于
 :
: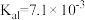 ;
; :
: )
)(5)Mg与
 在一定条件下可制得储氢物质X,其晶胞结构如图所示,晶胞棱边夹角均为90°,储氢物质X的化学式为
在一定条件下可制得储氢物质X,其晶胞结构如图所示,晶胞棱边夹角均为90°,储氢物质X的化学式为
您最近一年使用:0次
名校
解题方法
4 . 表明TiO2-aNb、Cu(In1-xGaxSe2)是光学活性物质,具有非常好的发展前景。
(1)已知铟的原子序数为49,基态铟原子的电子排布式为[Kr]_______ ;Ga、In、Se第一电离能从大到小顺序为_______ 。
(2)H2SeO3与 H2SO3中酸性更强的是_______ ;原因是_______ 。
(3)31Ga可以形成 GaCl3·xNH3(x=3、4、5、6) 等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,有沉淀生成;过滤后,充分加热滤液有氨逸出,且又有沉淀生成,两次沉淀的物质的量之比为1∶2,则该溶液中溶质的化学式为_______ 。
(4)Cu2+与NH3形成的配离子为[Cu(NH3)4]2+,在该配离子中,氮氢键的键角比独立存在的气态氨分子中键角略大,其原因是_______ 。 向[Cu(NH3)4]SO4溶液中加入乙醇能够析出深蓝色的晶体,试分析加入乙醇的作用:_______ 。
(5)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心,它们晶胞具有相同的侧视图,如图2所示。已知CuS和Cu2S的晶胞参数分别为a pm和b pm,阿伏加德罗常数的值为NA。
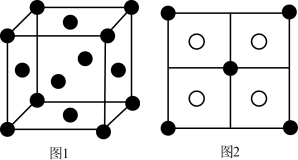
①CuS晶体中,相邻的两个铜离子间的距离为_______ pm。
②Cu2S晶体的密度为ρ=_______ g·cm-3(列出计算式即可)。
(1)已知铟的原子序数为49,基态铟原子的电子排布式为[Kr]
(2)H2SeO3与 H2SO3中酸性更强的是
(3)31Ga可以形成 GaCl3·xNH3(x=3、4、5、6) 等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,有沉淀生成;过滤后,充分加热滤液有氨逸出,且又有沉淀生成,两次沉淀的物质的量之比为1∶2,则该溶液中溶质的化学式为
(4)Cu2+与NH3形成的配离子为[Cu(NH3)4]2+,在该配离子中,氮氢键的键角比独立存在的气态氨分子中键角略大,其原因是
(5)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心,它们晶胞具有相同的侧视图,如图2所示。已知CuS和Cu2S的晶胞参数分别为a pm和b pm,阿伏加德罗常数的值为NA。

①CuS晶体中,相邻的两个铜离子间的距离为
②Cu2S晶体的密度为ρ=
您最近一年使用:0次
名校
5 . 海洋是元素的摇篮,海水中含有大量卤族元素。NaCl的晶胞结构示意图(晶胞边长为a nm)和晶胞截面图如下所示。

(1)元素Na的价电子被激发到相邻高能级后形成激发态Na原子,其价电子轨道表示式为___________ 。
(2)除了NaCl,Cl元素还能形成多种价态的化合物,如NaClO、NaClO2、NaClO3、NaClO4,这四种钠盐对应的酸的酸性依次增强,试解释HClO4的酸性强于HClO3的原因:___________ 。
(3)在适当的条件下,电解NaCl水溶液可制得NaClO3。
①NaCl水溶液中,不存在的微粒间作用力有___________ (填标号)。
A.离子键 B.极性键 C.配位键 D.氢键 E.范德华力
②根据价层电子对互斥理论,预测 的空间构型为
的空间构型为___________ ,写出一个 的等电子体的化学符号
的等电子体的化学符号___________ 。
(4)在NaCl晶体中,Na+位于Cl-所围成的___________ (填立体构型)的中心,该多面体的边长是___________ nm。
(5)Na+半径与Cl-半径的比值是___________ ( 保留小数点后三位, =1. 414)。
=1. 414)。

(1)元素Na的价电子被激发到相邻高能级后形成激发态Na原子,其价电子轨道表示式为
(2)除了NaCl,Cl元素还能形成多种价态的化合物,如NaClO、NaClO2、NaClO3、NaClO4,这四种钠盐对应的酸的酸性依次增强,试解释HClO4的酸性强于HClO3的原因:
(3)在适当的条件下,电解NaCl水溶液可制得NaClO3。
①NaCl水溶液中,不存在的微粒间作用力有
A.离子键 B.极性键 C.配位键 D.氢键 E.范德华力
②根据价层电子对互斥理论,预测
 的空间构型为
的空间构型为 的等电子体的化学符号
的等电子体的化学符号(4)在NaCl晶体中,Na+位于Cl-所围成的
(5)Na+半径与Cl-半径的比值是
 =1. 414)。
=1. 414)。
您最近一年使用:0次
名校
6 . 下列排序正确的是
| A.酸性:H2CO3<C6H5OH<CH3COOH |
| B.碱性:Ba(OH)2<Ca(OH)2<KOH |
| C.熔点:MgBr2<SiCl4<SiO2 |
| D.沸点:PH3<NH3<H2O |
您最近一年使用:0次
名校
7 . X、Y、Z、W、R为原子序数依次增大的五种短周期主族元素,X原子的最外层电子数是其内层电子数的2倍,W+与Y2 ─具有相同的电子层结构,R与Y可形成RY2、RY3化合物,下列说法正确的是
| A.Y与氢元素所形成的化合物分子只含有极性键 |
| B.W2Y、W2Y2中阴、阳离子个数比均为1:2 |
| C.Z的最高价氧化物对应水化物的酸性比R的强 |
| D.将XY2通入W单质与水反应后的溶液中,生成的盐只有一种 |
您最近一年使用:0次
2017-03-07更新
|
591次组卷
|
5卷引用:2017届湖南省三湘名校教育联盟高三第三次大联考理综化学试卷
2014·湖南长沙·一模
名校
解题方法
8 . 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的_________ 区;溴的价电子排布式为____________________ 。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________ 。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________ 。
(4)已知高碘酸有两种形式,化学式分别为H5IO6(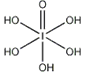 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____ HIO4。(填“>”、 “<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-。I3-离子的中心原子周围σ键电子对对数为_____ ,孤电子对对数为______ , I3-离子的空间构型为___________ 。
与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____ 式发生。 A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(6)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________ ,写出一个ClO2-的等电子体__________ 。
(7)下图为碘晶体晶胞结构。有关说法中正确的是_____________ 。

A.碘分子的排列有2种不同的取向,2种取向不同
的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(8)已知CaF2晶体(见下图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________ 。
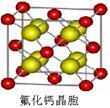
(1)卤族元素位于周期表的
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6(
 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-。I3-离子的中心原子周围σ键电子对对数为
与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列
(6)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为
(7)下图为碘晶体晶胞结构。有关说法中正确的是

A.碘分子的排列有2种不同的取向,2种取向不同
的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(8)已知CaF2晶体(见下图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为

您最近一年使用:0次
名校
9 . 下列结论错误的是
①微粒半径:K+>Al3+>S2->Cl- ②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4③离子的还原性:S2->Cl->Br->I- ④氧化性: Cl2>S⑤酸性:H2SO4>H3PO4>H2CO3>HClO⑥非金属性:O>N>P>Si ⑦金属性:Mg<Ca<K
①微粒半径:K+>Al3+>S2->Cl- ②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4③离子的还原性:S2->Cl->Br->I- ④氧化性: Cl2>S⑤酸性:H2SO4>H3PO4>H2CO3>HClO⑥非金属性:O>N>P>Si ⑦金属性:Mg<Ca<K
| A.只有① | B.①③ | C.②④⑤⑥⑦ | D.①③⑤ |
您最近一年使用:0次
2016-12-09更新
|
1385次组卷
|
7卷引用:湖南省衡阳县2017-2018学年高一下学期期末考试化学试题



