20-21高三上·江苏南通·阶段练习
名校
解题方法
1 . 短周期主族元素X、Y、Z、W原子序数依次增大,且X、Z同主族,Y的基态原子中含11种运动状态不同的电子, Z原子的最外层电子数与核外电子总数之比为3∶8。下列说法正确的是
| A.原子的半径:r(X)<r(Y)<r(Z)<r(W) |
| B.X与Y组成的化合物中均不含共价键 |
| C.简单气态氢化物的沸点X的比Z的高 |
| D.由X、Y、W三种元素组成的化合物的水溶液一定呈碱性 |
您最近一年使用:0次
2020-10-15更新
|
168次组卷
|
3卷引用:江苏省如皋市2021届高三上学期教学质量调研(一)化学(选修)试题
(已下线)江苏省如皋市2021届高三上学期教学质量调研(一)化学(选修)试题江苏省南京市第十三中学2021届高三上学期教学质量调研(一)化学试题江苏省镇江第一中学2020-2021学年高二下学期阶段性检测化学试题
名校
2 . 铋(83Bi)为第V A族元素,常见化合价为+3和+5。化合物NaBiO3为黄色固体,常温下微溶于水,在空气中逐渐分解产生Bi2O3、NaOH等物质。
(1)铋元素最外层电子分布在_____ 种能级中,共有_____ 种运动状态。
(2)铋酸钠NaBiO3中属于短周期元素的离子半径大小关系为_________ 。
(3)元素Na、Bi、O的金属性依次减弱,非金属性依次增强,请列举判断依据:_______ 。
(4)铋酸钠NaBiO3在空气中分解所得到产物中,化学键类型是______ 。
A.金属键 B.离子键 C.极性键 D.非极性键
(5)将NaBiO3加入MnSO4和H2SO4的混合溶液里加热,发生如下反应:
[ ]NaBiO3+[ ]MnSO4+[ ]H2SO4→[ ]Na2SO4+[ ]Bi2(SO4)3+[ ]NaMnO4+[ ]H2O
①配平该化学方程式,将系数填写在对应位置上。
______ NaBiO3+______ MnSO4+______ H2SO4→______ Na2SO4+______ Bi2(SO4)3+______ NaMnO4+______ H2O
②若有2mol氧化剂在该反应中被还原,则生成的MnO 被还原为Mn2+时,能将
被还原为Mn2+时,能将____ mol HCl氧化成Cl2。
(6)写出NaBiO3固体溶于HCl时发生反应的离子方程式:_________ 。
(1)铋元素最外层电子分布在
(2)铋酸钠NaBiO3中属于短周期元素的离子半径大小关系为
(3)元素Na、Bi、O的金属性依次减弱,非金属性依次增强,请列举判断依据:
(4)铋酸钠NaBiO3在空气中分解所得到产物中,化学键类型是
A.金属键 B.离子键 C.极性键 D.非极性键
(5)将NaBiO3加入MnSO4和H2SO4的混合溶液里加热,发生如下反应:
[ ]NaBiO3+[ ]MnSO4+[ ]H2SO4→[ ]Na2SO4+[ ]Bi2(SO4)3+[ ]NaMnO4+[ ]H2O
①配平该化学方程式,将系数填写在对应位置上。
②若有2mol氧化剂在该反应中被还原,则生成的MnO
 被还原为Mn2+时,能将
被还原为Mn2+时,能将(6)写出NaBiO3固体溶于HCl时发生反应的离子方程式:
您最近一年使用:0次
3 . 下列关于物质结构的说法错误的是
| A.晶格能:NaF>NaCl>NaBr |
| B.基态碳原子有三种能量不同的电子 |
C.CH4和 都是正四面体结构,键角均为109°28′ 都是正四面体结构,键角均为109°28′ |
| D.甲醛(HCHO)的键角约为120°,分子之间存在氢键 |
您最近一年使用:0次
2020-10-05更新
|
401次组卷
|
3卷引用:卓越联盟新高考省份2021届高三9月份检测化学试题
4 . 下列说法不正确的是
| A.1s、2s、 3s的电子云轮廓图均为球形,但电子的能量不同 |
| B.最外层电子数相同的原子不一定位于同一主族,也可能在同一周期 |
C.N原子的基态电子排布图为: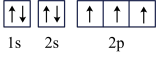 |
D.Fe3+的离子结构示意图为: |
您最近一年使用:0次
5 . 一种新型漂白剂(见下图)可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,Y的最外层p能级上只有一个单电子, X是地壳中含量最多的元素。W、Y、Z的最外层电子数之和等于X的最外层电子数,W、 X对应的简单离子核外电子排布相同。下 列叙述不正确的是
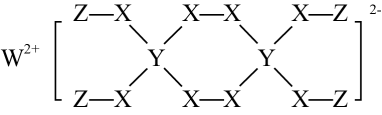

| A.Z原子中只有1个电子,故其核外只有1个原子轨道 |
| B.原子序数:W>X,对应的简单离子半径顺序:W<X |
| C.基态Y原子中有3种能量不同的电子,这些电子的运动状态共5种 |
| D.元素M是与Y同主族的短周期元素,则金属性W>M, 第一电离能W<M |
您最近一年使用:0次
2020-08-30更新
|
240次组卷
|
3卷引用:重庆市第八中学2019-2020学年高二下学期阶段性测试化学试题
6 . (1)写出碳原子最外电子层的轨道表示式___ 。
(2)钛(Ti)是22号元素,它是___ (选填编号)
a.主族元素 b.副族元素 c.短周期元素 d.长周期元素
(3)CS2分子的电子式为____ ;其熔沸点比CO2高的原因是___ 。
(4)氟化钠溶液中,不存在的微粒间作用力是___ (填标号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(5)金属铜单独与氨水或过氧化氢均不能反应,但可与过氧化氢和过量氨水的混合溶液反应生成一种配位化合物,其反应的化学方程式可表示为_____ 。
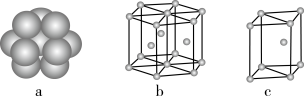
(6)镁单质晶体中原子的堆积模型为六方最密堆积(如图),它的晶胞是图中的___ (填a、b或c);配位数是____ ;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2acm3,镁单质的密度为ρg•cm-3,已知阿伏加 德罗常数为NA,则镁的摩尔质量的计算式是__ 。
(2)钛(Ti)是22号元素,它是
a.主族元素 b.副族元素 c.短周期元素 d.长周期元素
(3)CS2分子的电子式为
(4)氟化钠溶液中,不存在的微粒间作用力是
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(5)金属铜单独与氨水或过氧化氢均不能反应,但可与过氧化氢和过量氨水的混合溶液反应生成一种配位化合物,其反应的化学方程式可表示为

(6)镁单质晶体中原子的堆积模型为六方最密堆积(如图),它的晶胞是图中的
您最近一年使用:0次
7 . 中科院宁波研究所的“固态锂电池”即将量产,其技术世界领先。请完成下列问题:
(1)基态锂原子的电子排布式:______ ;基态锂原子中有_____ 种运动状态不同的电子。
(2)LiAlH4是重要的还原剂与储氢材料。其合成方法如下:① Na+Al+2H2 NaAlH4,②NaAlH4+LiCl
NaAlH4,②NaAlH4+LiCl LiAlH4+NaCl。
LiAlH4+NaCl。
①上述反应中涉及的元素的原子半径最大的是______ (填元素名称)。
②LiAlH4与水剧烈反应产生一种盐与 H2,写出反应的化学方程式:_______ 。
③LiAlH4中 H元素表现为-1价,Li元素为+1价,解释H表现出负价的理由:_______ 。
(3)Mg与 Al的电离能如下(kJ·mol-1):
第一电离能 Mg大于 Al,但第二电离能 Mg小于 Al,解释原因:_________ 。
(4)上述物质的元素中电负性最大的元素与电负性最小的元素形成的化合物的电子式为__________ 。
(1)基态锂原子的电子排布式:
(2)LiAlH4是重要的还原剂与储氢材料。其合成方法如下:① Na+Al+2H2
 NaAlH4,②NaAlH4+LiCl
NaAlH4,②NaAlH4+LiCl LiAlH4+NaCl。
LiAlH4+NaCl。①上述反应中涉及的元素的原子半径最大的是
②LiAlH4与水剧烈反应产生一种盐与 H2,写出反应的化学方程式:
③LiAlH4中 H元素表现为-1价,Li元素为+1价,解释H表现出负价的理由:
(3)Mg与 Al的电离能如下(kJ·mol-1):
| Mg | 737.7 | 1450.7 | … |
| Al | 577.5 | 1816.7 | … |
(4)上述物质的元素中电负性最大的元素与电负性最小的元素形成的化合物的电子式为
您最近一年使用:0次
2020-08-21更新
|
165次组卷
|
3卷引用:吉林省松原市扶余市第一中学2019-2020学年高二下学期期中考试化学试题
吉林省松原市扶余市第一中学2019-2020学年高二下学期期中考试化学试题山西省运城市2019-2020学年高二下学期期末测试化学试题(已下线)第01章 原子结构与元素性质(A卷基础强化篇)-2020-2021学年高二化学选择性必修2同步单元AB卷(新教材鲁科版)
8 . 某高效制氨剂的结构如下图,下列说法正确的是
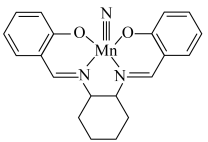

A. 元素电离能 元素电离能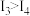 |
B.叁键键能: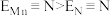 |
C.该化合物中的苯分子中含有大Ⅱ键 ,吡啶( ,吡啶(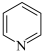 )中也含有大Ⅱ键 )中也含有大Ⅱ键 |
| D.该化合物中基态氧原子最高能级的电子云形状为球形 |
您最近一年使用:0次
解题方法
9 . 钾和碘的相关化合物在化工、医药、材料等领域有广泛的应用。回答下列问题:
(1)钾元素的焰色为紫色,该过程中其原子光谱属于______ 光谱(选填“吸收”或“发射”)。
(2)碘原子中,占据最高能级的电子的电子云轮廓图形状为______ 。
(3)请写出基态钾原子的核外电子排布式______ 。
(4)请比较KI与KCl晶体的熔点高低______ ,并说明理由:______ 。
(5)KIO3常用作食盐添加剂,其晶胞如图所示。

① 离子的立体构型为
离子的立体构型为______ 。
②已知KIO3晶胞的边长为apm,晶胞中K、I、O原子分别处于顶角、体心、面心位置。则每个K原子周围距离最短的O原子有______ 个。该晶胞的密度为______ g/cm3。
(1)钾元素的焰色为紫色,该过程中其原子光谱属于
(2)碘原子中,占据最高能级的电子的电子云轮廓图形状为
(3)请写出基态钾原子的核外电子排布式
(4)请比较KI与KCl晶体的熔点高低
(5)KIO3常用作食盐添加剂,其晶胞如图所示。

①
 离子的立体构型为
离子的立体构型为②已知KIO3晶胞的边长为apm,晶胞中K、I、O原子分别处于顶角、体心、面心位置。则每个K原子周围距离最短的O原子有
您最近一年使用:0次
10 . 下列各项叙述中,正确的是
| A.所有原子任一能层的s电子云轮廓图都是球形,且球的半径大小相同 |
| B.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 |
| C.Cr原子的电子排布式是1s22s22p63s23p63d44s2 |
D.基态Ni原子的价电子排布图: |
您最近一年使用:0次



