解题方法
1 . 镓(31Ga)是一种重要金属元素,镓及其化合物在电子工业、光电子工业、国防工业和超导材料等领域有着广泛的应用。回答下列问题:
(1)基态Ga原子占据最高能级电子的电子云轮廓图形状为__________ ,未成对电子数为________________ 。
(2)Ga(NO3)3中阴离子的立体构型是_____________ ,写出一个与该阴离子的立体构型相同的分子的化学式___________ 。
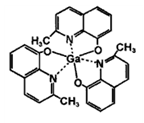
(3)2-甲基-8-羟基喹啉镓(如图)应用于分子印迹技术,2-甲基-8-羟基喹啉镓中五种元素电负性由大到小的顺序是____________________________ (填元素符号),提供孤电子对的成键原子是_____________ 。
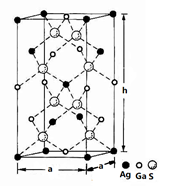
(4)一种硅镓半导体材料的晶胞结构如图所示由硫、镓、银形成的化合物的晶胞是底面为正方形的长方体,结构如下图所示,则该晶体中硫的配位数为___________ ,晶胞底面的边长a=5.75 nm,高h=10.30nm,该晶体密度为__________________ g·cm-3(列出计算式即可)。
(1)基态Ga原子占据最高能级电子的电子云轮廓图形状为
(2)Ga(NO3)3中阴离子的立体构型是
(3)2-甲基-8-羟基喹啉镓(如图)应用于分子印迹技术,2-甲基-8-羟基喹啉镓中五种元素电负性由大到小的顺序是

(4)一种硅镓半导体材料的晶胞结构如图所示由硫、镓、银形成的化合物的晶胞是底面为正方形的长方体,结构如下图所示,则该晶体中硫的配位数为

您最近一年使用:0次
2018-04-28更新
|
347次组卷
|
2卷引用:【全国市级联考】安徽省淮北市2018届高三第二次模拟考试理综化学试题
11-12高三上·上海长宁·期末
解题方法
2 . 已知某种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,X元素的原子核外共有20种不同运动状态的电子,Y元素的原子核外共有5种不同能级的电子,且XY2中阳离子和阴离子的电子层结构相同。
(1)该融雪剂的化学式是_________ ;电子式为:_________ ;
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是____________ ;D与E能形成一种非极性分子,该分子的结构式为 ________ ;E的单质中,质软有润滑性的是___________ (填写单质名称)。
(3)元素W在D的同一周期,其单质是原子晶体;元素Z的气态单质分子Z2中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式可能是___________ 。
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为____________________________________ 。
(1)该融雪剂的化学式是
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是
(3)元素W在D的同一周期,其单质是原子晶体;元素Z的气态单质分子Z2中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式可能是
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为
您最近一年使用:0次
11-12高三上·上海奉贤·期末
解题方法
3 . 工业制玻璃主要原料有石英、纯碱和石灰石.在玻璃窑中发生主要反应的化学方程式为:Na2CO3+SiO2 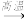 Na2SiO3+CO2↑;CaCO3+SiO2
Na2SiO3+CO2↑;CaCO3+SiO2 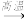 CaSiO3+CO2↑
CaSiO3+CO2↑
(1)普通玻璃的成分是Na2CaSi6O14,它的氧化物形式为________ ,则原料中SiO2、Na2CO3、CaCO3的物质的量之比为_________________________ 。
(2)在上述反应的反应物和生成物中,属于非极性分子的电子式___________________ ,有_____________ 种不同类型的晶体(填数字)
(3)在上述普通玻璃的组成元素中某元素与铝元素同周期且原子半径比铝原子半径大,该元素离子半径比铝离子半径___________ (填“大”或“小”),该元素与铝元素两者的最高价氧化物的水化物之间发生反应的离子方程式为__________________________ 。
(4)在上述普通玻璃的组成元素中,与铝元素同周期的另一元素的原子最外层共有________ 种不同运动状态的电子、________ 种不同能级的电子。
 Na2SiO3+CO2↑;CaCO3+SiO2
Na2SiO3+CO2↑;CaCO3+SiO2  CaSiO3+CO2↑
CaSiO3+CO2↑(1)普通玻璃的成分是Na2CaSi6O14,它的氧化物形式为
(2)在上述反应的反应物和生成物中,属于非极性分子的电子式
(3)在上述普通玻璃的组成元素中某元素与铝元素同周期且原子半径比铝原子半径大,该元素离子半径比铝离子半径
(4)在上述普通玻璃的组成元素中,与铝元素同周期的另一元素的原子最外层共有
您最近一年使用:0次
名校
解题方法
4 . 下列描述中正确的是
| A.CS2 为空间构型为 V 形的极性分子 |
| B.双原子或多原子形成的气体单质中,一定有σ键,可能有π键 |
| C.氢原子电子云的一个小黑点表示一个电子 |
| D.HCN、SiF4 和 SO32- 的中心原子均为 sp3 杂化 |
您最近一年使用:0次
2018-01-18更新
|
407次组卷
|
8卷引用:辽宁省大连市普兰店市第三十八中学2021届高三第一学期开学考试化学试题
辽宁省大连市普兰店市第三十八中学2021届高三第一学期开学考试化学试题辽宁省实验中学、大连八中、大连二十四中、鞍山一中、东北育才学校2017-2018学年高二上学期期末考试化学试题【全国百强校】内蒙古北方重工业集团有限公司第三中学2017-2018学年高二下学期期末考试化学试题【全国百强校】安徽省铜陵市第一中学2018-2019学年高二上学期开学考试化学试题【全国百强校】福建省厦门第一中学2018-2019学年高二上学期期中考试化学试题安徽省淮北师范大学附属实验中学2018-2019学年高二下学期第二次月考化学试题辽宁省六校协作体2019-2020高二下学期期初考试化学试卷(已下线)第二单元 化学键与分子间作用力(能力提升卷)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)
5 . 铝及其化合物在日常生活、工业上有广泛的应用。
(1)铝原子核外有_____ 种不同运动状态的电子,有_____ 种能量不同的电子。
(2)氮化铝具有强度高,耐磨,抗腐蚀,熔点可达2200℃。推测氮化铝是______ 晶体,试比较组成该物质的两微粒半径大小____________________ 。
(3)可用铝和氧化钡反应可制备金属钡:2Al+4BaO 3Ba↑+BaO·Al2O3的主要原因是
3Ba↑+BaO·Al2O3的主要原因是 __________ (选填编号)。
(4)氢氧化铝在水中发生酸式电离的电离方程式为:____________________ ,
滴入少量盐酸,上述体系中Al3+浓度_______ (填“增加”、“减少”或“不变”)。
(5)工业上用氢氧化铝、氢氟酸和碳酸钠制取冰晶石(Na3AlF6)。其反应物中有两种元素在周期表中位置相邻,可比较它们金属性或非金属性强弱的是_______ (选填编号)。
a.气态氢化物的稳定性
b.最高价氧化物对应水化物的酸(碱)性
c.单质与氢气反应的难易
d.单质与同浓度酸发生反应的快慢
(6)冰晶石可做电解氧化铝的助熔剂,此反应中若有0.6mol电子转移,则在________ 极可得金属铝的质量为__________ 克。工业上不用电解氯化铝而是用电解氧化铝的方法获得铝单质的原因_____________________ 。
(1)铝原子核外有
(2)氮化铝具有强度高,耐磨,抗腐蚀,熔点可达2200℃。推测氮化铝是
(3)可用铝和氧化钡反应可制备金属钡:2Al+4BaO
 3Ba↑+BaO·Al2O3的主要原因是
3Ba↑+BaO·Al2O3的主要原因是 a.Al活泼性大于Ba | b.Ba沸点比Al的低 | c.BaO·Al2O3比Al2O3稳定 |
滴入少量盐酸,上述体系中Al3+浓度
(5)工业上用氢氧化铝、氢氟酸和碳酸钠制取冰晶石(Na3AlF6)。其反应物中有两种元素在周期表中位置相邻,可比较它们金属性或非金属性强弱的是
a.气态氢化物的稳定性
b.最高价氧化物对应水化物的酸(碱)性
c.单质与氢气反应的难易
d.单质与同浓度酸发生反应的快慢
(6)冰晶石可做电解氧化铝的助熔剂,此反应中若有0.6mol电子转移,则在
您最近一年使用:0次
解题方法
6 . 现有短周期元素A、B、C、D。A元素M层上有2对成对电子,D与A在周期表中同一主族。由A、B与D组成的化合物的浓溶液是常见的干燥剂,常温下C单质为双原子分子,其氢化物水溶液呈碱性,是一种重要的肥料。
(1)A的原子最外层共有__________ 种不同运动状态的电子,该层电子亚层有__________ 种。描述集气瓶中足量的A的氢化物与其低价态氧化物混合后,充分反应的实验现象:_____________________ 。
(2)元素A、B与D组成的化合物的浓溶液是常见干燥剂,其化学式是_______ 。写出该化合物在实验室制备乙酸乙酯时所起的作用:________________ 。
(3)B与C元素形成带一个单位正电荷的离子,写成该微粒的电子式_____ 。写出实验室检验溶液中该离子的简单实验方案:_______________ 。
(4)元素A与元素D相比,非金属性较强的是____________ (用元素符号表示),下列表述中能表明这一事实的是______
①比较最高价氧化物对应水化物的酸性
②比较对应气态氢化物的稳定性
③一定条件下D能从A的氢化物水溶液中置换出A单质
④A单质的熔沸点明显高于D单质
(5)C的氢化物固态时属于__________ 晶体,该氢化物与A的最高价氧化物水化物反应的化学方程式是_______________ 。
(1)A的原子最外层共有
(2)元素A、B与D组成的化合物的浓溶液是常见干燥剂,其化学式是
(3)B与C元素形成带一个单位正电荷的离子,写成该微粒的电子式
(4)元素A与元素D相比,非金属性较强的是
①比较最高价氧化物对应水化物的酸性
②比较对应气态氢化物的稳定性
③一定条件下D能从A的氢化物水溶液中置换出A单质
④A单质的熔沸点明显高于D单质
(5)C的氢化物固态时属于
您最近一年使用:0次
7 . 以下对核外电子运动状况的描述正确的是( )
| A.电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转 |
| B.能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动 |
| C.能层序数越大,s原子轨道的半径越大 |
| D.在同一能级上运动的电子,其运动状态肯定不同 |
您最近一年使用:0次
2016-12-09更新
|
842次组卷
|
5卷引用:题型73 电子云和电子运动状态
(已下线)题型73 电子云和电子运动状态(已下线)2012年人教版高中化学选修3 1.1原子结构练习卷2016-2017学年甘肃省武威市第十八中学高二下学期第一次月考化学试卷河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1(人教版2019)选择性必修2 第一章 原子结构与性质 第一节 原子结构
8 . n、l、m确定后,仍不能确定该量子数组合所描述的原子轨道的
| A.数目 | B.形状 | C.能量 | D.所填充的电子数目 |
您最近一年使用:0次
2016-12-09更新
|
935次组卷
|
2卷引用:江西省玉山县第一中学2017届高三化学板块复习测试:物质结构与性质
9 . 下列说法正确的是
| A.熔点:Na-K合金<Na<氯化钠 |
| B.非金属氢化物的稳定性顺序:H2O>H2S>H2Se,HCl<H2S<PH3 |
| C.CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2 |
| D.同一原子中,2p、3p、4p能级的轨道数依次增多 |
您最近一年使用:0次
2016-12-09更新
|
317次组卷
|
2卷引用:2020届高三化学二轮物质结构题型专攻——核外电子排布和运动【选择基础专练】
解题方法
10 . 如图是元素周期表中关于碘元素的信息,其中解读正确的是


| A.碘元素的质子数为53 |
| B.碘原子的质量数为126.9 |
| C.碘原子核外有5种不同能量的电子 |
| D.碘原子最外层有7种不同运动状态的电子 |
您最近一年使用:0次
2016-12-09更新
|
319次组卷
|
2卷引用:2015届上海市普陀区高三4月质量调研(二模)化学试卷



