1 . 依据原子结构知识回答下列问题。
(1)下列有关说法错误的是___________。
(2)基态V原子中具有___________ 种不同能量的电子,具有___________ 种不同空间运动状态的电子,具有___________ 种不同运动状态的电子。
(3)基态Cu原子的简化电子排布式为___________ ,基态Se原子的价电子轨道表示式为___________ ,基态Mn2+的价电子排布式为___________ 。
(1)下列有关说法错误的是___________。
| A.简单离子的还原性:P3->O2->F- |
| B.在元素周期表第二周期中元素原子的第一电离能介于硼和氮之间的元素有两种 |
| C.焰色试验与电子跃迁有关 |
| D.基态铝原子占据的最高能级的电子云轮廓图的形状为球形 |
(3)基态Cu原子的简化电子排布式为
您最近半年使用:0次
2 . 按要求回答下列问题:
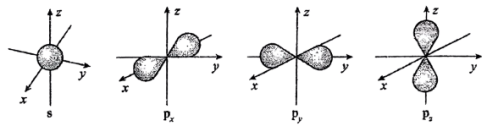
(1)如图是s能级和p能级的电子云轮廓图,试回答问题。______ 形,每个p能级有______ 个原子轨道。
(2)按要求作答:
①画出氯原子结构示意图______ ;
②写出基态O核外电子排布式为:______ ;
③写出基态N的原子轨道表示式:______ ;
(3)Sm的价层电子排布式为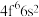 ,则
,则 价层电子排布式为
价层电子排布式为______ 。
(1)如图是s能级和p能级的电子云轮廓图,试回答问题。
(2)按要求作答:
①画出氯原子结构示意图
②写出基态O核外电子排布式为:
③写出基态N的原子轨道表示式:
(3)Sm的价层电子排布式为
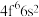 ,则
,则 价层电子排布式为
价层电子排布式为
您最近半年使用:0次
3 . 按要求回答下列问题:
(1)基态K原子中,核外电子占据最高能层的符号是___ ,占据该能层电子的电子云轮廓图形状____ 。
(2)Fe成为阳离子时首先失去_______ 轨道电子,写出Fe2+简化核外电子排布_______ 。
(3)P位于元素周期表中第三周期_______ 族,基态P原子核外未成对电子有_______ 个。
(1)基态K原子中,核外电子占据最高能层的符号是
(2)Fe成为阳离子时首先失去
(3)P位于元素周期表中第三周期
您最近半年使用:0次
2024-04-24更新
|
41次组卷
|
2卷引用:陕西省西安市周至县第四中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
4 . 运用物质结构与性质的相关知识,回答下列问题:
(1) 分子中,与
分子中,与 原子相连的
原子相连的 呈正电性
呈正电性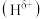 ,与
,与 原子相连的
原子相连的 呈负电性
呈负电性 电负性大小顺序是
电负性大小顺序是_______ 。基态 原子中能量最高的电子所在的原子轨道的电子云在空间上有
原子中能量最高的电子所在的原子轨道的电子云在空间上有_____ 个伸展方向,原子轨道呈______ 形。
(2) 的价层电子排布式为
的价层电子排布式为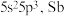 在周期表中的位置为
在周期表中的位置为________ , 价电子轨道表示式为
价电子轨道表示式为________ 。
(3) 是离子晶体,其晶格能可通过Born-Haber循环计算得到。
是离子晶体,其晶格能可通过Born-Haber循环计算得到。
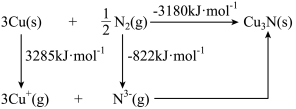
通过图中数据________ (填“能”或“不能”)计算出 原子的第一电离能,
原子的第一电离能, 的晶格能为
的晶格能为________  。
。
(4)GaAs的晶胞结构如图甲。将Mn掺杂到GaAs的晶体中得到稀磁性半导体材料(图乙)。
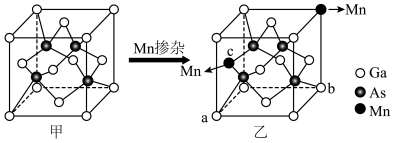
①GaAs晶胞中距离Ga原子最近As原子的个数为________ 。
②掺杂 之后,晶体中
之后,晶体中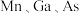 的原子个数比为
的原子个数比为________ (化为最简整数比)。
(1)
 分子中,与
分子中,与 原子相连的
原子相连的 呈正电性
呈正电性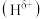 ,与
,与 原子相连的
原子相连的 呈负电性
呈负电性 电负性大小顺序是
电负性大小顺序是 原子中能量最高的电子所在的原子轨道的电子云在空间上有
原子中能量最高的电子所在的原子轨道的电子云在空间上有(2)
 的价层电子排布式为
的价层电子排布式为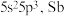 在周期表中的位置为
在周期表中的位置为 价电子轨道表示式为
价电子轨道表示式为(3)
 是离子晶体,其晶格能可通过Born-Haber循环计算得到。
是离子晶体,其晶格能可通过Born-Haber循环计算得到。
通过图中数据
 原子的第一电离能,
原子的第一电离能, 的晶格能为
的晶格能为 。
。(4)GaAs的晶胞结构如图甲。将Mn掺杂到GaAs的晶体中得到稀磁性半导体材料(图乙)。

①GaAs晶胞中距离Ga原子最近As原子的个数为
②掺杂
 之后,晶体中
之后,晶体中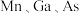 的原子个数比为
的原子个数比为
您最近半年使用:0次
5 . 我国硒储量居世界首位,硒广泛用于冶金、陶瓷、电子、太阳能等领域。工业上常将含硒废料处理得到亚硒酸( )和硒酸(
)和硒酸(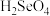 ),进而制备单质硒。
),进而制备单质硒。
(1)基态硒原子核外电子的空间运动状态有________ 种。
(2)甲硒醇(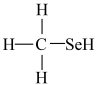 )的熔沸点低于甲醇(
)的熔沸点低于甲醇(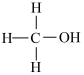 ),原因是
),原因是________________ 。
(3) 亚硒酸溶液中含硒微粒的分布系数
亚硒酸溶液中含硒微粒的分布系数 与溶液
与溶液 的关系如图所示。(分布系数即各组分的平衡浓度占总浓度的分数)
的关系如图所示。(分布系数即各组分的平衡浓度占总浓度的分数)
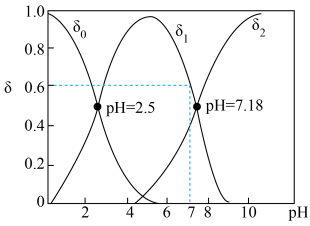
①曲线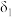 表示的含硒微粒是
表示的含硒微粒是________ 。
②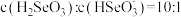 ,溶液
,溶液
________ 。
③向溶液中滴入氨水, 由5.5增大到7.3的过程中,主要反应的离子方程式为
由5.5增大到7.3的过程中,主要反应的离子方程式为________________ , 时,溶液中
时,溶液中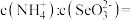
_______ 。
④在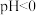 的酸性环境下,向溶液中通入
的酸性环境下,向溶液中通入 制得单质
制得单质 的离子方程式为
的离子方程式为________________ 。
(4) 可以用于测定粗硒中硒的含量,操作步骤如下:
可以用于测定粗硒中硒的含量,操作步骤如下:
Ⅰ.用浓 将样品中的
将样品中的 氧化为
氧化为 ;
;
Ⅱ.用 溶液还原
溶液还原 为
为 ,同时生成
,同时生成 ;
;
Ⅲ.以淀粉为指示剂,用 标准溶液滴定Ⅱ中生成的
标准溶液滴定Ⅱ中生成的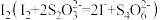 。
。
实验中准确称量 粗硒样品,滴定中消耗
粗硒样品,滴定中消耗 的
的 标准溶液
标准溶液 。
。
①滴定终点的现象为________ 。
②粗硒样品中硒的质量分数为________ 。
 )和硒酸(
)和硒酸(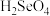 ),进而制备单质硒。
),进而制备单质硒。(1)基态硒原子核外电子的空间运动状态有
(2)甲硒醇(
 )的熔沸点低于甲醇(
)的熔沸点低于甲醇( ),原因是
),原因是(3)
 亚硒酸溶液中含硒微粒的分布系数
亚硒酸溶液中含硒微粒的分布系数 与溶液
与溶液 的关系如图所示。(分布系数即各组分的平衡浓度占总浓度的分数)
的关系如图所示。(分布系数即各组分的平衡浓度占总浓度的分数)
①曲线
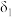 表示的含硒微粒是
表示的含硒微粒是②
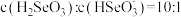 ,溶液
,溶液
③向溶液中滴入氨水,
 由5.5增大到7.3的过程中,主要反应的离子方程式为
由5.5增大到7.3的过程中,主要反应的离子方程式为 时,溶液中
时,溶液中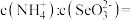
④在
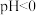 的酸性环境下,向溶液中通入
的酸性环境下,向溶液中通入 制得单质
制得单质 的离子方程式为
的离子方程式为(4)
 可以用于测定粗硒中硒的含量,操作步骤如下:
可以用于测定粗硒中硒的含量,操作步骤如下:Ⅰ.用浓
 将样品中的
将样品中的 氧化为
氧化为 ;
; Ⅱ.用
 溶液还原
溶液还原 为
为 ,同时生成
,同时生成 ;
;Ⅲ.以淀粉为指示剂,用
 标准溶液滴定Ⅱ中生成的
标准溶液滴定Ⅱ中生成的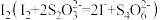 。
。实验中准确称量
 粗硒样品,滴定中消耗
粗硒样品,滴定中消耗 的
的 标准溶液
标准溶液 。
。①滴定终点的现象为
②粗硒样品中硒的质量分数为
您最近半年使用:0次
解题方法
6 . 回答下列问题:
(1)某基态原子的价层电子的轨道表示式为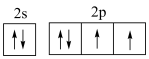
①s电子的电子云轮廓图是______________ 形
②有______________ 种空间运动状态不同的电子
③最外层有______________ 个电子
④有______________ 种能量不同的电子
(2)四种元素基态原子的电子排布式如下:①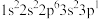 ;②
;② ;③
;③ ;④
;④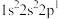
①第一电离能:①______________ ②(填“>”、“=”或“<”)
②电负性:③______________ ④(填“>”、“=”或“<”)
(1)某基态原子的价层电子的轨道表示式为

①s电子的电子云轮廓图是
②有
③最外层有
④有
(2)四种元素基态原子的电子排布式如下:①
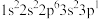 ;②
;② ;③
;③ ;④
;④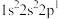
①第一电离能:①
②电负性:③
您最近半年使用:0次
7 . 完成下列问题
(1)As元素在周期表中的位置为___________ ,基态硫原子核外电子的空间运动状态有___________ 种。
(2)基态镍原子价电子排布图为___________ ,Cu形成 失去
失去___________ 轨道电子。
(3)下列状态的镁,电离最外层一个电子所需能量最大的是___________ (填标号);当镁从B状态变到C状态,形成的是___________ 光谱(选填“发射”或“吸收”)。
A. B.
B. C.
C.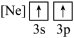 D.
D.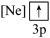
(1)As元素在周期表中的位置为
(2)基态镍原子价电子排布图为
 失去
失去(3)下列状态的镁,电离最外层一个电子所需能量最大的是
A.
 B.
B. C.
C. D.
D.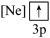
您最近半年使用:0次
2024-01-30更新
|
324次组卷
|
2卷引用:浙江省义乌市义亭中学2023-2024学年高二上学期化学期末模拟试题(一)
8 . 根据有关知识,回答下列问题。
(1)符号 所代表的含义是__________(填字母)。
所代表的含义是__________(填字母)。
(2)铝原子核外电子云有__________ 种不同的伸展方向,有__________ 种不同运动状态的电子。
(3)短周期的化学元素(0族和放射性元素除外)中,第一电离能最小的元素是__________ (填元素符号,下同),电负性最大的元素是__________ 。
(4)Be的第一电离能大于B的第一电离能,这是因为__________ 。
(5)短周期元素中符合“对角线规则”的元素有Be和Al、B和Si,它们的性质分别有一定的相似性,写出 与NaOH溶液反应的离子方程式:
与NaOH溶液反应的离子方程式:__________ 。
(6)锰元素位于第四周期第ⅦB族,请写出基础 的价层电子排布式
的价层电子排布式__________ 。
(1)符号
 所代表的含义是__________(填字母)。
所代表的含义是__________(填字母)。A. 轨道上有3个电子 轨道上有3个电子 |
B.第3个电子层 轨道有三个伸展方向 轨道有三个伸展方向 |
C. 电子云有3个伸展方向 电子云有3个伸展方向 |
| D.第3个电子层沿x轴方向伸展的p轨道 |
(3)短周期的化学元素(0族和放射性元素除外)中,第一电离能最小的元素是
(4)Be的第一电离能大于B的第一电离能,这是因为
(5)短周期元素中符合“对角线规则”的元素有Be和Al、B和Si,它们的性质分别有一定的相似性,写出
 与NaOH溶液反应的离子方程式:
与NaOH溶液反应的离子方程式:(6)锰元素位于第四周期第ⅦB族,请写出基础
 的价层电子排布式
的价层电子排布式
您最近半年使用:0次
9 . 研究含氮化合物对消除环境污染,能源结构的改变,食品添加剂的研究等有重要意义。
(1)甘氨酸锌常用于食品的添加剂,也可代替甘油作烟丝的加香、防冻。一水合甘氨酸锌结构简式如图所示。

①在H、N、O、C、 元素中,不属于P区元素的有:
元素中,不属于P区元素的有:_______
②基态O原子最高能级的原子轨道形状是_______
(2)“中国制造2025”是中国政府实施制造强国战略第一个十年行动领。氮化铬在现代工业中发挥了重要的作用。
①基态N原子的价层电子的轨道表示式为_______ 。
②基态 原子的价层电子排布式为
原子的价层电子排布式为_______ 。
(3) 在空气中存在如下反应:
在空气中存在如下反应: ,该反应分两步完成,其反应历程如图所示:则决定总反应的速率这一步的热化学方程式为:
,该反应分两步完成,其反应历程如图所示:则决定总反应的速率这一步的热化学方程式为:_______
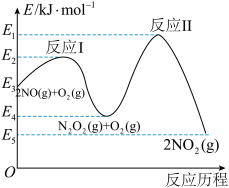
(4)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物( 、
、 、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。发生以下反应:
、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。发生以下反应:
Ⅰ.
II.
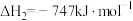
若 的燃烧热为283.5
的燃烧热为283.5 ,则反应Ⅰ的
,则反应Ⅰ的
_______ 
(5)已知1 化学键断开吸收或生成时释放的能量如下:
化学键断开吸收或生成时释放的能量如下: 436
436 ,
, 193
193 ,
, 946
946 。已知:
。已知: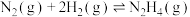
 ,则生成1
,则生成1
 释放的能量是
释放的能量是_______  。
。
(1)甘氨酸锌常用于食品的添加剂,也可代替甘油作烟丝的加香、防冻。一水合甘氨酸锌结构简式如图所示。

①在H、N、O、C、
 元素中,不属于P区元素的有:
元素中,不属于P区元素的有:②基态O原子最高能级的原子轨道形状是
(2)“中国制造2025”是中国政府实施制造强国战略第一个十年行动领。氮化铬在现代工业中发挥了重要的作用。
①基态N原子的价层电子的轨道表示式为
②基态
 原子的价层电子排布式为
原子的价层电子排布式为(3)
 在空气中存在如下反应:
在空气中存在如下反应: ,该反应分两步完成,其反应历程如图所示:则决定总反应的速率这一步的热化学方程式为:
,该反应分两步完成,其反应历程如图所示:则决定总反应的速率这一步的热化学方程式为:
(4)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(
 、
、 、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。发生以下反应:
、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。发生以下反应:Ⅰ.

II.

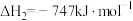
若
 的燃烧热为283.5
的燃烧热为283.5 ,则反应Ⅰ的
,则反应Ⅰ的

(5)已知1
 化学键断开吸收或生成时释放的能量如下:
化学键断开吸收或生成时释放的能量如下: 436
436 ,
, 193
193 ,
, 946
946 。已知:
。已知: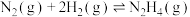
 ,则生成1
,则生成1
 释放的能量是
释放的能量是 。
。
您最近半年使用:0次
名校
解题方法
10 . Zn、V、Cu、In、S和Se等原子是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:
(1)49In的价层电子排布式为_______ 。
(2)Zn、O、S和Se的电负性由大到小的顺序为_______ 。制备荧光材料过程中会产生少量SO 、VO
、VO ,其中V原子采用
,其中V原子采用_______ 杂化,VO 空间结构为
空间结构为_______ ,SO 的空间构型为
的空间构型为_______ 。
(3)C、N、S分别与H形成的简单氢化物中键角最小的是_______ ,其原因是_______ 。
(4)H、C、N、S四种元素可形成硫氰酸(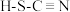 )和异硫氰酸(H-N=C=S),异硫氰酸分子中σ键与π键的数目比为
)和异硫氰酸(H-N=C=S),异硫氰酸分子中σ键与π键的数目比为_______ ,异硫氰酸沸点较高,原因是_______ 。
(5)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用−
表示,与之相反的用− 表示,称为电子的自旋量子数。对于基态Cu原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋量子数。对于基态Cu原子,其价电子自旋磁量子数的代数和为_______ 。
(1)49In的价层电子排布式为
(2)Zn、O、S和Se的电负性由大到小的顺序为
 、VO
、VO ,其中V原子采用
,其中V原子采用 空间结构为
空间结构为 的空间构型为
的空间构型为(3)C、N、S分别与H形成的简单氢化物中键角最小的是
(4)H、C、N、S四种元素可形成硫氰酸(
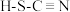 )和异硫氰酸(H-N=C=S),异硫氰酸分子中σ键与π键的数目比为
)和异硫氰酸(H-N=C=S),异硫氰酸分子中σ键与π键的数目比为(5)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用−
表示,与之相反的用− 表示,称为电子的自旋量子数。对于基态Cu原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋量子数。对于基态Cu原子,其价电子自旋磁量子数的代数和为
您最近半年使用:0次



