解题方法
1 . 下列说法正确的是
| A.未成对电子数:O>N | B.π键数目:CH2=CH2>CH≡CH |
| C.杂化轨道数:BCl3>CCl4 | D.第一电离能:N>O>C |
您最近半年使用:0次
解题方法
2 . 短周期主族元素X、Y、Z、W的原子序数依次增大,X与Y位于不同周期,Y与W位于同一主族,Y、Z原子的最外层电子数之和等于它们的内层电子总数之和,W在同周期主族元素的基态原子中第一电离能最大。下列说法中不正确的是
| A.与X同主族的元素的基态原子最外层电子所占轨道呈球形 |
| B.Y、Z、W均位于元素周期表的p区 |
| C.仅由Z、W两种元素组成的化合物不止一种 |
| D.Z的最高价氧化物对应的水化物一定为强酸 |
您最近半年使用:0次
解题方法
3 . 金属钛( )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
(1) 元素在周期表中的分区是位于
元素在周期表中的分区是位于___________ 区。基态 原子中含有的未成对电子数是
原子中含有的未成对电子数是___________ 。
(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为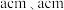 和
和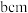 ,结构如下图所示。
,结构如下图所示。___________ , 位于距离最近的
位于距离最近的 构成的
构成的___________ 中心(填字母序号,下同)。
a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为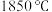 ,其晶体类型
,其晶体类型最不可 能是___________ 。
a.共价晶体 b.离子晶体 c.分子晶体
③若已知 该氧化物晶体体积为
该氧化物晶体体积为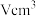 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为___________  。
。
(3)以钓铁矿 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下: 元素在元素周期表中的位置是
元素在元素周期表中的位置是___________ 。
②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:___________ 。
③结合流程及下表数据,“分离”时所需控制的最低温度应为___________  。
。
④已知 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:___________ 。
 )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。(1)
 元素在周期表中的分区是位于
元素在周期表中的分区是位于 原子中含有的未成对电子数是
原子中含有的未成对电子数是(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为
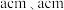 和
和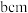 ,结构如下图所示。
,结构如下图所示。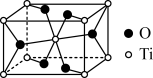
 位于距离最近的
位于距离最近的 构成的
构成的a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为
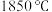 ,其晶体类型
,其晶体类型a.共价晶体 b.离子晶体 c.分子晶体
③若已知
 该氧化物晶体体积为
该氧化物晶体体积为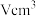 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为 。
。(3)以钓铁矿
 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下:
 元素在元素周期表中的位置是
元素在元素周期表中的位置是②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:
③结合流程及下表数据,“分离”时所需控制的最低温度应为
 。
。 |  |  | |
熔点/ | 1668 | 651 | 714 |
沸点/ | 3287 | 1107 | 1412 |
 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:
您最近半年使用:0次
名校
解题方法
4 . 已知五种前四周期的元素X、Y、Z、Q、T。其中,基态X原子的M层上有6种运动状态不同的电子;基态Y原子的简化电子排布式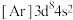 ,基态Z原子的L层的p能级有一个空轨道;基态Q原子的L层的p能级只有一对成对电子;基态T原子的M层上p轨道为半充满状态。根据题给信息,回答问题:
,基态Z原子的L层的p能级有一个空轨道;基态Q原子的L层的p能级只有一对成对电子;基态T原子的M层上p轨道为半充满状态。根据题给信息,回答问题:
(1)试推断这五种元素的符号:X:_____ ,Y:_____ ,Z:_____ ,Q:_____ ,T:_____ 。
(2)Y在元素周期表中的位置为_____________ 。
(3)基态Z原子的轨道表示式为_____________ 。
(4)对于T原子的p轨道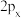 、
、 、
、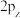 间的差异,下列说法错误的是
间的差异,下列说法错误的是____ (填字母)。
a.电子云形状相同 b.原子轨道的对称类型不同
c.电子的能量不同 d.电子云空间伸展方向不同
(5)Z元素的最高价氧化物对应水化物的电离方程式为______________ 。
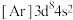 ,基态Z原子的L层的p能级有一个空轨道;基态Q原子的L层的p能级只有一对成对电子;基态T原子的M层上p轨道为半充满状态。根据题给信息,回答问题:
,基态Z原子的L层的p能级有一个空轨道;基态Q原子的L层的p能级只有一对成对电子;基态T原子的M层上p轨道为半充满状态。根据题给信息,回答问题:(1)试推断这五种元素的符号:X:
(2)Y在元素周期表中的位置为
(3)基态Z原子的轨道表示式为
(4)对于T原子的p轨道
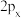 、
、 、
、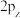 间的差异,下列说法错误的是
间的差异,下列说法错误的是a.电子云形状相同 b.原子轨道的对称类型不同
c.电子的能量不同 d.电子云空间伸展方向不同
(5)Z元素的最高价氧化物对应水化物的电离方程式为
您最近半年使用:0次
解题方法
5 . 下列化学用语正确的是
| A.水晶的分子式:SiO2 |
B.Cl-Cl的 键电子云图形: 键电子云图形: |
C.CO 的空间结构: 的空间结构: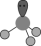 (正四面体形) (正四面体形) |
D.基态铜原子价电子的轨道表示式: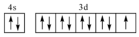 |
您最近半年使用:0次
名校
解题方法
6 . 下列表征说法正确的是
A. 的水解方程式为: 的水解方程式为: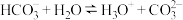 |
B.氯气的共价键电子云轮廓图: |
C.用电子式表示 的形成过程: 的形成过程: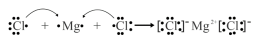 |
D. 的结构式: 的结构式: |
您最近半年使用:0次
名校
解题方法
7 . 运用物质结构与性质的相关知识,回答下列问题:
(1) 分子中,与
分子中,与 原子相连的
原子相连的 呈正电性
呈正电性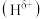 ,与
,与 原子相连的
原子相连的 呈负电性
呈负电性 电负性大小顺序是
电负性大小顺序是_______ 。基态 原子中能量最高的电子所在的原子轨道的电子云在空间上有
原子中能量最高的电子所在的原子轨道的电子云在空间上有_____ 个伸展方向,原子轨道呈______ 形。
(2)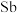 的价层电子排布式为
的价层电子排布式为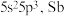 在周期表中的位置为
在周期表中的位置为________ ,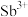 价电子轨道表示式为
价电子轨道表示式为________ 。
(3) 是离子晶体,其晶格能可通过Born-Haber循环计算得到。
是离子晶体,其晶格能可通过Born-Haber循环计算得到。
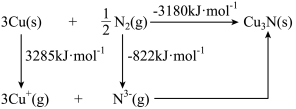
通过图中数据________ (填“能”或“不能”)计算出 原子的第一电离能,
原子的第一电离能, 的晶格能为
的晶格能为________  。
。
(4)GaAs的晶胞结构如图甲。将Mn掺杂到GaAs的晶体中得到稀磁性半导体材料(图乙)。
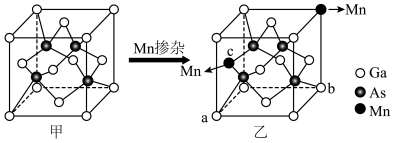
①GaAs晶胞中距离Ga原子最近As原子的个数为________ 。
②掺杂 之后,晶体中
之后,晶体中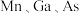 的原子个数比为
的原子个数比为________ (化为最简整数比)。
(1)
 分子中,与
分子中,与 原子相连的
原子相连的 呈正电性
呈正电性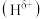 ,与
,与 原子相连的
原子相连的 呈负电性
呈负电性 电负性大小顺序是
电负性大小顺序是 原子中能量最高的电子所在的原子轨道的电子云在空间上有
原子中能量最高的电子所在的原子轨道的电子云在空间上有(2)
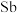 的价层电子排布式为
的价层电子排布式为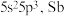 在周期表中的位置为
在周期表中的位置为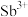 价电子轨道表示式为
价电子轨道表示式为(3)
 是离子晶体,其晶格能可通过Born-Haber循环计算得到。
是离子晶体,其晶格能可通过Born-Haber循环计算得到。
通过图中数据
 原子的第一电离能,
原子的第一电离能, 的晶格能为
的晶格能为 。
。(4)GaAs的晶胞结构如图甲。将Mn掺杂到GaAs的晶体中得到稀磁性半导体材料(图乙)。

①GaAs晶胞中距离Ga原子最近As原子的个数为
②掺杂
 之后,晶体中
之后,晶体中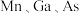 的原子个数比为
的原子个数比为
您最近半年使用:0次
8 . 绿矾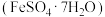 可作补血剂,其结构如图所示:
可作补血剂,其结构如图所示:
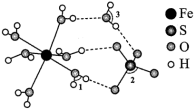
由成键一方单独提供孤电子对给予另外一方,这类“电子对给予—接受”化学键称为配位键。
(1)按照核外电子排布,可把元素周期表划分成五个区,铁元素位于元素周期表的_______ 区。
(2)基态S原子核外电子空间运动状态有___________ 种,电子占据最高能级的电子云轮廓图形状为___________ 。
(3) 中
中 由大到小的顺序是
由大到小的顺序是___________ 。
(4)二价铁易被氧化为三价铁,结合价层电子排布式解释原因:___________ 。
 可作补血剂,其结构如图所示:
可作补血剂,其结构如图所示:
由成键一方单独提供孤电子对给予另外一方,这类“电子对给予—接受”化学键称为配位键。
(1)按照核外电子排布,可把元素周期表划分成五个区,铁元素位于元素周期表的
(2)基态S原子核外电子空间运动状态有
(3)
 中
中 由大到小的顺序是
由大到小的顺序是(4)二价铁易被氧化为三价铁,结合价层电子排布式解释原因:
您最近半年使用:0次
解题方法
9 . 已知:NHCl2在水中产生几种化合物,其中一种物质M具有强氧化性且常用于自来水的消毒。下列有关说法错误的是
| A.基态N原子核外有3种不同能量的电子 |
| B.化合物M是次氯酸 |
| C.M分子的空间构型是直线形 |
| D.NHCl2分子中氮原子的杂化类型为sp3 |
您最近半年使用:0次
名校
解题方法
10 . 以下表示钠原子结构的化学用语中,对电子运动状态描述最详尽的是
A.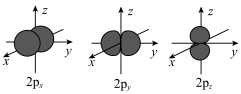 | B.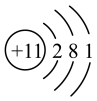 |
| C.Na· | D. |
您最近半年使用:0次



