1 . 在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起,据此,人们将元素周期表分为五个区,并以最后填入电子的轨道能级符号作为该区的符号,如图所示。
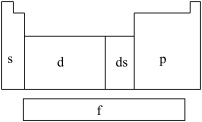
(1)在s区中,族序数最大、原子序数最小的元素原子的价电子的电子云形状为___________ 。
(2)在d区中,族序数最大、原子序数最小的元素,常见离子的电子排布式为___________ ,其中较稳定的是___________ 。
(3)在ds区中,族序数最大、原子序数最小的元素,原子的价电子排布式为___________ 。
(4)在p区中,第二周期ⅤA族元素原子的价电子排布图为___________ 。
(5)当今常用于核能开发的元素是铀和钚,它们在___________ 区中。

(1)在s区中,族序数最大、原子序数最小的元素原子的价电子的电子云形状为
(2)在d区中,族序数最大、原子序数最小的元素,常见离子的电子排布式为
(3)在ds区中,族序数最大、原子序数最小的元素,原子的价电子排布式为
(4)在p区中,第二周期ⅤA族元素原子的价电子排布图为
(5)当今常用于核能开发的元素是铀和钚,它们在
您最近半年使用:0次
2021-12-04更新
|
551次组卷
|
9卷引用:同步君 选修3 第一章 第二节 原子结构与元素周期表
(已下线)同步君 选修3 第一章 第二节 原子结构与元素周期表高中化学人教版 选修三 第1章 原子结构与性质 原子结构与元素周期表山东省济宁市实验中学2018-2019学年高二上学期第二次月考化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质(已下线)第30讲 原子结构与性质(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)1.2.1 原子结构与元素周期表(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)1.2.1 原子结构与元素周期表-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)专题2 原子结构与元素性质 第二单元 元素性质的递变规律 第1课时 原子核外电子排布的周期性2.2.1原子核外电子排布的周期性 课后
2 . 乙醇在醋酸菌作用下被空气氧化是制造醋酸的有效方法,然而这一传统过程远远不能满足工业的需求。目前工业上多采用甲醇和一氧化碳反应制备醋酸: CH3OH +CO→CH3COOH。第9族元素(Co, Rh,Ir)的一些配合物是上述反应良好的催化剂。以[Rh(CO)2I2]-为催化剂、以碘甲烷为助催化剂合成乙酸(Monsanto法)的示意图如下:
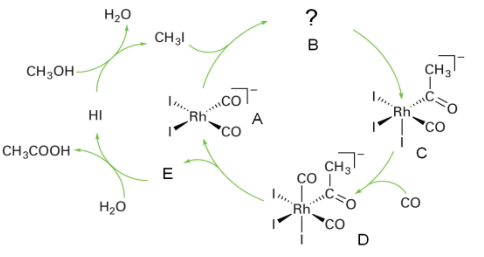
(1)在催化循环中,A和碘甲烷发生氧化加成反应,变为B。画出B及其几何异构体B1的结构示意图____ 。
(2)分别写出化合物A和D中铑的氧化态及其周围的电子数____ 。
(3)写出由E生成醋酸的反应式____ (E须用结构简式表示)。
(4)当将上述醋酸合成过程的催化剂改为[r(CO)2I2]-,被称作Cativa法。Cativa 法催化循环过程与Monsanto法类似,但中间体C和D (中心离子均为Ir)有差别,原因在于:由B (中心离子为Ir)变为C,发生的是CO取代I的反应:由C到D过程中则发生甲基迁移。画出C的面式结构示意图____ 。

(1)在催化循环中,A和碘甲烷发生氧化加成反应,变为B。画出B及其几何异构体B1的结构示意图
(2)分别写出化合物A和D中铑的氧化态及其周围的电子数
(3)写出由E生成醋酸的反应式
(4)当将上述醋酸合成过程的催化剂改为[r(CO)2I2]-,被称作Cativa法。Cativa 法催化循环过程与Monsanto法类似,但中间体C和D (中心离子均为Ir)有差别,原因在于:由B (中心离子为Ir)变为C,发生的是CO取代I的反应:由C到D过程中则发生甲基迁移。画出C的面式结构示意图
您最近半年使用:0次
3 . (1)玻尔原子结构模型成功地解释了___________ 的实验事实,电子所处的轨道的能量是___________ 的。最大不足之处是___________ 。
(2)p能级上有___________ 个原子轨道,在空间沿___________ 轴对称,记为___________ ,___________ ,___________ ,其能量关系为___________ 。
(2)p能级上有
您最近半年使用:0次
名校
解题方法
4 . 常温时,通过NaOH溶液或硫酸改变饱和氯水的pH,溶液中含氯微粒的物质的量分数与pH的关系如图所示。回答下列问题:
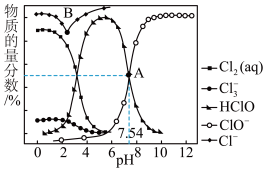
(1)Cl-的核外电子占有______ 个原子轨道, 中的化学键类型是
中的化学键类型是______ ,HClO的电子式是______ 。
(2)解释A点溶液pH=7.54的主要原因:______ 。
(3)结合图象,从平衡移动的角度解释B点向右Cl-物质的量分数增大的主要原因:
①______ ;
②______ 。
(4)估算图象中Cl-物质的量分数的上限______ 。

(1)Cl-的核外电子占有
 中的化学键类型是
中的化学键类型是(2)解释A点溶液pH=7.54的主要原因:
(3)结合图象,从平衡移动的角度解释B点向右Cl-物质的量分数增大的主要原因:
①
②
(4)估算图象中Cl-物质的量分数的上限
您最近半年使用:0次
2020高三·全国·专题练习
5 . (1)铁在元素周期表中的位置为_____ ,基态铁原子有个未成对电子_____ ,三价铁离子的电子排布式为_____ 。
(2)基态Si原子中,电子占据的最高能层符号_____ ,该能层具有的原子轨道数为_____ ;铝元素的原子核外共有_____ 种不同运动状态的电子、_____ 种不同能级的电子。
(3)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用_____ 形象化描述。在基态14C原子中,核外存在_____ 对自旋相反的电子。
(2)基态Si原子中,电子占据的最高能层符号
(3)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用
您最近半年使用:0次
6 . (1)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。基态Fe2+与Fe3+离子中未成对的电子数之比为______ 。
(2)钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,基态Ti原子的核外电子排布式为____________ 。
(3)以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵((NH4)3Fe(C6H5O7)2)。Fe基态核外电子排布式为___________ ;
(4)钙和铜合金可用作电解制钙的阴极电极材料,基态铜原子的价电子排布式为________ 。
(5)基态Sn原子价层电子的空间运动状态有___ 种,基态氧原子的价层电子排布式不能表示为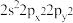 ,因为这违背了
,因为这违背了____ 原理(规则)。
(2)钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,基态Ti原子的核外电子排布式为
(3)以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵((NH4)3Fe(C6H5O7)2)。Fe基态核外电子排布式为
(4)钙和铜合金可用作电解制钙的阴极电极材料,基态铜原子的价电子排布式为
(5)基态Sn原子价层电子的空间运动状态有
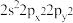 ,因为这违背了
,因为这违背了
您最近半年使用:0次
名校
解题方法
7 . 按照下列元素基态原子的电子排布特征判断元素,并回答问题。
A原子中只有一个能层且只含1个电子;B原子的2p轨道上得到2个电子后不能再容纳外来电子;C原子价电子排布式为nsn-1npn+1 ;D的一种核素的质量数为59,中子数为31。
(1)A的原子轨道形状为___________ 。
(2)画出B的原子结构示意图__________ 。
(3)C的基态原子核外电子空间运动状态有________ 种。
(4)D2+ 的核外电子排布式是____________ 。
A原子中只有一个能层且只含1个电子;B原子的2p轨道上得到2个电子后不能再容纳外来电子;C原子价电子排布式为nsn-1npn+1 ;D的一种核素的质量数为59,中子数为31。
(1)A的原子轨道形状为
(2)画出B的原子结构示意图
(3)C的基态原子核外电子空间运动状态有
(4)D2+ 的核外电子排布式是
您最近半年使用:0次
8 . 氮是生命物质的重要组成元素之一,含氮物质与人类的生活密切相关。氮原子最外层电子轨道表示式为:_____________ ;N4分子的空间结构如图: ,它是一种
,它是一种___________ 分子(填“极性”或“非极性”)。
 ,它是一种
,它是一种
您最近半年使用:0次
名校
9 . 铋(83Bi)为第V A族元素,常见化合价为+3和+5。化合物NaBiO3为黄色固体,常温下微溶于水,在空气中逐渐分解产生Bi2O3、NaOH等物质。
(1)铋元素最外层电子分布在_____ 种能级中,共有_____ 种运动状态。
(2)铋酸钠NaBiO3中属于短周期元素的离子半径大小关系为_________ 。
(3)元素Na、Bi、O的金属性依次减弱,非金属性依次增强,请列举判断依据:_______ 。
(4)铋酸钠NaBiO3在空气中分解所得到产物中,化学键类型是______ 。
A.金属键 B.离子键 C.极性键 D.非极性键
(5)将NaBiO3加入MnSO4和H2SO4的混合溶液里加热,发生如下反应:
[ ]NaBiO3+[ ]MnSO4+[ ]H2SO4→[ ]Na2SO4+[ ]Bi2(SO4)3+[ ]NaMnO4+[ ]H2O
①配平该化学方程式,将系数填写在对应位置上。
______ NaBiO3+______ MnSO4+______ H2SO4→______ Na2SO4+______ Bi2(SO4)3+______ NaMnO4+______ H2O
②若有2mol氧化剂在该反应中被还原,则生成的MnO 被还原为Mn2+时,能将
被还原为Mn2+时,能将____ mol HCl氧化成Cl2。
(6)写出NaBiO3固体溶于HCl时发生反应的离子方程式:_________ 。
(1)铋元素最外层电子分布在
(2)铋酸钠NaBiO3中属于短周期元素的离子半径大小关系为
(3)元素Na、Bi、O的金属性依次减弱,非金属性依次增强,请列举判断依据:
(4)铋酸钠NaBiO3在空气中分解所得到产物中,化学键类型是
A.金属键 B.离子键 C.极性键 D.非极性键
(5)将NaBiO3加入MnSO4和H2SO4的混合溶液里加热,发生如下反应:
[ ]NaBiO3+[ ]MnSO4+[ ]H2SO4→[ ]Na2SO4+[ ]Bi2(SO4)3+[ ]NaMnO4+[ ]H2O
①配平该化学方程式,将系数填写在对应位置上。
②若有2mol氧化剂在该反应中被还原,则生成的MnO
 被还原为Mn2+时,能将
被还原为Mn2+时,能将(6)写出NaBiO3固体溶于HCl时发生反应的离子方程式:
您最近半年使用:0次
解题方法
10 . 钾和碘的相关化合物在化工、医药、材料等领域有广泛的应用。回答下列问题:
(1)钾元素的焰色为紫色,该过程中其原子光谱属于______ 光谱(选填“吸收”或“发射”)。
(2)碘原子中,占据最高能级的电子的电子云轮廓图形状为______ 。
(3)请写出基态钾原子的核外电子排布式______ 。
(4)请比较KI与KCl晶体的熔点高低______ ,并说明理由:______ 。
(5)KIO3常用作食盐添加剂,其晶胞如图所示。

① 离子的立体构型为
离子的立体构型为______ 。
②已知KIO3晶胞的边长为apm,晶胞中K、I、O原子分别处于顶角、体心、面心位置。则每个K原子周围距离最短的O原子有______ 个。该晶胞的密度为______ g/cm3。
(1)钾元素的焰色为紫色,该过程中其原子光谱属于
(2)碘原子中,占据最高能级的电子的电子云轮廓图形状为
(3)请写出基态钾原子的核外电子排布式
(4)请比较KI与KCl晶体的熔点高低
(5)KIO3常用作食盐添加剂,其晶胞如图所示。

①
 离子的立体构型为
离子的立体构型为②已知KIO3晶胞的边长为apm,晶胞中K、I、O原子分别处于顶角、体心、面心位置。则每个K原子周围距离最短的O原子有
您最近半年使用:0次



