名校
解题方法
1 . 下列关于原子结构、原子轨道的说法正确的是
| A.N能层中有4s、4p、4d、4f四个能级,共16个轨道,可容纳32种运动状态的电子 |
| B.在K能层中,有自旋相反的两条轨道 |
| C.s电子绕核运动,其轨道为球面,而p电子在纺锤形曲面上运动 |
| D.电子云通常是用小黑点来表示电子的多少 |
您最近一年使用:0次
2020-10-29更新
|
910次组卷
|
8卷引用:四川省内江市第六中学2020-2021学年高二上学期第一次月考化学试题
四川省内江市第六中学2020-2021学年高二上学期第一次月考化学试题(已下线)第16单元 物质的结构与性质(选考)(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷(已下线)练习11 原子结构-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)(已下线)第1章 原子结构与元素性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版2019选择性必修2)河北省邯郸市大名县第一中学2021-2022学年高二上学期第二次月考化学试题(已下线)第1讲 原子结构 核外电子排布四川省泸州市叙永第一中学校2023-2024学年高二上学期1月期末化学试题吉林省通化市梅河口市第五中学2023-2024学年高二上学期第三次月考化学试题
2 . 按要求回答下列问题:
(1)某元素原子的价电子排布式为3d14s2,元素符号为________ ,最高正化合价为________ 。
(2)原子序数为26的元素的原子中有________ 个能级,________ 个未成对电子,________ 种运动状态不同的电子,位于________ 族________ 区,该原子的原子结构示意图为________ 。
(3)请写出有2个能层且p轨道中只有一对成对电子的基态原子的外围电子排布图为________ ,其能量最高的电子的电子云在空间有________ 个方向,原子轨道呈________ 形。
(4)请写出次外层电子数是最外层电子数 的元素的基态原子的电子排布式:
的元素的基态原子的电子排布式:____________ 。
(5)1~36号元素原子核外电子排布中未成对电子数最多的元素名称是________ 。
(1)某元素原子的价电子排布式为3d14s2,元素符号为
(2)原子序数为26的元素的原子中有
(3)请写出有2个能层且p轨道中只有一对成对电子的基态原子的外围电子排布图为
(4)请写出次外层电子数是最外层电子数
 的元素的基态原子的电子排布式:
的元素的基态原子的电子排布式:(5)1~36号元素原子核外电子排布中未成对电子数最多的元素名称是
您最近一年使用:0次
解题方法
3 . 以下能级符号正确的是( )
| A.6s | B.2d | C.3f | D.7f |
您最近一年使用:0次
名校
解题方法
4 . 1956年,美籍华人科学家吴健雄用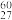 Co放射源进行实验验证了杨振宁和李政道的重要发现(此发现于1957年获得诺贝尔物理学奖)。
Co放射源进行实验验证了杨振宁和李政道的重要发现(此发现于1957年获得诺贝尔物理学奖)。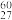 Co的衰变方程为:
Co的衰变方程为: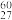 Co=
Co=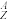 Ni+
Ni+ e-+
e-+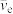 ,其中
,其中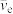 是反中微子,它的电荷数为0, 静止质量可认为是0。下列说法错误的是
是反中微子,它的电荷数为0, 静止质量可认为是0。下列说法错误的是
 Co放射源进行实验验证了杨振宁和李政道的重要发现(此发现于1957年获得诺贝尔物理学奖)。
Co放射源进行实验验证了杨振宁和李政道的重要发现(此发现于1957年获得诺贝尔物理学奖)。 Co的衰变方程为:
Co的衰变方程为: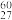 Co=
Co=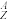 Ni+
Ni+ e-+
e-+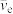 ,其中
,其中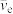 是反中微子,它的电荷数为0, 静止质量可认为是0。下列说法错误的是
是反中微子,它的电荷数为0, 静止质量可认为是0。下列说法错误的是| A.衰变产物Ni质量数是60 |
| B.Co与Ni同在元素周期表的d区 |
| C.Co与Ni基态原子核外电子占据的轨道数不同 |
| D.基态Ni原子的价电子排布为3d84s2 |
您最近一年使用:0次
2020-10-12更新
|
567次组卷
|
4卷引用:山东省潍坊市五县2021届高三10月联考化学试题
山东省潍坊市五县2021届高三10月联考化学试题(已下线)押新高考卷08题 物质结构与性质-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)江苏省昆山中学2022-2023学年高一下学期期中考试化学试题
解题方法
5 . 下列说法正确的是
| A.s轨道是绕核旋转的一个圆圈 |
| B.电子云图中黑点越密之处表示那里的电子越多 |
| C.主量子数为3时,有3s,3p,3d三个轨道 |
| D.电子在同一原子轨道上排布时应自旋相反,遵循的是泡利不相容原理 |
您最近一年使用:0次
解题方法
6 . 根据题给要求填空
(1)某元素的基态原子最外层电子排布式为3s23p2,它的次外层上电子云形状有________ 种,原子中所有电子占有________ 个轨道,核外共有________ 种运动状态不同的电子。
(2)E原子核外占有9个轨道,且具有1个未成对电子,E离子结构示意图是_______ 。
(3)F、G都是短周期元素,F2-与G3+的电子层结构相同,则G元素的原子序数是________ ,F2-的电子排布式是______ 。
(4)M能层上有________ 个能级,有________ 个轨道,作为内层最多可容纳________ 个电子,作为最外层时,最多可含有________ 个未成对电子。
(1)某元素的基态原子最外层电子排布式为3s23p2,它的次外层上电子云形状有
(2)E原子核外占有9个轨道,且具有1个未成对电子,E离子结构示意图是
(3)F、G都是短周期元素,F2-与G3+的电子层结构相同,则G元素的原子序数是
(4)M能层上有
您最近一年使用:0次
名校
解题方法
7 . 氮、磷、砷、铁等元素及其化合物在现代农业、科技、国防建设中有着许多独特的用途。
(1)基态砷原子中核外电子占据最高能层的符号为__ ,该能层的原子轨道数有__ 个。
(2)氮的一种氢化物N2H4是一种良好的火箭发射燃料,传统制备肼的方法是:NaClO+2NH3=N2H4+NaCl+H2O,又知肼的熔点、沸点分别为1.4℃、113.5℃,氨气的熔点、沸点分别为-77.7℃、-33.5℃。
①N2H4中氮原子的杂化轨道类型为__ 杂化,基态N原子电子占据最高能级的电子云轮廓图为___ 形。
②肼与氨气熔点、沸点差异最主要的原因是__ 。
(3)氨分子是一种常见配体,配离子[Co(NH3)6]3+中存在的化学键有__ (填序号)。
A.离子键 B.极性键 C.配位键 D.氢键
(1)基态砷原子中核外电子占据最高能层的符号为
(2)氮的一种氢化物N2H4是一种良好的火箭发射燃料,传统制备肼的方法是:NaClO+2NH3=N2H4+NaCl+H2O,又知肼的熔点、沸点分别为1.4℃、113.5℃,氨气的熔点、沸点分别为-77.7℃、-33.5℃。
①N2H4中氮原子的杂化轨道类型为
②肼与氨气熔点、沸点差异最主要的原因是
(3)氨分子是一种常见配体,配离子[Co(NH3)6]3+中存在的化学键有
A.离子键 B.极性键 C.配位键 D.氢键
您最近一年使用:0次
8 . 某元素基态原子4s轨道上有2个电子,则该基态原子价电子排布可能是( )
| A.4s | B. | C.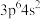 | D.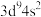 |
您最近一年使用:0次
解题方法
9 . 教材插图是对教材内容高度概括的体现,也是为说明、理解、深化文字内容服务的。请回答下列问题:
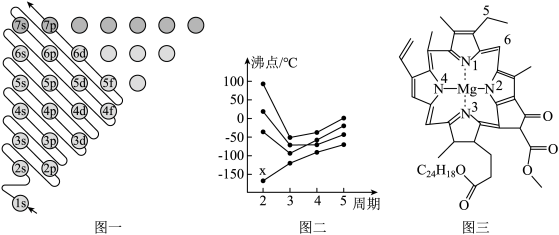
(1)图一为构造原理示意图,其含义是从H原子开始随着原子核电荷数递增,原子核每增加一个质子,核外便增加一个电子,电子大多按如图顺序填充。第四周期中,基态4s能级半充满的元素有___ 种,其中原子序数最大的基态原子的外围电子排布式为___ 。
(2)图二中,每条折线代表周期表中IVA-VIIA某一族元素简单氢化物的沸点变化,其他三条折线与x所在折线变化趋势不完全相同的原因为___ ;与x点对应的简单氢化物互为等电子体的离子为___ (写一种)。
(3)图三为卟啉配合物叶绿素的结构示意图,1号N原子和3号N原子与Mg2+形成的化学键类型为___ ;5号C原子和6号C原子的杂化方式分别为___ 、___ ;该分子中所含非金属元素的电负性由小到大的顺序为___ 。
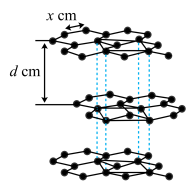
(4)从石墨晶体结构示意图中截取石墨的晶胞如图所示,设阿伏加 德罗常数为NA,已知sin60°= ),石墨晶体的密度为
),石墨晶体的密度为___ g·cm-3(列出计算式)。

(1)图一为构造原理示意图,其含义是从H原子开始随着原子核电荷数递增,原子核每增加一个质子,核外便增加一个电子,电子大多按如图顺序填充。第四周期中,基态4s能级半充满的元素有
(2)图二中,每条折线代表周期表中IVA-VIIA某一族元素简单氢化物的沸点变化,其他三条折线与x所在折线变化趋势不完全相同的原因为
(3)图三为卟啉配合物叶绿素的结构示意图,1号N原子和3号N原子与Mg2+形成的化学键类型为
(4)从石墨晶体结构示意图中截取石墨的晶胞如图所示,设阿伏加 德罗常数为NA,已知sin60°=
 ),石墨晶体的密度为
),石墨晶体的密度为
您最近一年使用:0次
解题方法
10 . 最外层电子排布式为3s23p3的原子,其核外电子占有的轨道数为( )
| A.4 | B.7 | C.8 | D.9 |
您最近一年使用:0次



