名校
解题方法
1 . 下列说法错误的是
A.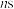 电子的能量不一定高于 电子的能量不一定高于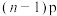 电子的能量 电子的能量 |
B. 的电子排布式为 的电子排布式为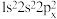 ,违背了洪特规则 ,违背了洪特规则 |
C.电子排布式 违背了能量最低原则 违背了能量最低原则 |
D.电子排布式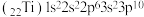 违背了泡利原理 违背了泡利原理 |
您最近一年使用:0次
2024-03-13更新
|
116次组卷
|
2卷引用:山东省青岛第五十八中学2023-2024学年高二上学期第二次月考化学试卷
2 . 下列各项叙述中,错误的是
| A.原子的量子力学模型是根据量子力学理论和原子光谱建构的原子模型 |
| B.单个电子的空间运动状态用原子轨道来描述 |
| C.基态原子中,内层各能级中电子的能量一定低于各外层能级的电子 |
| D.基态原子中处于同一原子轨道上的电子自旋运动状态一定不同 |
您最近一年使用:0次
名校
解题方法
3 . 5-氨基四唑硝酸盐受热迅速生成以 为主的环境友好型气体,并放出大量的热,是制造HTPB火箭推进剂的重要原料,结构简式如图,其中五元环为平面结构,下列说法正确的是
为主的环境友好型气体,并放出大量的热,是制造HTPB火箭推进剂的重要原料,结构简式如图,其中五元环为平面结构,下列说法正确的是

 为主的环境友好型气体,并放出大量的热,是制造HTPB火箭推进剂的重要原料,结构简式如图,其中五元环为平面结构,下列说法正确的是
为主的环境友好型气体,并放出大量的热,是制造HTPB火箭推进剂的重要原料,结构简式如图,其中五元环为平面结构,下列说法正确的是 
| A.基态N原子核外电子的运动状态有3种 |
| B.阴离子的空间构型为三角锥形 |
| C.该化合物中五元环上的5个原子的杂化方式都相同 |
D.该化合物因存在类似于苯分子的大 键,所以非常稳定 键,所以非常稳定 |
您最近一年使用:0次
2022-04-29更新
|
981次组卷
|
7卷引用:山东省济宁市2022届高三第二次模拟考试化学试题
名校
解题方法
4 . 下列说法正确的是
A.6C的电子排布式1s22s22p ,违反了泡利不相容原理 ,违反了泡利不相容原理 |
| B.价电子排布为5s25p1的元素位于第五周期第ⅠA族,是p区元素 |
| C.电子排布式(22Ti)1s22s22p63s23p10违反了洪特规则 |
| D.ns电子的能量一定高于(n-1)p电子的能量 |
您最近一年使用:0次
2021-09-26更新
|
1295次组卷
|
13卷引用:山东省青岛第十七中学2022-2023学年高二上学期期末考试化学试题
山东省青岛第十七中学2022-2023学年高二上学期期末考试化学试题四川省彭州市濛阳中学2019-2020学年高二下学期开学考试化学试题四川省内江市第六中学2020-2021学年高二上学期期中考试化学试题四川省达川第四中学2021-2022学年高二上学期第一次月考化学试题浙江省宁波市北仑中学2021-2022学年高二上学期期中考试化学(育英班)试题(已下线)第一章 原子结构与性质 章节过关检测-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)(已下线)1.1.2 构造原理与电子排布式-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)广东省深圳市盐田高级中学2021-2022学年高二下学期期中考试化学试题四川省南充市嘉陵第一中学2021-2022学年高二上学期第二次月考化学试题安徽省合肥市肥东县综合高中2021-2022学年高二下学期5月月考化学试题广东省湛江市第二中学2021-2022学年高二下学期第16周(6.4)周练化学试题辽宁省大连市第八中学2021-2022学年高二上学期12月月考化学试题四川省合江县马街中学校2023-2024学年高二上学期1月期末化学试题
5 . 已知下列电子排布图所表示的是元素的原子,其中能量处于最低状态的是
A.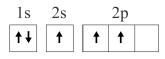 | B.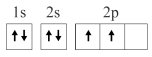 |
C.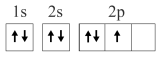 | D. |
您最近一年使用:0次
2021-05-28更新
|
1589次组卷
|
30卷引用:2016-2017学年山东省滨州市高二下学期第一次阶段性测试化学试卷
2016-2017学年山东省滨州市高二下学期第一次阶段性测试化学试卷(已下线)2014届四川省富顺一中高二上学期第一次月考化学试卷2015-2016学年湖北省黄冈市高二下期末化学试卷人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质2人教版2017-2018学年高二化学选修三同步训练:1.1 原子结构(第2课时)云南省双柏县第一中学2018-2019学年高二上学期期中考试化学试题广西宾阳县宾阳中学2018-2019学年高二5月月考化学试题云南省镇康县第一中学2019-2020学年高二12月月考化学试题云南省广南县第三中学校2019-2020学年高二上学期期末考试化学试题2020届高三化学二轮物质结构题型专攻—— 基态原子核外电子排布【选择基础专练】人教化学选修3第一章第一节课时3河南省林州市第一中学2019-2020学年高二4月月考(实验班)化学试题吉林省长春市第一中学2019-2020学年高二下学期阶段测试化学试题河南省洛阳市2019-2020学年高二下学期期末质量检测化学试题云南省玉溪市新平彝族傣自治县第一中学2020-2021学年高三上学期开学考试化学试题陕西省咸阳市实验中学2020-2021学年高二上学期第一次月考化学试题甘肃省静宁县第一中学2020-2021学年高二上学期期末考试化学(实验班)试题吉林省通化县综合高级中学2019-2020学年高二下学期期末考试化学试题河北省石家庄市第十五中学2020-2021学年高二第二学期4月月考化学试题(已下线)作业01 原子结构-2021年高二化学暑假作业(人教版2019)(已下线)1.1.3 电子云与原子轨道 泡利原理与洪特规则 能量最低原理-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)1.1 原子结构(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)第1.1.3讲 泡利原理、洪特规则、能量最低原理 -2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)河南省新乡市河南师范大学附属中学2021-2022学年高二下学期3月月考化学试题黑龙江省双鸭山市第一中学2021-2022学年高二下学期期中考试化学试题内蒙古通辽市开鲁县第一中学2021-2022学年高二下学期期中考试化学试题甘肃省高台县第一中学2021-2022学年高二下学期6月月考化学试题专题2 原子结构与元素性质 本专题复习提升四川省自贡市富顺县城关中学2021-2022学年高一下学期期中考试化学试题1.1.3 泡利原理、洪特规则、能量最低原理-随堂练习
解题方法
6 . (1)X射线衍射测定等发现,I3AsF6中存在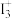 离子。
离子。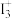 离子中心原子的杂化形式为
离子中心原子的杂化形式为_______ 。
(2)FeS2晶体的晶胞如图所示。晶胞边长为a nm晶胞中Fe2+位于S 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为_______ nm。

(3)在周期表中,与Li的化学性质最相似的邻族元素是_______ ,该元素基态原子核外M层电子的自旋状态_______ (填“相同”或“相反”)。
(4)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为_______ ,其中Fe的配位数为_______ 。
(5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
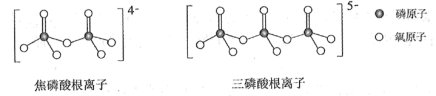
这类磷酸根离子的化学式可用通式表示为_______ (用n代表P原子数)。
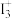 离子。
离子。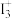 离子中心原子的杂化形式为
离子中心原子的杂化形式为(2)FeS2晶体的晶胞如图所示。晶胞边长为a nm晶胞中Fe2+位于S
 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为
(3)在周期表中,与Li的化学性质最相似的邻族元素是
(4)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为
(5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:

这类磷酸根离子的化学式可用通式表示为
您最近一年使用:0次
7 . 下列说法正确的是
| A.玻尔原子结构模型不但成功解释了氢原子光谱,而且还解释了其他原子光谱 |
B.基态氧原子轨道表示式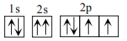 违背了泡利不相容原理 违背了泡利不相容原理 |
| C.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 |
| D.不同的能层所含的s能级的原子轨道数是不同的 |
您最近一年使用:0次
2021-02-07更新
|
367次组卷
|
4卷引用:山东省威海市2020-2021学年高二上学期期末考试化学试题
山东省威海市2020-2021学年高二上学期期末考试化学试题(已下线)专题一 原子结构-2020-2021学年高二《新题速递·化学》(人教版选修3)2月刊 (同步课堂必刷题)(已下线)专题一 原子结构-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修2)2月刊 (同步课堂必刷题)专题2 原子结构与元素性质 专题强化练1 核外电子排布的表示方法
名校
解题方法
8 . 下列关于能层与能级的说法中不正确的是
| A.原子核外电子的每一个能层最多可容纳的电子数为2n2 |
| B.任一能层的能级总是从s能级开始,而且能级数等于该能层序 数 |
| C.同是s能级,在不同的能层中所能容纳的最多电子数相同 |
| D.1个原子轨道里最多只能容纳2个电子,且自旋状态相同 |
您最近一年使用:0次
2020-11-14更新
|
431次组卷
|
6卷引用:山东师范大学附属中学2017-2018学年高二下学期期中考试(理)化学试题
山东师范大学附属中学2017-2018学年高二下学期期中考试(理)化学试题山东省师范大学附属中学2017-2018学年高二下学期第七次学分认定考试(期中)(理)化学试题天津市宝坻区宝坻九中2021届高三上学期第一次月考化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 第一节 原子结构(已下线)第一章 原子结构与性质【过关测试基础卷】-2020-2021学年高二化学单元复习测试(新教材人教版选择性必修2)(已下线)第01章 原子结构与元素性质(A卷基础强化篇)-2020-2021学年高二化学选择性必修2同步单元AB卷(新教材鲁科版)
9 . H、C、N、O、V(钒)五种元素形成的某分子结构如图所示,下列说法错误是
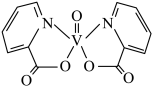

| A.N原子核外存在3种不同能量的电子 |
B.基态V原子的价电子轨道表示式为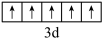 |
| C.基态O原子,电子占据的最高能级符号为2p |
| D.基态C、N两种原子中,核外存在相同对数自旋方向相反的电子 |
您最近一年使用:0次
2020-04-03更新
|
245次组卷
|
6卷引用:山东省威海市文登区2018-2019学年高二下学期期末考试化学试题
名校
解题方法
10 . 铜是人类最早使用的金属之一,其单质及化合物具有广泛的用途。
(1)基态铜原子核外有________ 对自旋相反的电子。
(2)青铜是铜与锡或铅等元素按一定比例熔铸而成的合金。第一电离能I1(Sn)____________ I1(Pb)(填“大于”或“小于”)。
(3)新制的Cu(OH)2能够溶解于浓氨水中,反应的离子方程式是____________________________________ ;
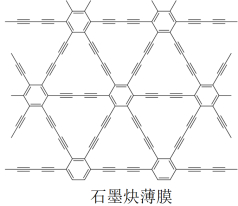
(4)利用铜片表面催化反应,我国研究人员用六炔基苯为原料,在世界上首次通过化学方法获得全碳材料—石墨炔薄膜(结构片段如图所示),开辟了人工化学合成碳同素异形体的先例。石墨炔中碳原子_________________________ 的杂化方式。
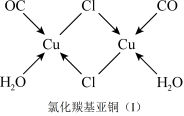
(5)CuCl的盐酸溶液能吸收CO形成氯化羰基亚铜(I),可用于定量测定气体混合物中CO的含量。氯化羰基亚铜(I)中含___________ σ键数目。
(6)Cu2O可用于半导体材料。
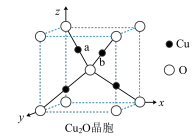
①Cu2O晶胞(如图所示)中,O原子的配位数为________________ ;a位置Cu+坐标为(0.25,0.25,0.75),则b位置Cu+坐标_______________________ 。
②Cu2S与Cu2O具有相似晶体结构,则两者的熔点是Cu2O比Cu2S的_________ (填“高”或“低”),请解释原因___________________ 。
(1)基态铜原子核外有
(2)青铜是铜与锡或铅等元素按一定比例熔铸而成的合金。第一电离能I1(Sn)
(3)新制的Cu(OH)2能够溶解于浓氨水中,反应的离子方程式是
(4)利用铜片表面催化反应,我国研究人员用六炔基苯为原料,在世界上首次通过化学方法获得全碳材料—石墨炔薄膜(结构片段如图所示),开辟了人工化学合成碳同素异形体的先例。石墨炔中碳原子



(5)CuCl的盐酸溶液能吸收CO形成氯化羰基亚铜(I),可用于定量测定气体混合物中CO的含量。氯化羰基亚铜(I)中含
(6)Cu2O可用于半导体材料。
①Cu2O晶胞(如图所示)中,O原子的配位数为
②Cu2S与Cu2O具有相似晶体结构,则两者的熔点是Cu2O比Cu2S的
您最近一年使用:0次
2020-04-02更新
|
308次组卷
|
3卷引用:山东省潍坊市2020届高三下学期第三次线上检测化学试题



