解题方法
1 . 铜基及硼系高温超导材料都具有良好的应用前景。回答下列问题:
(1)写出Cu原子价电子的轨道表达式:____________ 。BF3的立体构型是____________ 。
(2)NaBH4被认为是有机化学上的“万能还原剂”, NaBH4电子式为____________ ,其中三种元素的第一电离能由大到小的顺序是_________________ 。
(3)BH3·NH3是一种有效、安全的固体储氢材料,结构如右图所示。 B原子的轨道杂化类型是____________ 。该物质中含有配位键,其中提供空轨道接受孤对电子的是____________ 。该物质易溶于水,其原因是____________ 。
(4)硼与氦形成类似苯的化合物B3N3H6(硼氮苯),俗称无机苯。硼氮苯属于分子____________ (填“极性”或“非极性”),一个硼氮苯分子中有____________ 个σ键,形成π键的电子由____________ 提供。
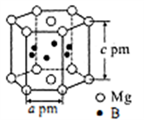
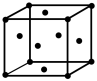
(5)硼与镁形成的高温超导材料晶体结构如图所示。该六方晶胞中镁原子与硼原子的数量比为____________ ,晶体密度d=____________ g·cm-3。
(1)写出Cu原子价电子的轨道表达式:
(2)NaBH4被认为是有机化学上的“万能还原剂”, NaBH4电子式为
(3)BH3·NH3是一种有效、安全的固体储氢材料,结构如右图所示。 B原子的轨道杂化类型是

(4)硼与氦形成类似苯的化合物B3N3H6(硼氮苯),俗称无机苯。硼氮苯属于分子
(5)硼与镁形成的高温超导材料晶体结构如图所示。该六方晶胞中镁原子与硼原子的数量比为
您最近一年使用:0次
名校
解题方法
2 . X、Y、Z、W、Q五种元素的原子序数依次增大且分别位于周期表的二、三、四周期,X和Y的原子序数相差1,基态Y原子中有3个未成对电子:基态Z2-与基态W+的电子层结构相同,W为前四周期电负性最小的元素;Q位于周期表的第12列。
请回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用___________ 形象化描述。
(2)基态X 原子的价层电子排布图为____________ 。基态W原子中有___________ 对自旋方向相反的电子。
(3)基态Y原子和基态Z原子的第一电离能:Y___________ (填“>”或“<")Z。
(4)Fe3+常用X、Y、Z、W组成的一种化合物检验。与该化合物中的阴离子互为等电子体的—种分子为__________ (填分子式)。
(5)Y的最高价含氧酸分子中,中心原子的杂化轨道类型为__________ ;其酸根离子的空间构型为______ 。
(6)相同压强下,Y的最简单氢化物的熔点低于W的氢化物的熔点,原因为_______________ 。
(7)Z与Q形成的一种晶体的晶胞如图所示,Z的配位数为_____________ 。若晶体密度为ρg·cm-1,阿伏伽德罗常数的值为NA,则晶胞参数为____________ nm(用含ρ、NA的代数式表示)。
请回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用
(2)基态X 原子的价层电子排布图为
(3)基态Y原子和基态Z原子的第一电离能:Y
(4)Fe3+常用X、Y、Z、W组成的一种化合物检验。与该化合物中的阴离子互为等电子体的—种分子为
(5)Y的最高价含氧酸分子中,中心原子的杂化轨道类型为
(6)相同压强下,Y的最简单氢化物的熔点低于W的氢化物的熔点,原因为
(7)Z与Q形成的一种晶体的晶胞如图所示,Z的配位数为

您最近一年使用:0次
2017-04-22更新
|
411次组卷
|
2卷引用:重庆市巴蜀中学2017届高三第二次诊断考试模拟理科综合化学试题
解题方法
3 . A、B、C、D、E是前四周期原子序数依次增大的五种元素。A、D同主族且能形成两种常见化合物DA2和DA3;基态C原子最外电子层上有1个未成对电子;基态B、E原子的最外层均只有2个电子,其余各电子层均全充满。回答下列问题:
(1)基态D原子价电子的轨道表达式为_________ ,元素铜与E的第二电离能分别为ICu=1985 kJ·mol-1,IE=1733 kJ·mol-1,ICu>IE的原因是_____________________ 。
(2)DA2分子的VSEPR模型是_________ 。写出一种与DA3互为等电子体的离子的化学式:_____ 。
(3)实验测得C与氯元素形成气态化合物的实际组成为C2Cl6,其中C原子的杂化方式为_____________ 。已知CCl3在加热时易升华,与过量的NaOH溶液反应可生成 Na[C(OH)4],CCl3固体属于______ 晶体(填晶体类型)
(4)试比较A、D简单氢化物的热稳定性,并说明理由:_________________ (用键参数解释)
(5)D与E所形成化合物晶体的晶胞如图所示:
①在该晶体中,D的配位数为_____________ 。
②原子坐标参数可表示晶胞内部各原子的相对位置。上图晶胞中,原子坐标参数a为(0,0,0);b为( ,0,
,0, );c 为(
);c 为( ,
, ,0)。则d 的坐标参数为
,0)。则d 的坐标参数为_________ 。
③已知该晶体的密度为ρ g·cm-3,设NA表示阿伏伽德罗常数的值,则晶胞中D离子与E离子之间的最近距离为__________ pm。
(1)基态D原子价电子的轨道表达式为
(2)DA2分子的VSEPR模型是
(3)实验测得C与氯元素形成气态化合物的实际组成为C2Cl6,其中C原子的杂化方式为
(4)试比较A、D简单氢化物的热稳定性,并说明理由:
(5)D与E所形成化合物晶体的晶胞如图所示:
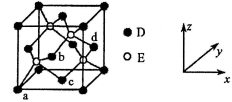
①在该晶体中,D的配位数为
②原子坐标参数可表示晶胞内部各原子的相对位置。上图晶胞中,原子坐标参数a为(0,0,0);b为(
 ,0,
,0, );c 为(
);c 为( ,
, ,0)。则d 的坐标参数为
,0)。则d 的坐标参数为③已知该晶体的密度为ρ g·cm-3,设NA表示阿伏伽德罗常数的值,则晶胞中D离子与E离子之间的最近距离为
您最近一年使用:0次
解题方法
4 . 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期且相邻的元素,B基态原子2p轨道中有三个自旋方向完全相同的电子;C基态原子核外电子占有9个轨道,且只有1个未成对电子;D、E、F是位于同一周期的金属元素, D、E基态原子的价电子层中未成对电子数分别为4、2,且原子序数相差2;F是ds区元素,F基态原子的价电子层中只有1个未成对电子。
回答下列问题:
(1)E元素在周期表中的位置是____________ ,E的价层电子排布图为________________ 。E单质能导电的原因是_______________ 。
(2)A、B、D三种元素形成配合物D3[D(AB)6]2,该配合物的中心离子是___ ,1 个AB-离子中含有_____ 个 π键。
(3)A元素最高价氧化物分子中A原子的杂化轨道类型是______ ,BC3分子的立体构型是_____________ 。
(4)新制的F(OH)2能够溶解于浓NaOH溶液中形成一种配离子,反应的离子方程式是__ 。
(5)E、F元素的第二电离能分别是:IE=1753kJ/mol、IF=1958kJ/mol, IF>IE的原因是___ 。
(6)C、F元素形成的一种化合物晶胞如下图,F位于面心和顶点,其晶胞参数为a pm。
①已知M点的坐标为 ,则N点的坐标为
,则N点的坐标为______ ,P点的坐标为_______ 。
若阿伏伽德罗常数用NA表示,则该晶体的密度是_____________ g/cm3(只要求列算式)。

回答下列问题:
(1)E元素在周期表中的位置是
(2)A、B、D三种元素形成配合物D3[D(AB)6]2,该配合物的中心离子是
(3)A元素最高价氧化物分子中A原子的杂化轨道类型是
(4)新制的F(OH)2能够溶解于浓NaOH溶液中形成一种配离子,反应的离子方程式是
(5)E、F元素的第二电离能分别是:IE=1753kJ/mol、IF=1958kJ/mol, IF>IE的原因是
(6)C、F元素形成的一种化合物晶胞如下图,F位于面心和顶点,其晶胞参数为a pm。
①已知M点的坐标为
 ,则N点的坐标为
,则N点的坐标为若阿伏伽德罗常数用NA表示,则该晶体的密度是

您最近一年使用:0次
解题方法
5 .
(1)G位于周期表的____ 区(填“s”、“ p”、“d ”或“ds”)。
(2)画出W基态原子的核外电子排布图_______ 。
(3)A2Y的VSEPR模型名称为______ 。
(4)已知为X2Y分子中Y原子只与一个X原子相连,请根据等电子原理.写出X2Y的电子式____ ,其中心原子的杂化轨道类型是______ ,1个X2Y分子中含的π键数为______ 。
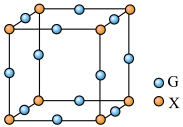
(5)X、G形成的某种化合物的晶胞结构如图所示,则其化学式为______ 。
(6)已知Z和M形成的化合物的晶体密度为pg·cm-3,阿伏加德罗常效为NA,该晶体中两个距离最近的Z离子中心间距离为______ cm。
| 元素 | 相关信息 |
| A | 原子核外电子总数与其周期数相同 |
| X | 其羞态原子的L层中有3个未成对电子 |
| Y | 荃态原子的2p轨道上有一个电子的自旋方向与2p轨道上其它电子的自旋方向相反 |
| Z | 原子核外p电子数比s电子数多l个 |
| W | 原子的第一至第四电离能(kJ·mol-1)分别是:I1=578,I2=1817,I3=2745,I4=11575 |
| M | 元素的主族数与周期数相差4 |
| G | 其基态原子最外层电子数为1,其余各电子层均充满电子 |
(1)G位于周期表的
(2)画出W基态原子的核外电子排布图
(3)A2Y的VSEPR模型名称为
(4)已知为X2Y分子中Y原子只与一个X原子相连,请根据等电子原理.写出X2Y的电子式

(5)X、G形成的某种化合物的晶胞结构如图所示,则其化学式为
(6)已知Z和M形成的化合物的晶体密度为pg·cm-3,阿伏加德罗常效为NA,该晶体中两个距离最近的Z离子中心间距离为
您最近一年使用:0次
解题方法
6 . (1)红细胞中血红素结构如图所示,回答下列问题:
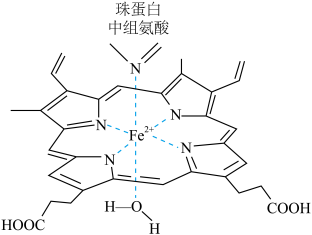
①Fe2+的轨道表示式[Ar]________ 。
②所含短周期元素电负性从大到小的顺序是___________ 。
③羧基中碳原子的杂化轨道方式是______________ 。
④在肺部,血红素中的Fe2+结合的水分子与氧分子交换,形成氧合血红蛋白,经动脉运送到组织释放出O2;然后血红素结合组织代谢所产生的CO2,经静脉送回肺中与水分子交换,最后将CO2排出体外,完成呼吸过程。血红素中Fe2+与CO2中____ 原子以____ 形式结合,这种结合是可逆的,比Fe2+与N的结合弱的原因是______________ 。
(2)磁性氧化铁Fe3O4含有Fe2+和Fe3+,其晶体属于立方晶系,氧原子呈面心立方密堆积,Fe3+和一半的Fe3+随机占据八面体空穴,电子可在Fe2+、Fe3+间迅速发生转移,另一半Fe3+作阳离占据四面体空穴。Fe3O4是一种盐,其真实结构可较好地表示为_________ [Fe2+和Fe3+分别用Fe(II)、Fe(III)表示];该晶体_____ 导电(填“能”、“不能”);该晶体的密度为5.18g·cm-3,其晶胞中最近的两个氧原子之间的核间距_________ cm(列出计算式,不必计算最终结果)。

①Fe2+的轨道表示式[Ar]
②所含短周期元素电负性从大到小的顺序是
③羧基中碳原子的杂化轨道方式是
④在肺部,血红素中的Fe2+结合的水分子与氧分子交换,形成氧合血红蛋白,经动脉运送到组织释放出O2;然后血红素结合组织代谢所产生的CO2,经静脉送回肺中与水分子交换,最后将CO2排出体外,完成呼吸过程。血红素中Fe2+与CO2中
(2)磁性氧化铁Fe3O4含有Fe2+和Fe3+,其晶体属于立方晶系,氧原子呈面心立方密堆积,Fe3+和一半的Fe3+随机占据八面体空穴,电子可在Fe2+、Fe3+间迅速发生转移,另一半Fe3+作阳离占据四面体空穴。Fe3O4是一种盐,其真实结构可较好地表示为
您最近一年使用:0次
解题方法
7 . 自然界中存在大量的金属元素和非金属元素,它们在工农业生产中有着广泛的应用。
(1)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,已知高温下Cu2O比CuO稳定。
①画出基态Cu原子的价电子轨道排布图_______ ;
②从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因_______ 。
(2)CuSO4溶液常用作农药、电镀液等,向CuSO4溶液中滴加足量浓氨水,直至产生的沉淀恰好溶解,再向其中加入适量乙醇,可析出深蓝色的Cu(NH3)4SO4·H2O晶体。
①Cu(NH3)4SO4·H2O晶体中存在的化学键有_______ (填字母序号)。
a.离子键 b.极性键 c.非极性键 d.配位键
② 的立体构型是
的立体构型是_______ ,其中S原子的杂化轨道类型是_______ 。
③已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______ 。
(3)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是_______ 。
(4)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac-代表CH3COO-),该反应是:
[Cu(NH3)2]Ac+CO+NH3 [Cu(NH3)3CO]Ac(醋酸羰基三氨合铜)(I) △H<0
[Cu(NH3)3CO]Ac(醋酸羰基三氨合铜)(I) △H<0
①C、N、O三种元素的第一电离能由小到大的顺序为_______ ;
②配合物[Cu(NH3)3CO]Ac中心原子的配位数为_______ 。
(5)铜的化合物种类很多,如图是氯化亚铜的晶胞结构,已知晶胞的棱长为a cm,则氯化亚铜密度的计算式为: =
=_______ g/cm3(用NA表示阿伏伽德罗常数)。

(1)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,已知高温下Cu2O比CuO稳定。
①画出基态Cu原子的价电子轨道排布图
②从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因
(2)CuSO4溶液常用作农药、电镀液等,向CuSO4溶液中滴加足量浓氨水,直至产生的沉淀恰好溶解,再向其中加入适量乙醇,可析出深蓝色的Cu(NH3)4SO4·H2O晶体。
①Cu(NH3)4SO4·H2O晶体中存在的化学键有
a.离子键 b.极性键 c.非极性键 d.配位键
②
 的立体构型是
的立体构型是③已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是
(3)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是
(4)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac-代表CH3COO-),该反应是:
[Cu(NH3)2]Ac+CO+NH3
 [Cu(NH3)3CO]Ac(醋酸羰基三氨合铜)(I) △H<0
[Cu(NH3)3CO]Ac(醋酸羰基三氨合铜)(I) △H<0①C、N、O三种元素的第一电离能由小到大的顺序为
②配合物[Cu(NH3)3CO]Ac中心原子的配位数为
(5)铜的化合物种类很多,如图是氯化亚铜的晶胞结构,已知晶胞的棱长为a cm,则氯化亚铜密度的计算式为:
 =
=
您最近一年使用:0次
名校
解题方法
8 . 铍及其化合物的应用正日益被重视。
(l)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的轨道表示式为__________ 。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有_____ (填标号)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)铍、铝晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点(155lK)比铝的熔点(930K)高,原因是______________ 。
(4)氯化铍在气态时存在BeC12分子(a)和二聚分子(BeCl2)2(b),固态时则具有如下图所示的链状结构(c)。
① a属于__________ (填“极性”或“非极性”)分子。
② b中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为____ (标出配位键)。
③ c中Be原子的杂化方式为__________ 。
④ 氯化铍晶体中存在的作用力有__________ (填标号)。
A.范德华力 B. σ键 C.极性键 D.非极性键 E.离子键
(5)BeO立方晶胞如下图所示。
① BeO晶体中,O2-的配位数为___________ 。
② 若BeO晶体的密度为dg/cm3,则晶胞参数a =______ nm (列出计算式即可)。
(l)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的轨道表示式为
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)铍、铝晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点(155lK)比铝的熔点(930K)高,原因是
(4)氯化铍在气态时存在BeC12分子(a)和二聚分子(BeCl2)2(b),固态时则具有如下图所示的链状结构(c)。
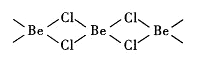
① a属于
② b中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为
③ c中Be原子的杂化方式为
④ 氯化铍晶体中存在的作用力有
A.范德华力 B. σ键 C.极性键 D.非极性键 E.离子键
(5)BeO立方晶胞如下图所示。

① BeO晶体中,O2-的配位数为
② 若BeO晶体的密度为dg/cm3,则晶胞参数a =
您最近一年使用:0次
2017-04-12更新
|
299次组卷
|
2卷引用:2017届福建省高三4月质量检查理综化学试卷
9 . 周期表前四周期元素R、X、Y、Z原子序效依次增大,RO2是红棕色气体:X位于元素周期表ⅣB族:同周期元素的基态原子中,Y的未成对电子最多;基态Z+最外层有18个电子。请回答下列问题:
(l)基态Y原子的价层电子轨道示意图为__________ 。
(2) RO3-的立体构型是______________ ,写出两个与RO3- 其有相同空间构型和键合形式的分子或离子____________ 。
(3) R及与R相邻的同周期元素中,第一电离能最大的是____ (填元素符号), 原因是_____ 。
(4)若过渡金属离子具有未成对d电子,容易吸收可见光而发生d-d跃迁,因而它们的水合离子常常具有颜色;若过渡金属离子无未成对d电子,则其水合离子是无色的。下列水合离子为无色的是_____
A. X2+ B.X4+ C. Y3+ D. Z2+
(5)右图是Z与金的一种合金晶体的立方晶胞:

① 该晶体中,Z与Au的原子个数比为_________ ;
② 原子坐标参数可表示晶胞内各原子的相对位置。图示晶胞中,原子坐标参数A为(0, 0,0 );
B为(0,1/2,1/2)则C原子(底心)的坐标参数为__________ 。
③ 已知该立方晶胞的密度为dg/cm3 ,NA为阿伏伽德罗常数的值,则晶胞参数(描述晶胞的大小和形状)a=_______ nm。(列出表达式即可)
(l)基态Y原子的价层电子轨道示意图为
(2) RO3-的立体构型是
(3) R及与R相邻的同周期元素中,第一电离能最大的是
(4)若过渡金属离子具有未成对d电子,容易吸收可见光而发生d-d跃迁,因而它们的水合离子常常具有颜色;若过渡金属离子无未成对d电子,则其水合离子是无色的。下列水合离子为无色的是
A. X2+ B.X4+ C. Y3+ D. Z2+
(5)右图是Z与金的一种合金晶体的立方晶胞:

① 该晶体中,Z与Au的原子个数比为
② 原子坐标参数可表示晶胞内各原子的相对位置。图示晶胞中,原子坐标参数A为(0, 0,0 );
B为(0,1/2,1/2)则C原子(底心)的坐标参数为
③ 已知该立方晶胞的密度为dg/cm3 ,NA为阿伏伽德罗常数的值,则晶胞参数(描述晶胞的大小和形状)a=
您最近一年使用:0次
解题方法
10 . 【化学—选修3:物质结构与性质】
铁、铝、铜都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
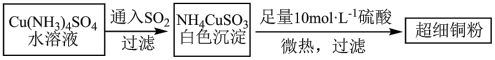
①铜元素位于周期表_________ 区;Cu+的基态价电子排布图_________ ;NH4CuSO3中N、S、O三种元素的第一电离能由大到小的顺序为_________ (元素符号表示)。
②SO42-中心原子的杂化方式为_________ ,SO32-的价层电子互斥模型为_________ 。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式_________ 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是_________ 。
a.因NH3和H2O都为极性分子,且它们还存在分子内氢键,所以氨气极易溶于水
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因_________ 。
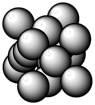
(4)下图所示为金属铜的一个晶胞,此晶胞立方体的边长为a pm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则晶胞中铜原子的配位数为_________ ,用含有a、ρ的代数式表示的阿伏伽德罗常数为:_________ mol-1。
铁、铝、铜都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
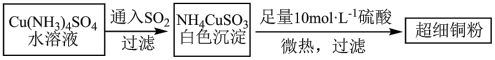
①铜元素位于周期表
②SO42-中心原子的杂化方式为
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是
a.因NH3和H2O都为极性分子,且它们还存在分子内氢键,所以氨气极易溶于水
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因
(4)下图所示为金属铜的一个晶胞,此晶胞立方体的边长为a pm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则晶胞中铜原子的配位数为
您最近一年使用:0次



