1 . 工业上,从铜镍矿(主要成分为铜氧化物、镍氧化物,含有 、
、 、
、 等杂质)中提取镍和铜的一种工艺流程如下:
等杂质)中提取镍和铜的一种工艺流程如下:
②当溶液中某离子浓度c≤10-5mol/L时,可认为该离子沉淀完全。
③
(1)基态 原子的价电子排布图为
原子的价电子排布图为___________ 。
(2)浸出过程中通入 的目的是
的目的是___________ 。
(3)萃取时发生反应: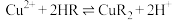 (HR、CuR2在有机层,
(HR、CuR2在有机层, 在水层)。
在水层)。___________ 。
(4)写出用惰性电极电解 溶液发生反应的化学方程式:
溶液发生反应的化学方程式:___________ 。
(5)黄钠铁矾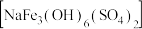 比
比 更易形成沉淀,则生成黄钠铁矾的离子方程式是
更易形成沉淀,则生成黄钠铁矾的离子方程式是___________ 。
(6)第二次使用 调节溶液
调节溶液 ,使
,使 沉淀完全,应将
沉淀完全,应将 调节至
调节至___________ (保留2位小数)。
 、
、 、
、 等杂质)中提取镍和铜的一种工艺流程如下:
等杂质)中提取镍和铜的一种工艺流程如下: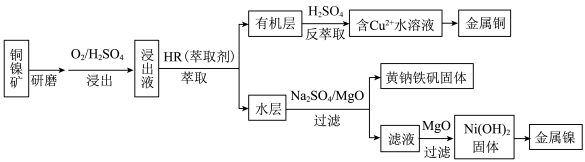
| 物质 |  |  |  |  |
 |  |  |  | 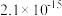 |
③

(1)基态
 原子的价电子排布图为
原子的价电子排布图为(2)浸出过程中通入
 的目的是
的目的是(3)萃取时发生反应:
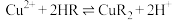 (HR、CuR2在有机层,
(HR、CuR2在有机层, 在水层)。
在水层)。①某种 的结构简式为
的结构简式为 ,该分子中可能与
,该分子中可能与 形成配位键的原子有
形成配位键的原子有
(4)写出用惰性电极电解
 溶液发生反应的化学方程式:
溶液发生反应的化学方程式:(5)黄钠铁矾
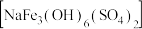 比
比 更易形成沉淀,则生成黄钠铁矾的离子方程式是
更易形成沉淀,则生成黄钠铁矾的离子方程式是(6)第二次使用
 调节溶液
调节溶液 ,使
,使 沉淀完全,应将
沉淀完全,应将 调节至
调节至
您最近一年使用:0次
2 . 镍、钴及其化合物在工业上有广泛的应用。以含镍废料(主要成分为NiO,含少量FeO、 、CoO、BaO和
、CoO、BaO和 )为原料制备
)为原料制备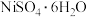 和
和 的工艺流程如下。
的工艺流程如下。
(1)基态Co原子的价层电子的轨道表示式为___________ 。
(2)“滤渣Ⅰ”主要成分是___________ (填化学式)。
(3)“调pH”过程中生成黄钠铁钒沉淀,该反应的离子方程式为___________ 。
(4)“萃取”时需充分振荡,目的是___________ 。“萃取”和“反萃取”可简单表示为: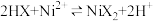 。在萃取过程中加入适量氨水,其作用是
。在萃取过程中加入适量氨水,其作用是___________ 。“反萃取”需要往有机层中加___________ (填试剂名称)。
(5)常温下,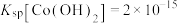 ,若起始时
,若起始时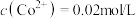 ,“沉钴”过程中应控制pH<
,“沉钴”过程中应控制pH<___________ 。
(6) 在空气中能受热分解,测得剩余固体的质量与起始
在空气中能受热分解,测得剩余固体的质量与起始 的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。
的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。 固体置于热解装置中,通入空气流,在
固体置于热解装置中,通入空气流,在___________ ℃(填范围)煅烧至恒重即可得到 。由
。由 制备
制备 总的反应方程式为
总的反应方程式为___________ 。
 、CoO、BaO和
、CoO、BaO和 )为原料制备
)为原料制备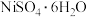 和
和 的工艺流程如下。
的工艺流程如下。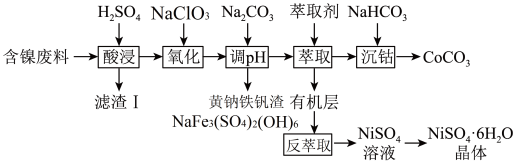
(1)基态Co原子的价层电子的轨道表示式为
(2)“滤渣Ⅰ”主要成分是
(3)“调pH”过程中生成黄钠铁钒沉淀,该反应的离子方程式为
(4)“萃取”时需充分振荡,目的是
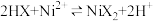 。在萃取过程中加入适量氨水,其作用是
。在萃取过程中加入适量氨水,其作用是(5)常温下,
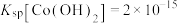 ,若起始时
,若起始时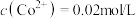 ,“沉钴”过程中应控制pH<
,“沉钴”过程中应控制pH<(6)
 在空气中能受热分解,测得剩余固体的质量与起始
在空气中能受热分解,测得剩余固体的质量与起始 的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。
的质量的比值(剩余固体的质量分数)随温度变化曲线如图所示。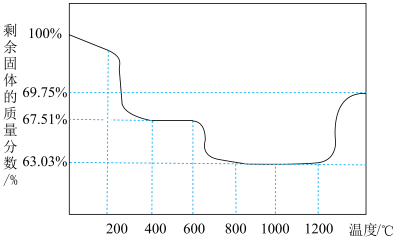
 固体置于热解装置中,通入空气流,在
固体置于热解装置中,通入空气流,在 。由
。由 制备
制备 总的反应方程式为
总的反应方程式为
您最近一年使用:0次
3 . 铁、钴、镍位于元素周期表中第四周期第Ⅷ族,它们的单质及其化合物在化工生产中用途广泛.回答下列问题:
(1)基态铁原子价电子排布图为________________ ;第四周期元素中基态原子未成对电子数与钴相同的还有________ (填元素符号);
(2)向含 的溶液中加入过量氨水,最终会得到黄色的
的溶液中加入过量氨水,最终会得到黄色的 ,在空气中易被氧化为橙黄色的
,在空气中易被氧化为橙黄色的 ;
;
①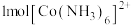 中含有
中含有 键的物质的量为
键的物质的量为________ ; 中存在
中存在________ (填选项字母);
A. 键 B.离子键 C.配位键 D.金属键
键 B.离子键 C.配位键 D.金属键
②与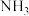 相比,
相比, 中的
中的
________ (填“较大”或“较小”),原因为________________ ;
③ 被氧化为
被氧化为 的离子方程式为
的离子方程式为________________ ;
(3)由钾、镍、氟三种元素组成的某晶体常应用于光化学领域,其四方晶胞结构及晶胞参数如图.该晶体中镍的配位数为________ ;设 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为________ 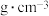 (列出计算式即可);
(列出计算式即可);
(1)基态铁原子价电子排布图为
(2)向含
 的溶液中加入过量氨水,最终会得到黄色的
的溶液中加入过量氨水,最终会得到黄色的 ,在空气中易被氧化为橙黄色的
,在空气中易被氧化为橙黄色的 ;
;①
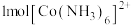 中含有
中含有 键的物质的量为
键的物质的量为 中存在
中存在A.
 键 B.离子键 C.配位键 D.金属键
键 B.离子键 C.配位键 D.金属键②与
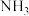 相比,
相比, 中的
中的
③
 被氧化为
被氧化为 的离子方程式为
的离子方程式为(3)由钾、镍、氟三种元素组成的某晶体常应用于光化学领域,其四方晶胞结构及晶胞参数如图.该晶体中镍的配位数为
 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为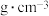 (列出计算式即可);
(列出计算式即可);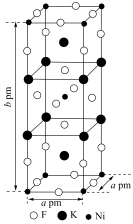
您最近一年使用:0次
4 . 刀片电池是比亚迪发布的新型电池产品,该电池采用磷酸铁锂技术,以硫铁矿烧渣(主要成分 、
、 、
、 、CaO、
、CaO、 )为原料制备
)为原料制备 的流程如下图所示:
的流程如下图所示: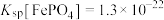 ,
,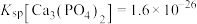 ;当溶液中离子浓度小于或等于
;当溶液中离子浓度小于或等于 时认为沉淀完全。
时认为沉淀完全。
请回答下列问题:
(1) 的价电子轨道表示式为
的价电子轨道表示式为______ ;磷酸根离子的空间构型为______ 。
(2)滤渣1的主要成分有______ (填化学式)。
(3)①“氧化”工序的目的是______ ;
②检验“氧化”工序是否完全的实验操作为______ ;
③“氧化”过程中主要发生的离子方程式为______ 。
(4)已知“氧化”后的溶液中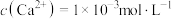 ,“沉铁”过程中,当
,“沉铁”过程中,当 恰好完全沉淀时,溶液中残留的
恰好完全沉淀时,溶液中残留的 是否会沉淀,写出计算过程
是否会沉淀,写出计算过程______ 。
(5)“煅烧还原”工序中发生反应的化学方程式为______ 。
 、
、 、
、 、CaO、
、CaO、 )为原料制备
)为原料制备 的流程如下图所示:
的流程如下图所示: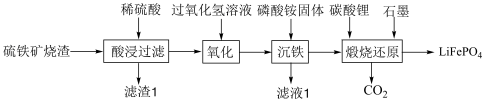
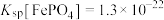 ,
,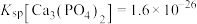 ;当溶液中离子浓度小于或等于
;当溶液中离子浓度小于或等于 时认为沉淀完全。
时认为沉淀完全。请回答下列问题:
(1)
 的价电子轨道表示式为
的价电子轨道表示式为(2)滤渣1的主要成分有
(3)①“氧化”工序的目的是
②检验“氧化”工序是否完全的实验操作为
③“氧化”过程中主要发生的离子方程式为
(4)已知“氧化”后的溶液中
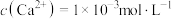 ,“沉铁”过程中,当
,“沉铁”过程中,当 恰好完全沉淀时,溶液中残留的
恰好完全沉淀时,溶液中残留的 是否会沉淀,写出计算过程
是否会沉淀,写出计算过程(5)“煅烧还原”工序中发生反应的化学方程式为
您最近一年使用:0次
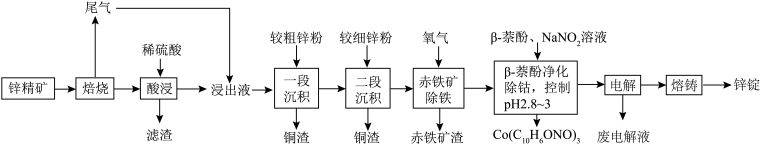
5 . 湿法炼锌具有能耗低,生成产品纯度高等特点,其主要原料为锌精矿(主要成分为硫化锌,还含有铁、钴、铜、镉、铅等元素的杂质),获得较纯锌锭的工艺流程如图:
(1)铜原子的价层电子排布图为_____ 。
(2)“酸浸”中滤渣主要成分为_____ 。
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:_____ 。
(4)“β—萘酚净化除钴”先是NaNO2把Co2+氧化成Co3+,并生成NO,Co3+与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出Co2+被氧化的离子方程式:_____ 。
(5)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。_____ (x和y用具体数字表示)。
②若Li2S的晶胞参数为ann,则EF间的距离为_____ nm。
(1)铜原子的价层电子排布图为
(2)“酸浸”中滤渣主要成分为
(3)“一段沉积”和“二段沉积”刚开始加入锌粉时,反应速率较小,然后反应速率显著增大,请解释产生此现象的原因:
(4)“β—萘酚净化除钴”先是NaNO2把Co2+氧化成Co3+,并生成NO,Co3+与有机物发生化学反应生成红褐色稳定鳌合物沉淀。写出Co2+被氧化的离子方程式:
(5)纯净的硫化锌是半导体锂离子电池负极材料。在充电过程中,发生合金化反应生成LiZn(合金相),同时负极材料晶胞的组成变化如图所示。
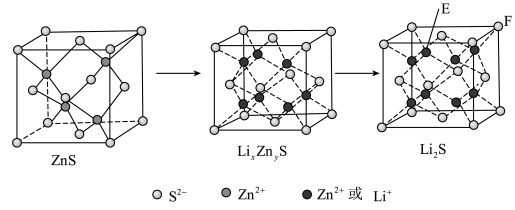
②若Li2S的晶胞参数为ann,则EF间的距离为
您最近一年使用:0次
7日内更新
|
52次组卷
|
2卷引用:黑龙江省大庆市实验中学实验二部2023-2024学年高三下学期得分训练化学试题(五)
6 . 过渡金属不但能够与非金属元素形成化合物,还能与其他金属元素形成金属互化物。回答下列问题:
(1)Mn在元素周期表中的位置___________ ,属于___________ 区的元素,基态锰原子的价电子轨道表示式为___________ 。
(2)二茂铁化学式为 ,由
,由 与两个
与两个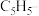 构成(如图),熔点为172℃。
构成(如图),熔点为172℃。___________ 。
②大 键通常用符号
键通常用符号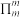 表示(m代表参与形大
表示(m代表参与形大 键的原子数,n代表大
键的原子数,n代表大 键的电子数),则
键的电子数),则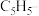 中的大
中的大 键表示为
键表示为___________ 。
③ 与两个
与两个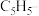 离子形成配位键后,使
离子形成配位键后,使 的3d、4s、4p能级中共具有18电子的稳定结构。则
的3d、4s、4p能级中共具有18电子的稳定结构。则 与两个
与两个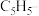 离子形成配位键的数目为
离子形成配位键的数目为___________ 。
(3)锰和镓形成的金属互化物立方晶胞如图所示。
___________ (填标号)。
A.面心 B.体心 C.顶点 D.棱心
②晶胞中,相邻Mn原子构成的正四面体空隙完全由镍原子填充,可用于制备碳基金属催化剂。1号Mn原子坐标参数为 ,则填充在1、2、3、4号Mn构成的四面体空隙中心的镍原子的坐标参数为
,则填充在1、2、3、4号Mn构成的四面体空隙中心的镍原子的坐标参数为___________ ;晶胞参数为a nm,则填充镍后的晶胞的密度
___________  (用含
(用含 、a的代数式表示)。
、a的代数式表示)。
(1)Mn在元素周期表中的位置
(2)二茂铁化学式为
 ,由
,由 与两个
与两个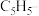 构成(如图),熔点为172℃。
构成(如图),熔点为172℃。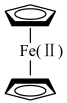
②大
 键通常用符号
键通常用符号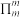 表示(m代表参与形大
表示(m代表参与形大 键的原子数,n代表大
键的原子数,n代表大 键的电子数),则
键的电子数),则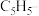 中的大
中的大 键表示为
键表示为③
 与两个
与两个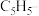 离子形成配位键后,使
离子形成配位键后,使 的3d、4s、4p能级中共具有18电子的稳定结构。则
的3d、4s、4p能级中共具有18电子的稳定结构。则 与两个
与两个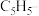 离子形成配位键的数目为
离子形成配位键的数目为(3)锰和镓形成的金属互化物立方晶胞如图所示。
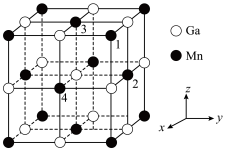
A.面心 B.体心 C.顶点 D.棱心
②晶胞中,相邻Mn原子构成的正四面体空隙完全由镍原子填充,可用于制备碳基金属催化剂。1号Mn原子坐标参数为
 ,则填充在1、2、3、4号Mn构成的四面体空隙中心的镍原子的坐标参数为
,则填充在1、2、3、4号Mn构成的四面体空隙中心的镍原子的坐标参数为
 (用含
(用含 、a的代数式表示)。
、a的代数式表示)。
您最近一年使用:0次
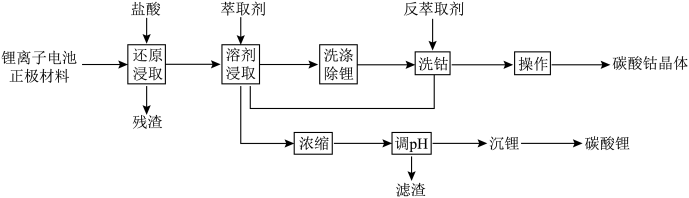
7 . 废旧锂离子电池的资源化利用是锂离子电池工业可持续发展的有效途径,一种废旧锂离子电池湿法回收钴和锂的工艺流程如图所示。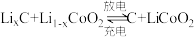 。
。
②25℃时,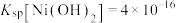 ;当溶液中离子浓度小于
;当溶液中离子浓度小于 时认为沉淀完全。
时认为沉淀完全。
③ 和
和 的溶解度如表所示。
的溶解度如表所示。
回答下列问题:
(1)基态Cu原子的价层电子排布图为___________ 。
(2)“还原浸取”时发生反应的化学方程式为___________ 。
(3)“溶剂浸取”的目的是将 、
、 与
与 、
、 分开(锂离子不与萃取剂作用),萃取原理为
分开(锂离子不与萃取剂作用),萃取原理为 ,参考下图判断应选择的萃取剂为
,参考下图判断应选择的萃取剂为___________ (填“P507”或“P204”),pH应控制在约___________ (“2~3”“4~5”或“6~7”)。___________ (填化学式);从溶液中获得硫酸钻晶体的操作为___________ 。
(5)25℃时,调
___________ 可以使 沉淀完全(已知:
沉淀完全(已知: )。
)。
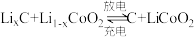 。
。②25℃时,
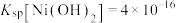 ;当溶液中离子浓度小于
;当溶液中离子浓度小于 时认为沉淀完全。
时认为沉淀完全。③
 和
和 的溶解度如表所示。
的溶解度如表所示。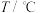 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
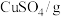 | 17.4 | 20.7 | 25.0 | 28.5 | 33.3 | 35.0 | 39.5 | 43.4 | 47.2 | 65.4 |
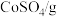 | 30.6 | 36.2 | 42.2 | 49.9 | 55.2 | 60.4 | 65.7 | 71.0 | 76.0 | 83.0 |
(1)基态Cu原子的价层电子排布图为
(2)“还原浸取”时发生反应的化学方程式为
(3)“溶剂浸取”的目的是将
 、
、 与
与 、
、 分开(锂离子不与萃取剂作用),萃取原理为
分开(锂离子不与萃取剂作用),萃取原理为 ,参考下图判断应选择的萃取剂为
,参考下图判断应选择的萃取剂为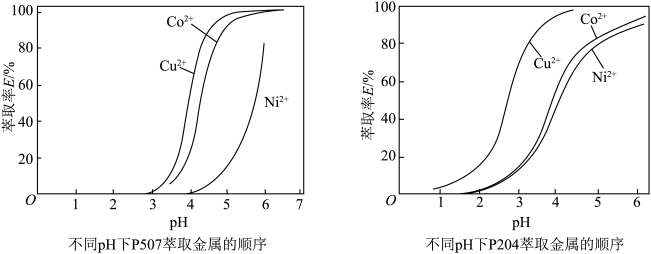
(5)25℃时,调

 沉淀完全(已知:
沉淀完全(已知: )。
)。
您最近一年使用:0次
8 . 硫元素化合物非常丰富,应用广泛。
请回答:
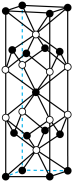
(1)由钾、镍、硫三种元素组成的某电极材料的晶胞如图,已知钾离子位于晶胞顶点及体心,其化学式是___________ ,与钾离子直接相邻的元素是___________ (填元素符号)。
(3)①硫酰卤( ):
):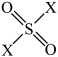 ,分子中S原子的杂化方式为:
,分子中S原子的杂化方式为:___________ ;比较键角
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
请回答:
(1)由钾、镍、硫三种元素组成的某电极材料的晶胞如图,已知钾离子位于晶胞顶点及体心,其化学式是
A.基态S原子的价层电子排布图: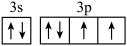 |
B.第一电离能: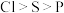 |
| C.K、Ni同为第四周期金属元素,都处于元素周期表d区 |
D.离子半径: |
(3)①硫酰卤(
 ):
): ,分子中S原子的杂化方式为:
,分子中S原子的杂化方式为:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②氟磺酸(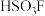 )属于超酸,可看作
)属于超酸,可看作 部分水解形成的产物。氟磺酸酸性比硫酸强。请从分子结构上说明氟磺酸酸性强的原因:
部分水解形成的产物。氟磺酸酸性比硫酸强。请从分子结构上说明氟磺酸酸性强的原因: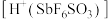 ,由
,由 (
(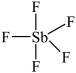 )与
)与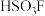 等物质的量化合生成。写出其中阴离子的结构式:
等物质的量化合生成。写出其中阴离子的结构式:
您最近一年使用:0次
9 . 金属钛(Ti)重量轻、强度高、抗腐蚀能力,在航空航天、医疗器械等工业领域有着重要用途。目前生产钛的方法之一是将金红石( )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。
(1)基态Ti原子的价电子轨道表示式:______ 。
(2) 转化为
转化为 有直接氯化法(Ⅰ)和碳氯化法(Ⅱ)。
有直接氯化法(Ⅰ)和碳氯化法(Ⅱ)。
Ⅰ.

Ⅱ.

已知: 的燃烧热为393.5
的燃烧热为393.5 ',
', 的燃烧热为283.0
的燃烧热为283.0
①
______ 。
②碳氯化反应过程中CO和 可以相互转化,如图1所示,下列关于碳氯化反应说法正确的是
可以相互转化,如图1所示,下列关于碳氯化反应说法正确的是______ 。 生成CO反应为放热反应
生成CO反应为放热反应
B.升高温度, 平衡转化率减小
平衡转化率减小
C.增大压强,碳氯化反应平衡向正反应方向移动
D.如图2所示 晶胞中
晶胞中 位于
位于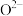 所构成的正八面体的体心,则
所构成的正八面体的体心,则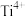 的配位数是6
的配位数是6
③碳氯化法中生成CO比生成 更有利于
更有利于 转化为
转化为 ,从熵变角度分析可能的原因是
,从熵变角度分析可能的原因是______ 。
(3)经光谱分析在碳氯化反应中有光气( )生成,后
)生成,后 继续反应,有理论认为机理如下:
继续反应,有理论认为机理如下: 含有
含有______ 个σ键,决速步骤的反应方程式为______ 。
(4)在 ,将
,将 、C、
、C、 以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。 的平衡常数
的平衡常数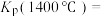
______ Pa。
②图中显示,在200℃平衡时 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于此温度,其原因是
,但实际生产中反应温度却远高于此温度,其原因是______ 。
 )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。(1)基态Ti原子的价电子轨道表示式:
(2)
 转化为
转化为 有直接氯化法(Ⅰ)和碳氯化法(Ⅱ)。
有直接氯化法(Ⅰ)和碳氯化法(Ⅱ)。Ⅰ.


Ⅱ.


已知:
 的燃烧热为393.5
的燃烧热为393.5 ',
', 的燃烧热为283.0
的燃烧热为283.0
①

②碳氯化反应过程中CO和
 可以相互转化,如图1所示,下列关于碳氯化反应说法正确的是
可以相互转化,如图1所示,下列关于碳氯化反应说法正确的是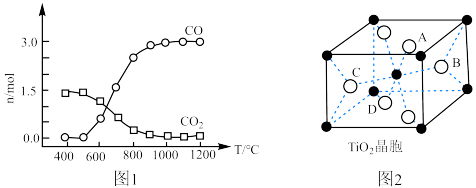
 生成CO反应为放热反应
生成CO反应为放热反应B.升高温度,
 平衡转化率减小
平衡转化率减小C.增大压强,碳氯化反应平衡向正反应方向移动
D.如图2所示
 晶胞中
晶胞中 位于
位于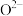 所构成的正八面体的体心,则
所构成的正八面体的体心,则 的配位数是6
的配位数是6③碳氯化法中生成CO比生成
 更有利于
更有利于 转化为
转化为 ,从熵变角度分析可能的原因是
,从熵变角度分析可能的原因是(3)经光谱分析在碳氯化反应中有光气(
 )生成,后
)生成,后 继续反应,有理论认为机理如下:
继续反应,有理论认为机理如下: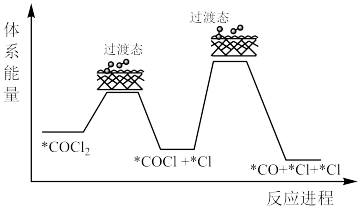
 含有
含有(4)在
 ,将
,将 、C、
、C、 以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
 的平衡常数
的平衡常数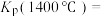
②图中显示,在200℃平衡时
 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于此温度,其原因是
,但实际生产中反应温度却远高于此温度,其原因是
您最近一年使用:0次
解题方法
10 . 闪锌矿的主要成分为ZnS,其中含有大量的铁元素以及少量的CuO等。湿法浸取闪锌矿制备 和
和 的工艺流程如下图所示。请回答以下问题。
的工艺流程如下图所示。请回答以下问题。 的价电子排布图为
的价电子排布图为________ 。同周期和基态Cu原子具有相同未成对电子数目的元素还有________ 种。
(2)酸浸时 的作用为
的作用为________ 。铜元素在滤渣中的存在形式为________ 。
(3)加入铁粉还原脱酸的优点是________ 。
(4)浓缩结晶时,溶液蒸发至________ 即停止加热。
(5)针铁矿法除铁是在常温下将 缓慢氧化,使铁元素以针铁矿形式形成沉淀而达到除铁的目的。针铁矿法除铁的离子方程式为
缓慢氧化,使铁元素以针铁矿形式形成沉淀而达到除铁的目的。针铁矿法除铁的离子方程式为________ 。
(6)把 放到密闭容器内,缓缓抽去其中的水气,
放到密闭容器内,缓缓抽去其中的水气, 分三次脱水。各步脱水过程为一系列动态平衡。剩余固体质量占原来总质量的百分比(η)与容器中水蒸气的压强变化关系如下图所示。
分三次脱水。各步脱水过程为一系列动态平衡。剩余固体质量占原来总质量的百分比(η)与容器中水蒸气的压强变化关系如下图所示。________ ;第三步反应的压强平衡常数为________ Pa;M点时所对应反应的转化率为________ 。
 和
和 的工艺流程如下图所示。请回答以下问题。
的工艺流程如下图所示。请回答以下问题。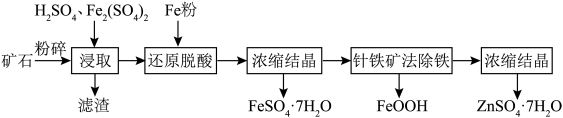
 的价电子排布图为
的价电子排布图为(2)酸浸时
 的作用为
的作用为(3)加入铁粉还原脱酸的优点是
(4)浓缩结晶时,溶液蒸发至
(5)针铁矿法除铁是在常温下将
 缓慢氧化,使铁元素以针铁矿形式形成沉淀而达到除铁的目的。针铁矿法除铁的离子方程式为
缓慢氧化,使铁元素以针铁矿形式形成沉淀而达到除铁的目的。针铁矿法除铁的离子方程式为(6)把
 放到密闭容器内,缓缓抽去其中的水气,
放到密闭容器内,缓缓抽去其中的水气, 分三次脱水。各步脱水过程为一系列动态平衡。剩余固体质量占原来总质量的百分比(η)与容器中水蒸气的压强变化关系如下图所示。
分三次脱水。各步脱水过程为一系列动态平衡。剩余固体质量占原来总质量的百分比(η)与容器中水蒸气的压强变化关系如下图所示。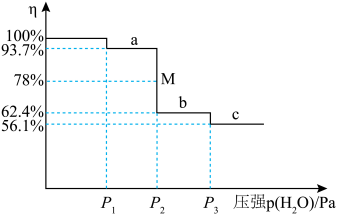
您最近一年使用:0次



