解题方法
1 . 近日,中国科学院深圳先进技术研究院某研究团队发现,二维铜铟磷硫(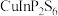 )能作纳米药物,用于未来安全有效的抗SARS-CoV-2治疗,以降低SARS-CoV-2的传染性。
)能作纳米药物,用于未来安全有效的抗SARS-CoV-2治疗,以降低SARS-CoV-2的传染性。
(1)已知铟( )与铝同主族,则基态In原子的价电子的轨道表示式为
)与铝同主族,则基态In原子的价电子的轨道表示式为___________ ;焰火中铜的焰色是绿色,该光谱属于___________ (填“发射”或“吸收”)光谱。
(2)第一电离能:P___________ S(填“>”或“<”,下同);键角:
___________  。
。
(3) 常作消毒剂,其合成途径之一为
常作消毒剂,其合成途径之一为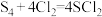 ,
,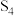 (
(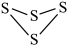 )中硫原子的杂化类型为
)中硫原子的杂化类型为___________ ; 分子的VSEPR模型是
分子的VSEPR模型是___________ 。
(4) 可用于制造火柴及火柴盒摩擦面,已知
可用于制造火柴及火柴盒摩擦面,已知 分子中各原子最外层均满足8电子结构,且该分子中只含有9个
分子中各原子最外层均满足8电子结构,且该分子中只含有9个 键,则
键,则 的结构式可能为
的结构式可能为___________ (写一种即可)。
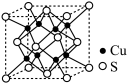
(5) 呈黑色或灰黑色,其晶胞结构如图所示,若晶胞的参数为
呈黑色或灰黑色,其晶胞结构如图所示,若晶胞的参数为 ,晶体的密度为
,晶体的密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为___________ (用含a和d的代数式表示)。
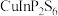 )能作纳米药物,用于未来安全有效的抗SARS-CoV-2治疗,以降低SARS-CoV-2的传染性。
)能作纳米药物,用于未来安全有效的抗SARS-CoV-2治疗,以降低SARS-CoV-2的传染性。(1)已知铟(
 )与铝同主族,则基态In原子的价电子的轨道表示式为
)与铝同主族,则基态In原子的价电子的轨道表示式为(2)第一电离能:P

 。
。(3)
 常作消毒剂,其合成途径之一为
常作消毒剂,其合成途径之一为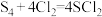 ,
,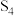 (
( )中硫原子的杂化类型为
)中硫原子的杂化类型为 分子的VSEPR模型是
分子的VSEPR模型是(4)
 可用于制造火柴及火柴盒摩擦面,已知
可用于制造火柴及火柴盒摩擦面,已知 分子中各原子最外层均满足8电子结构,且该分子中只含有9个
分子中各原子最外层均满足8电子结构,且该分子中只含有9个 键,则
键,则 的结构式可能为
的结构式可能为(5)
 呈黑色或灰黑色,其晶胞结构如图所示,若晶胞的参数为
呈黑色或灰黑色,其晶胞结构如图所示,若晶胞的参数为 ,晶体的密度为
,晶体的密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次
解题方法
2 . 复兴号高铁车体材质用到锰元素,锰及其化合物用途广泛。以菱锰矿(主要成分为MnCO3,还含有铁、镍、钴的碳酸盐以及SiO2杂质)为原料生产金属锰和高品位MnCO3的工艺流程如图:

(1)“溶浸”过程中,若其他条件不变,采取下列措施能提高浸出率的有________ (填序号)。
A.适当升高溶浸温度 B.适当加快搅拌速度 C.适当缩短溶浸时间
(2)锰的浸出率结果如图所示。由图可知,所采用的最佳实验条件为___________ 。

(3)残余在滤渣1中需要回收循环利用的MnO2,可加入葡萄糖和硫酸溶液处理,氧化产物为CO2.写出对应的离子方程式___________ 。
(4)“除杂”步骤所得滤渣2的主要成分除了CoS、NiS以外,还有___________ (填化学式)。
(5)写出“沉锰”的原理为___________ (用离子方程式表示);“沉锰”的关键操作是将反应终点pH控制在7附近,原因是___________ 。
(6)由锰、镍、镓制备的磁性形状记忆型合金中,基态Mn原子的价层电子排布图为___________ ,晶胞结构如图,立方晶胞的边长为 a nm,则该晶体的密度为___________ g•cm-3(NA表示阿伏加德罗常数)。


(1)“溶浸”过程中,若其他条件不变,采取下列措施能提高浸出率的有
A.适当升高溶浸温度 B.适当加快搅拌速度 C.适当缩短溶浸时间
(2)锰的浸出率结果如图所示。由图可知,所采用的最佳实验条件为

(3)残余在滤渣1中需要回收循环利用的MnO2,可加入葡萄糖和硫酸溶液处理,氧化产物为CO2.写出对应的离子方程式
(4)“除杂”步骤所得滤渣2的主要成分除了CoS、NiS以外,还有
(5)写出“沉锰”的原理为
(6)由锰、镍、镓制备的磁性形状记忆型合金中,基态Mn原子的价层电子排布图为

您最近一年使用:0次
解题方法
3 . 离子液体被认为是21世纪理想的绿色溶剂,是指室温或者接近室温时呈液态,而本身由阴、阳离子构成的化合物。氯代1-丁基-3-甲基咪唑离子液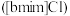 可以与
可以与 混合形成离子液体;
混合形成离子液体; 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是 与
与 离子交换反应合成离子液体
离子交换反应合成离子液体 的流程:
的流程:

(1)请画出基态Ga原子的价电子排布图_____ ;同周期元素中基态原子未成对电子数与硼(B)原子相同的有_____ (填元素符号)。
(2)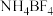 中N原子的杂化方式为
中N原子的杂化方式为_____ ,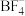 的空间构型为
的空间构型为_____ , 中几种元素电负性由大到小的顺序为
中几种元素电负性由大到小的顺序为_____ 。
(3)已知分子中的大 键可以用
键可以用 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则
键中的电子数,则 中大
中大 键可以表示为
键可以表示为_____ 。
(4) 熔点为
熔点为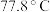 ,则
,则 的晶体类型为
的晶体类型为_____ , 和
和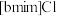 混合形成离子液体的过程中会存在以下转化:
混合形成离子液体的过程中会存在以下转化: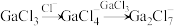 ,请画出
,请画出 的结构式
的结构式_____ 。
(5)某种 的晶胞结构如图所示,O2−以六方最密方式堆积,
的晶胞结构如图所示,O2−以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在1、2、3、4、5、6构成的八面体体心)。
在1、2、3、4、5、6构成的八面体体心)。
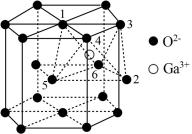
①该晶胞中O2−的配位数为_____ 。
②已知氧离子半径为acm,晶胞的高为bcm,NA代表阿伏加德罗常数的值,该晶体的密度为_____ g·cm−3(用含 和NA的代数式表示)。
和NA的代数式表示)。
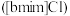 可以与
可以与 混合形成离子液体;
混合形成离子液体; 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是 与
与 离子交换反应合成离子液体
离子交换反应合成离子液体 的流程:
的流程:
(1)请画出基态Ga原子的价电子排布图
(2)
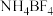 中N原子的杂化方式为
中N原子的杂化方式为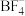 的空间构型为
的空间构型为 中几种元素电负性由大到小的顺序为
中几种元素电负性由大到小的顺序为(3)已知分子中的大
 键可以用
键可以用 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则
键中的电子数,则 中大
中大 键可以表示为
键可以表示为(4)
 熔点为
熔点为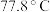 ,则
,则 的晶体类型为
的晶体类型为 和
和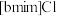 混合形成离子液体的过程中会存在以下转化:
混合形成离子液体的过程中会存在以下转化: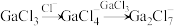 ,请画出
,请画出 的结构式
的结构式(5)某种
 的晶胞结构如图所示,O2−以六方最密方式堆积,
的晶胞结构如图所示,O2−以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在1、2、3、4、5、6构成的八面体体心)。
在1、2、3、4、5、6构成的八面体体心)。
①该晶胞中O2−的配位数为
②已知氧离子半径为acm,晶胞的高为bcm,NA代表阿伏加德罗常数的值,该晶体的密度为
 和NA的代数式表示)。
和NA的代数式表示)。
您最近一年使用:0次
名校
解题方法
4 . 氮化亚铜用于制备P型半导体,其可用 、
、 、2-吡咯甲醛作氮源制取。回答下列问题:
、2-吡咯甲醛作氮源制取。回答下列问题:
(1)基态N原子核外电子的电子排布图(轨道表示式)为___________ 。
(2)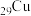 、
、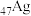 均位于第ⅠB族,基态Ag原子的价电子排布式为
均位于第ⅠB族,基态Ag原子的价电子排布式为___________ ;但铜的熔点和沸点均比银的高,这是由于___________ 。
(3) 的空间结构和
的空间结构和 相同,则
相同,则 的空间结构为
的空间结构为___________ , 的价电子数为
的价电子数为___________ 。
(4)2—吡咯甲醛作氮源制备氮化亚铜的反应过程如下:
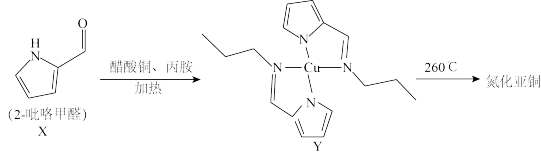
①配合物Y中,Cu的配位数为___________ 。
②基态 中未成对电子数为
中未成对电子数为___________ 。
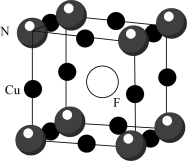
(5)氮化亚铜用氟掺杂可得到P型半导体,其晶胞结构如图所示,晶胞参数为 。则F原子与邻近的N原子间的距离为
。则F原子与邻近的N原子间的距离为___________ pm,设 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为___________  。
。
 、
、 、2-吡咯甲醛作氮源制取。回答下列问题:
、2-吡咯甲醛作氮源制取。回答下列问题:(1)基态N原子核外电子的电子排布图(轨道表示式)为
(2)
 、
、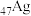 均位于第ⅠB族,基态Ag原子的价电子排布式为
均位于第ⅠB族,基态Ag原子的价电子排布式为(3)
 的空间结构和
的空间结构和 相同,则
相同,则 的空间结构为
的空间结构为 的价电子数为
的价电子数为(4)2—吡咯甲醛作氮源制备氮化亚铜的反应过程如下:

①配合物Y中,Cu的配位数为
②基态
 中未成对电子数为
中未成对电子数为(5)氮化亚铜用氟掺杂可得到P型半导体,其晶胞结构如图所示,晶胞参数为
 。则F原子与邻近的N原子间的距离为
。则F原子与邻近的N原子间的距离为 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 。
。
您最近一年使用:0次
名校
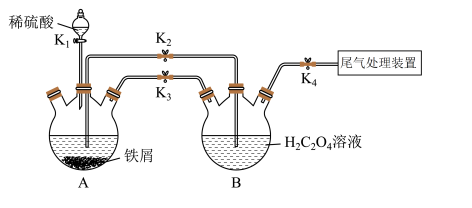
5 . K3[Fe(C2O4)3]·3H2O[三草酸合铁酸钾(M=491 g·mol-1)]易溶于水,难溶于乙醇,常用作有机反应的催化剂。某同学利用下图装置制备FeC2O4·2H2O,然后再制备三草酸合铁酸钾。
I.晶体的制备
(1)三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O,中心离子价层电子轨道表示式______________ 。
(2)打开K1、K3、K4,关闭K2,制备FeSO4。为使生成的FeSO4溶液与H2C2O4溶液接触,应进行的操作为__________________ 。
(3)向制得的FeC2O4(s)中加入过量K2C2O4溶液和H2C2O4溶液,水浴40℃下加热,缓慢滴加H2O2溶液,制得K3[Fe(C2O4)3],该反应的化学方程式为______________________ ;将上述混合物煮沸,加入饱和H2C2O4溶液,充分反应后冷却、结晶;结晶完全后减压抽滤、洗涤、干燥得到目标产物。
i.缓慢滴加H2O2溶液,水浴控温在40℃的原因是___________________ 。
ii.制备K3[Fe(C2O4)3]·3H2O时可能有红褐色沉淀生成,则H2C2O4的作用是_______________ 。
iii.为促进结晶,冷却后可加入_____________ (填试剂名称)。
II.阴离子电荷的测定
准确称取mg三草酸合铁酸钾加水溶解,控制流速,使其全部通过装有阴离子交换树脂(用R≡N+Cl-表示)的交换柱,发生阴离子(Xz-)交换:zR≡N+Cl-+ Xz- (R≡N+)zXz-+zCl-。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成250 mL溶液。取25.00mL该溶液,以K2CrO4溶液为指示剂,用c mol·L-1 AgNO3标准液滴定至终点,消耗标准液V mL。
(R≡N+)zXz-+zCl-。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成250 mL溶液。取25.00mL该溶液,以K2CrO4溶液为指示剂,用c mol·L-1 AgNO3标准液滴定至终点,消耗标准液V mL。
(4)阴离子电荷数为____________ (用含字母的代数式表示);若交换时样品液的流速过快,则会导致测定结果_____ (填“偏高“偏低”或“无影响”)。
I.晶体的制备
(1)三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O,中心离子价层电子轨道表示式
(2)打开K1、K3、K4,关闭K2,制备FeSO4。为使生成的FeSO4溶液与H2C2O4溶液接触,应进行的操作为
(3)向制得的FeC2O4(s)中加入过量K2C2O4溶液和H2C2O4溶液,水浴40℃下加热,缓慢滴加H2O2溶液,制得K3[Fe(C2O4)3],该反应的化学方程式为
i.缓慢滴加H2O2溶液,水浴控温在40℃的原因是
ii.制备K3[Fe(C2O4)3]·3H2O时可能有红褐色沉淀生成,则H2C2O4的作用是
iii.为促进结晶,冷却后可加入
II.阴离子电荷的测定
准确称取mg三草酸合铁酸钾加水溶解,控制流速,使其全部通过装有阴离子交换树脂(用R≡N+Cl-表示)的交换柱,发生阴离子(Xz-)交换:zR≡N+Cl-+ Xz-
 (R≡N+)zXz-+zCl-。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成250 mL溶液。取25.00mL该溶液,以K2CrO4溶液为指示剂,用c mol·L-1 AgNO3标准液滴定至终点,消耗标准液V mL。
(R≡N+)zXz-+zCl-。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成250 mL溶液。取25.00mL该溶液,以K2CrO4溶液为指示剂,用c mol·L-1 AgNO3标准液滴定至终点,消耗标准液V mL。(4)阴离子电荷数为
您最近一年使用:0次
解题方法
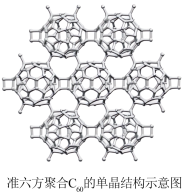
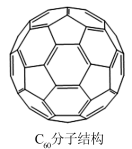
6 . 一种新型碳单晶一单层聚合C60。它是典型的半导体,预示其在光、电半导体器件中具有潜在应用。回答下列问题:
(1)基态碳原子的价电子轨道表示式为_______ 。
(2)下列有关单层聚合C60(准六方聚合C60的结构如图)的说法正确的是_______ (填字母)。
A.与金刚石、石墨烯互为同素异形体
B.与C60是同一种物质
C.所有的碳原子均为sp2杂化
D.它是一种共价化合物,不导电
E.它是由多个C60通过碳碳单键连接起来的
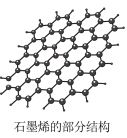
(3)石墨烯如图,分子中碳原子的杂化方式为_______ ,它具有很强的导电性,原因是_______ 。
(4)C60的结构如图所示,它能与氯气反应形成C60Cl10分子,1molC60Cl10分子中含有碳碳双键的数目为_______ 。
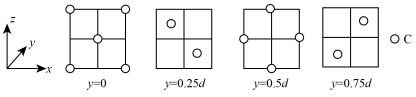
(5)金刚石晶胞的截面图如图所示(假设晶胞边长为dcm),原子1的分数坐标为_______ ,金刚石晶胞的密度为_______ (列出计算式,已知阿伏加德罗常数的值为NA)。
(1)基态碳原子的价电子轨道表示式为
(2)下列有关单层聚合C60(准六方聚合C60的结构如图)的说法正确的是

A.与金刚石、石墨烯互为同素异形体
B.与C60是同一种物质
C.所有的碳原子均为sp2杂化
D.它是一种共价化合物,不导电
E.它是由多个C60通过碳碳单键连接起来的
(3)石墨烯如图,分子中碳原子的杂化方式为

(4)C60的结构如图所示,它能与氯气反应形成C60Cl10分子,1molC60Cl10分子中含有碳碳双键的数目为

(5)金刚石晶胞的截面图如图所示(假设晶胞边长为dcm),原子1的分数坐标为

您最近一年使用:0次
7 . 填空
(1)基态 的轨道表示式为
的轨道表示式为___________ ,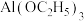 与
与 溶液反应的化学方程式为
溶液反应的化学方程式为___________ ,反应后的含铝微粒在溶液中形成___________ (填序号)。
A.离子键 B. 键 C.
键 C. 键 D.氢键
键 D.氢键
(2)键角比较:
___________  (填“
(填“ ”“
”“ ”或“
”或“ ”),原因是
”),原因是___________ 。
(3)下列关于结构和性质的比较正确的是___________。
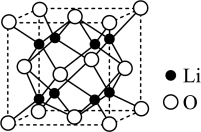
(4) 具有反萤石结构,晶胞如图所示。已知晶胞参数为
具有反萤石结构,晶胞如图所示。已知晶胞参数为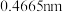 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 的密度为
的密度为___________  (列出计算式)。
(列出计算式)。
(1)基态
 的轨道表示式为
的轨道表示式为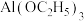 与
与 溶液反应的化学方程式为
溶液反应的化学方程式为A.离子键 B.
 键 C.
键 C. 键 D.氢键
键 D.氢键(2)键角比较:

 (填“
(填“ ”“
”“ ”或“
”或“ ”),原因是
”),原因是(3)下列关于结构和性质的比较正确的是___________。
| A.对羟基苯甲醛的沸点低于邻羟基苯甲醛 |
B. 和 和 的空间结构相同, 的空间结构相同, 和 和 的空间结构相同 的空间结构相同 |
C.分子间作用力: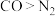 ,相同条件下在水中的溶解度 ,相同条件下在水中的溶解度 |
D. 与 与 可以生成 可以生成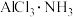 , , 可与 可与 反应生成 反应生成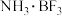 |
 具有反萤石结构,晶胞如图所示。已知晶胞参数为
具有反萤石结构,晶胞如图所示。已知晶胞参数为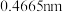 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 的密度为
的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
解题方法
8 . 化学物质在材料领域有着广泛用途:黄血盐 常用作颜料、染料,
常用作颜料、染料, 属于超导材料。
属于超导材料。
(1)上述涉及的元素中属于d区元素的有_______ 。电负性最大的元素的价层电子轨道表示式为_______ 。
(2)金属的熔点:K小于Fe,理由是_______ 。
(3)可溶性氰化物(如KCN)有剧毒,但黄血盐 的毒性极低,请从结构角度解释黄血盐毒性极低的原因是
的毒性极低,请从结构角度解释黄血盐毒性极低的原因是_______ 。
(4) 晶体的晶胞结构如图所示。与S原子距离最近且等距离的Ni原子数目为
晶体的晶胞结构如图所示。与S原子距离最近且等距离的Ni原子数目为_______ ,一个晶胞的质量为_______ g。

 常用作颜料、染料,
常用作颜料、染料, 属于超导材料。
属于超导材料。(1)上述涉及的元素中属于d区元素的有
(2)金属的熔点:K小于Fe,理由是
(3)可溶性氰化物(如KCN)有剧毒,但黄血盐
 的毒性极低,请从结构角度解释黄血盐毒性极低的原因是
的毒性极低,请从结构角度解释黄血盐毒性极低的原因是(4)
 晶体的晶胞结构如图所示。与S原子距离最近且等距离的Ni原子数目为
晶体的晶胞结构如图所示。与S原子距离最近且等距离的Ni原子数目为
您最近一年使用:0次
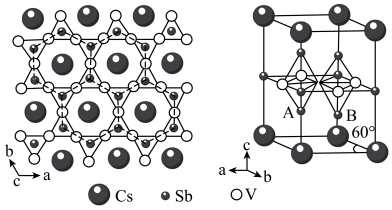
9 . 钒基笼目金属在超导电性方面有广阔的应用前最。某钒基笼目金属(M)的晶体结构如图所示。
(1)Sb在元素周期表中的位置是___________ 。
(2)基态V原子的价电子中,未成对电子数与成对电子数之比为___________ 。
(3)钒化合物在药物化学及催化化学等领域应用广泛。基态钒原子的价电子排布图为___________ ,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是_________ ,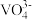 的空间结构为
的空间结构为________ 。
(4)SbH3的键角比NH3的键角小,原因是___________ 。
(5)该钒基笼目金属(M)的化学式为___________ ,与V原子距离最近且等距的V原子________ 个。
(6)已知,该晶胞中距离最近的两个V原子间的距离为2.75 Å,则晶胞体内A、B原子之间的距离为___________ Å ( ≈1.73, 保留两位小数)。
≈1.73, 保留两位小数)。

(1)Sb在元素周期表中的位置是
(2)基态V原子的价电子中,未成对电子数与成对电子数之比为
(3)钒化合物在药物化学及催化化学等领域应用广泛。基态钒原子的价电子排布图为
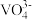 的空间结构为
的空间结构为(4)SbH3的键角比NH3的键角小,原因是
(5)该钒基笼目金属(M)的化学式为
(6)已知,该晶胞中距离最近的两个V原子间的距离为2.75 Å,则晶胞体内A、B原子之间的距离为
 ≈1.73, 保留两位小数)。
≈1.73, 保留两位小数)。
您最近一年使用:0次
名校
解题方法
10 . 残渣油中含有大量的有机物,还含有少量金属元素Mo、V、Ni、Fe的硫化物,其中Mo、V的含量最高,回收价值最大。但因油的粘度较大,增大了回收的难度,工业生产中从残渣油里回收V、Mo的工艺流程如图所示。
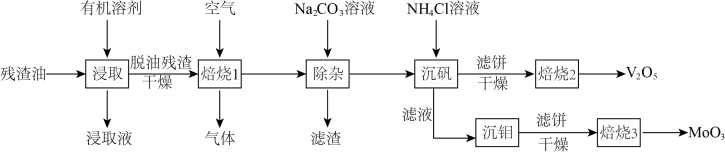
已知:① 微溶于冷水、乙醉、乙醚,能溶于热水:
微溶于冷水、乙醉、乙醚,能溶于热水:
②“除杂”步骤后的 、
、 以
以 利
利 离子的形式存在;
离子的形式存在;
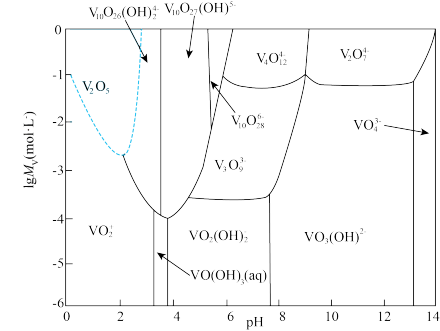
③钒在不同 、不同浓度下的存在形态如图,其中
、不同浓度下的存在形态如图,其中 可简写成
可简写成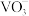 。
。
回答下列问题:
(1)已知 和
和 是同族相邻元素,写出Mo的外围电子轨道表示式
是同族相邻元素,写出Mo的外围电子轨道表示式___________ 。
(2)脱油残渣空气焙烧的目的是___________ 。
(3)“焙烧1”时生成的气体成分是___________ 。
(4)用碳酸钠溶液除杂,调节 值范围为
值范围为___________ 。
(5)“沉钒”时,发现随着温度升高,沉钒率反而下降,推测可能的原因是___________ 。
(6)在“焙烧2”制备 的操作中,若采取真空干燥焙烧,副产物经处理后可投入使用的流程步骤是
的操作中,若采取真空干燥焙烧,副产物经处理后可投入使用的流程步骤是___________ ;若在空气中焙烧,可生成一种无毒气体,该反应的化学方程式为___________ 。

已知:①
 微溶于冷水、乙醉、乙醚,能溶于热水:
微溶于冷水、乙醉、乙醚,能溶于热水:②“除杂”步骤后的
 、
、 以
以 利
利 离子的形式存在;
离子的形式存在;③钒在不同
 、不同浓度下的存在形态如图,其中
、不同浓度下的存在形态如图,其中 可简写成
可简写成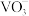 。
。
回答下列问题:
(1)已知
 和
和 是同族相邻元素,写出Mo的外围电子轨道表示式
是同族相邻元素,写出Mo的外围电子轨道表示式(2)脱油残渣空气焙烧的目的是
(3)“焙烧1”时生成的气体成分是
(4)用碳酸钠溶液除杂,调节
 值范围为
值范围为(5)“沉钒”时,发现随着温度升高,沉钒率反而下降,推测可能的原因是
(6)在“焙烧2”制备
 的操作中,若采取真空干燥焙烧,副产物经处理后可投入使用的流程步骤是
的操作中,若采取真空干燥焙烧,副产物经处理后可投入使用的流程步骤是
您最近一年使用:0次



