名校
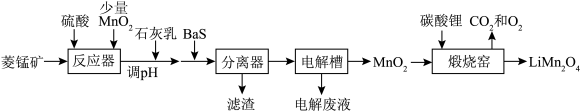
1 .  作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为
作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为 ,含有少量Fe、Ni、Al等元素)制备
,含有少量Fe、Ni、Al等元素)制备 的流程如图。
的流程如图。
已知常温下部分物质的 如表。
如表。
回答下列问题:
(1)基态Mn原子的价电子轨道表示式为______ 。
(2)常温下,若溶矿反应完成后,反应器中溶液pH=5,可沉淀完全的金属离子是______ ;若测得溶液中 浓度为0.1
浓度为0.1 ,
, 浓度为0.01
浓度为0.01 ,为防止
,为防止 、
、 发生沉淀,反应器中溶液用石灰乳调节的pH应小于
发生沉淀,反应器中溶液用石灰乳调节的pH应小于______ 。(已知:离子浓度小于等于
 ,即可认为该离子沉淀完全)
,即可认为该离子沉淀完全)
(3)加入少量BaS溶液除去 ,生成的沉淀有
,生成的沉淀有______ (填化学式)。
(4)具有强氧化性的过一硫酸( )可代替电解槽反应将
)可代替电解槽反应将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为______ (已知: 的电离第一步完全,第二步微弱)。
的电离第一步完全,第二步微弱)。
(5)煅烧窑中,生成 反应的化学方程式是
反应的化学方程式是______ 。
(6) 中锰元素的平均价态为+3.5。在不同温度下,合成的
中锰元素的平均价态为+3.5。在不同温度下,合成的 中
中 、
、 和
和 的含量与温度的关系见下表。
的含量与温度的关系见下表。
由此可以确定,在上述温度范围内,锰元素的平均价态的变化情况是______ 。
 作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为
作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为 ,含有少量Fe、Ni、Al等元素)制备
,含有少量Fe、Ni、Al等元素)制备 的流程如图。
的流程如图。
已知常温下部分物质的
 如表。
如表。物质 |
|
|
|
|
|
|
|
|
|
|
|
(1)基态Mn原子的价电子轨道表示式为
(2)常温下,若溶矿反应完成后,反应器中溶液pH=5,可沉淀完全的金属离子是
 浓度为0.1
浓度为0.1 ,
, 浓度为0.01
浓度为0.01 ,为防止
,为防止 、
、 发生沉淀,反应器中溶液用石灰乳调节的pH应小于
发生沉淀,反应器中溶液用石灰乳调节的pH应小于
 ,即可认为该离子沉淀完全)
,即可认为该离子沉淀完全)(3)加入少量BaS溶液除去
 ,生成的沉淀有
,生成的沉淀有(4)具有强氧化性的过一硫酸(
 )可代替电解槽反应将
)可代替电解槽反应将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 的电离第一步完全,第二步微弱)。
的电离第一步完全,第二步微弱)。(5)煅烧窑中,生成
 反应的化学方程式是
反应的化学方程式是(6)
 中锰元素的平均价态为+3.5。在不同温度下,合成的
中锰元素的平均价态为+3.5。在不同温度下,合成的 中
中 、
、 和
和 的含量与温度的关系见下表。
的含量与温度的关系见下表。T/℃ |
|
|
|
700 | 5.56 | 44.58 | 49.86 |
750 | 2.56 | 44.87 | 52.57 |
800 | 5.50 | 44.17 | 50.33 |
850 | 6.22 | 44.40 | 49.38 |
您最近一年使用:0次
2024-02-25更新
|
842次组卷
|
3卷引用:湖南省长沙市长郡中学2023-2024学年高三模拟考试(一)化学试题
湖南省长沙市长郡中学2023-2024学年高三模拟考试(一)化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)2024届吉林省通化市梅河口市第五中学高三下学期一模化学试题
名校
2 . 钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗等领域。
(1)基态Ti原子的价电子轨道表示式是______ 。
(2) 与
与 互为等电子体,
互为等电子体, 与
与 甲基咪唑
甲基咪唑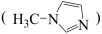 反应可以得到
反应可以得到
 其结构如下图所示。
其结构如下图所示。
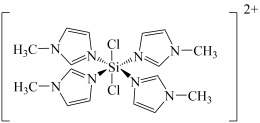
① 分子的空间构型为
分子的空间构型为______ 。
② 甲基咪唑分子中碳原子的杂化轨道类型为
甲基咪唑分子中碳原子的杂化轨道类型为______ ,C、N、Si的电负性由大到小的顺序为______ ,1个 中含有
中含有______ 个σ键。
③ 稳定性比
稳定性比 差,试从化学键角度分析原因:
差,试从化学键角度分析原因:______ 。
(3) 属于四方晶系,晶胞棱边夹角均为90°。研究表明,
属于四方晶系,晶胞棱边夹角均为90°。研究表明, 通过氮掺杂反应可生成
通过氮掺杂反应可生成 ,能使
,能使 对可见光具有活性,反应如图所示。
对可见光具有活性,反应如图所示。
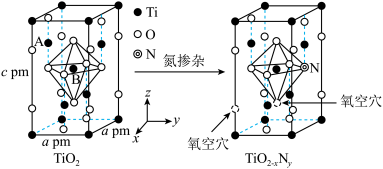
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。已知上述晶胞中所有 键键长为rpm,B点钛原子分数坐标为
键键长为rpm,B点钛原子分数坐标为 ,占据氧原子围成的八面体空隙,则A点钛原子的分数坐标为(
,占据氧原子围成的八面体空隙,则A点钛原子的分数坐标为( ,0,
,0,______ )。若 晶体密度为
晶体密度为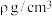 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
______ 。
② 晶体中
晶体中
______ 。
(1)基态Ti原子的价电子轨道表示式是
(2)
 与
与 互为等电子体,
互为等电子体, 与
与 甲基咪唑
甲基咪唑 反应可以得到
反应可以得到
 其结构如下图所示。
其结构如下图所示。
①
 分子的空间构型为
分子的空间构型为②
 甲基咪唑分子中碳原子的杂化轨道类型为
甲基咪唑分子中碳原子的杂化轨道类型为 中含有
中含有③
 稳定性比
稳定性比 差,试从化学键角度分析原因:
差,试从化学键角度分析原因:(3)
 属于四方晶系,晶胞棱边夹角均为90°。研究表明,
属于四方晶系,晶胞棱边夹角均为90°。研究表明, 通过氮掺杂反应可生成
通过氮掺杂反应可生成 ,能使
,能使 对可见光具有活性,反应如图所示。
对可见光具有活性,反应如图所示。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。已知上述晶胞中所有
 键键长为rpm,B点钛原子分数坐标为
键键长为rpm,B点钛原子分数坐标为 ,占据氧原子围成的八面体空隙,则A点钛原子的分数坐标为(
,占据氧原子围成的八面体空隙,则A点钛原子的分数坐标为( ,0,
,0, 晶体密度为
晶体密度为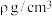 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
②
 晶体中
晶体中
您最近一年使用:0次
名校
解题方法
3 . 阿尔维德卡尔森因发现多巴胺获得了2000年诺贝尔生理学或医学奖,多巴胺是一种神经传导物质,用来帮助细胞传送脉冲的化学物质。这种脑内分泌物也能传递兴奋及开心的信息。其结构式如下图a所示,化学式为C8H11NO2。回答下列问题:
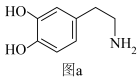
(1)基态氧原子最高能级上有_______ 种运动状态不同的电子,基态碳原子的一个2s电子跃迁到2p轨道形成激发态原子的价电子排布图为_______ 。
(2)多巴胺分子中碳原子的杂化方式有_______ ,C、N、O的第一电离能由大到小的顺序为_______ 。
(3)1 mol多巴胺中含有 键的数目为
键的数目为_______ 。多巴胺易溶于水,理由是_______ 。
(4)多巴胺与盐酸作用能形成盐酸多巴胺,结构如上图b所示,多巴胺和盐酸多巴胺中H—N—H键的键角,前者_______ (填“大于”“等于”或“小于”)后者,理由是_______ 。
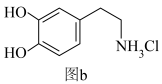
(5)盐酸多巴胺形成的晶体的晶胞结构如图所示,其晶胞中阳离子为面心立方最密堆积,阳离子半径为R pm,则晶胞氯离子的配位数是_______ ,晶胞的密度是_______ 。


(1)基态氧原子最高能级上有
(2)多巴胺分子中碳原子的杂化方式有
(3)1 mol多巴胺中含有
 键的数目为
键的数目为(4)多巴胺与盐酸作用能形成盐酸多巴胺,结构如上图b所示,多巴胺和盐酸多巴胺中H—N—H键的键角,前者

(5)盐酸多巴胺形成的晶体的晶胞结构如图所示,其晶胞中阳离子为面心立方最密堆积,阳离子半径为R pm,则晶胞氯离子的配位数是

您最近一年使用:0次
2023-12-31更新
|
332次组卷
|
3卷引用:2024届四川省双流棠湖中学高三上学期第一次联考理科综合能力测试试题
解题方法
4 . 电镀厂阳极产生的电镀污泥中含有大量的重金属物质[主要含有Cr2O3、Cu2Te及少量单质金(Au)],为了消除有害电镀污泥对环境的污染,某科研团队设计了新工艺,该工艺实现了Cr—Au—Cu—Te的深度利用,工艺流程如图:
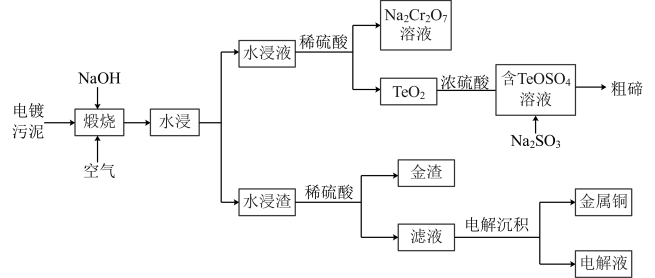
已知:①煅烧过程中Cu2Te发生的反应为 ;
;
②TeO2是两性氧化物,微溶于水,NaTeO3溶液为无色溶液。
(1)煅烧过程中的主要反应为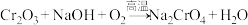 ,该反应中还原剂与氧化剂的物质的量之比为
,该反应中还原剂与氧化剂的物质的量之比为___________ ,该步骤不能使用陶瓷坩埚的原因是___________ 。
(2)水浸渣的成分为___________ ,基态Cr原子的价层电子轨道表示式为___________ 。
(3)图中生成Na2Cr2O7溶液时的离子方程式为_____________________ ,溶液的颜色由_______ 色变为_______ 色。
(4)电解沉积除铜时,阳极电极反应式为___________ ,流程中可以循环利用的物质是________ 。
(5)写出向“含TeOSO4溶液”加入Na2SO3固体的化学方程式为___________ 。
(6)粗碲经熔融结晶法能得到高纯碲。若500kg电镀污泥可以制得100kg含碲99.8%的高纯碲,已知电镀污泥中含Cu2Te的质量分数为49.9%,计算提纯过程中碲的利用率为___________ %。

已知:①煅烧过程中Cu2Te发生的反应为
 ;
;②TeO2是两性氧化物,微溶于水,NaTeO3溶液为无色溶液。
(1)煅烧过程中的主要反应为
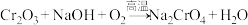 ,该反应中还原剂与氧化剂的物质的量之比为
,该反应中还原剂与氧化剂的物质的量之比为(2)水浸渣的成分为
(3)图中生成Na2Cr2O7溶液时的离子方程式为
(4)电解沉积除铜时,阳极电极反应式为
(5)写出向“含TeOSO4溶液”加入Na2SO3固体的化学方程式为
(6)粗碲经熔融结晶法能得到高纯碲。若500kg电镀污泥可以制得100kg含碲99.8%的高纯碲,已知电镀污泥中含Cu2Te的质量分数为49.9%,计算提纯过程中碲的利用率为
您最近一年使用:0次
2023-12-31更新
|
413次组卷
|
2卷引用:河北省2024届高三上学期大数据应用调研联合测评Ⅲ化学试卷
5 . 第VA族元素又称氮族元素,回答下列问题。
(1)基态P原子的价层电子排布图:_____ 。
(2)氮族元素的化合物应用广泛。
①下列说法正确的是_____ 。
A.激发态氮原子跃迁到基态时,可用光谱仪摄取原子的吸收光谱
B.第二周期中第一电离能介于B与N之间的元素有3种
C.氮族元素气态氢化物键角大小: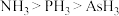
D. 中存在配位键,提供空轨道的是N
中存在配位键,提供空轨道的是N
②氮、硼和氢可以形成平面六元环结构的硼氮苯,分子式为 ,其结构式为
,其结构式为_____ 。
③结合质子能力: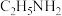
_____  (填“>”或“<”),理由是
(填“>”或“<”),理由是_____ 。
(3)某含砷化合物晶胞如图所示, 原子位于紧邻
原子位于紧邻 原子构成的正三棱柱的体心。阿伏加德罗常数的值为
原子构成的正三棱柱的体心。阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为_____  (写出计算式即可),每个
(写出计算式即可),每个 原子的配位数(紧邻的
原子的配位数(紧邻的 原子数)为
原子数)为_____ 。
(1)基态P原子的价层电子排布图:
(2)氮族元素的化合物应用广泛。
①下列说法正确的是
A.激发态氮原子跃迁到基态时,可用光谱仪摄取原子的吸收光谱
B.第二周期中第一电离能介于B与N之间的元素有3种
C.氮族元素气态氢化物键角大小:
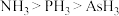
D.
 中存在配位键,提供空轨道的是N
中存在配位键,提供空轨道的是N②氮、硼和氢可以形成平面六元环结构的硼氮苯,分子式为
 ,其结构式为
,其结构式为③结合质子能力:
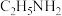
 (填“>”或“<”),理由是
(填“>”或“<”),理由是(3)某含砷化合物晶胞如图所示,
 原子位于紧邻
原子位于紧邻 原子构成的正三棱柱的体心。阿伏加德罗常数的值为
原子构成的正三棱柱的体心。阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为 (写出计算式即可),每个
(写出计算式即可),每个 原子的配位数(紧邻的
原子的配位数(紧邻的 原子数)为
原子数)为
您最近一年使用:0次
名校
解题方法
6 . 氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(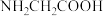 )是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
(1) 分子中氮原子和氢原子的价电子排布图分别为
分子中氮原子和氢原子的价电子排布图分别为___________ (填字母序号)。 和
和 分子中均含有以N原子为中心原子的大
分子中均含有以N原子为中心原子的大 键
键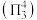 。
。
 分子中
分子中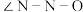
___________  分子中
分子中 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
(3)甘氨酸的晶体类型为___________ ,其中C原子的杂化方式为___________ ,其熔、沸点远高于相对分子质量几乎相等的丙酸(熔点为-21℃,沸点为141℃)的主要原因:一是甘氨酸能形成内盐;二是___________ 。
(4)三价铁的强酸盐溶于水后经水解可以生成如下图1所示的二聚体,其中 的配位数为
的配位数为___________ ,过渡元素的s、p、d轨道可以参与杂化,含s、p、d轨道的杂化类型有:① 、②
、② 、③
、③ ,该二聚体中Fe采取的杂化类型为
,该二聚体中Fe采取的杂化类型为___________ (填标号)。___________ 金刚石(填“>”、“<”或“=”)。若碳原子半径为a,金刚石晶胞的边长为b.计算表示碳原子在晶胞中的空间占有率___________ 。(答案写只含π的表达式)
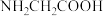 )是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。(1)
 分子中氮原子和氢原子的价电子排布图分别为
分子中氮原子和氢原子的价电子排布图分别为a. b.
b.  c.
c.  d.
d.
 和
和 分子中均含有以N原子为中心原子的大
分子中均含有以N原子为中心原子的大 键
键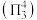 。
。 分子中
分子中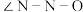
 分子中
分子中 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);(3)甘氨酸的晶体类型为
(4)三价铁的强酸盐溶于水后经水解可以生成如下图1所示的二聚体,其中
 的配位数为
的配位数为 、②
、② 、③
、③ ,该二聚体中Fe采取的杂化类型为
,该二聚体中Fe采取的杂化类型为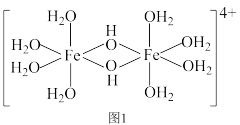
您最近一年使用:0次
2023-11-21更新
|
567次组卷
|
3卷引用:2024届四川省内江市威远中学校高三下学期第一次模拟考试理科综合试题-高中化学
解题方法
7 . 硫是组成生命的重要元素。回答下列问题:
(1)基态S原子含有___________ 种能量不同的电子,其价层电子排布图是___________ 。
(2)S单质的常见形式为 (
(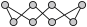 ),其中S原子采用的轨道杂化方式是
),其中S原子采用的轨道杂化方式是___________ 。
(3)已知化合物 (
( )中键角α为124°,β为96°,α>β的原因主要是
)中键角α为124°,β为96°,α>β的原因主要是___________ 。
(4) 的结构简图如图所示,其中不存在的作用力有
的结构简图如图所示,其中不存在的作用力有___________ (填字母)。
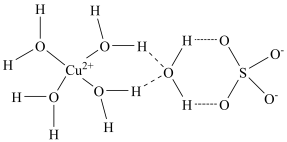
A.氢键 B.共价键 C.金属键 D.配位键
 的空间构型是
的空间构型是___________ ,写出一个与 互为等电子体的阴离子的化学式
互为等电子体的阴离子的化学式___________ 。
(5)ZnS在光导体材料、涂料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶体密度为 ,若将a位置
,若将a位置 离子的分数坐标确定为(0,0,0),则b位置
离子的分数坐标确定为(0,0,0),则b位置 离子的分数坐标为
离子的分数坐标为___________ , 离子与
离子与 离子的最近距离为
离子的最近距离为___________ pm(列出计算式,阿伏加德罗常数用 表示)。
表示)。

(1)基态S原子含有
(2)S单质的常见形式为
 (
( ),其中S原子采用的轨道杂化方式是
),其中S原子采用的轨道杂化方式是(3)已知化合物
 (
( )中键角α为124°,β为96°,α>β的原因主要是
)中键角α为124°,β为96°,α>β的原因主要是(4)
 的结构简图如图所示,其中不存在的作用力有
的结构简图如图所示,其中不存在的作用力有
A.氢键 B.共价键 C.金属键 D.配位键
 的空间构型是
的空间构型是 互为等电子体的阴离子的化学式
互为等电子体的阴离子的化学式(5)ZnS在光导体材料、涂料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶体密度为
 ,若将a位置
,若将a位置 离子的分数坐标确定为(0,0,0),则b位置
离子的分数坐标确定为(0,0,0),则b位置 离子的分数坐标为
离子的分数坐标为 离子与
离子与 离子的最近距离为
离子的最近距离为 表示)。
表示)。
您最近一年使用:0次
解题方法
8 . 硫及其化合物种类繁多,应用广泛。请回答:
(1)基态硫原子的价层电子排布图是_______ 。
(2)下列有关说法正确的是_______。
(3) 中的O-O比H2O2中的更
中的O-O比H2O2中的更_______ (填“难”或“易”)断裂。其原因是_______ 。
(4)锌与硫形成的化合物晶体的晶胞如图所示。_______ 。
②设 为阿伏加德罗常数的值,晶胞参数为anm,则该晶体的密度
为阿伏加德罗常数的值,晶胞参数为anm,则该晶体的密度_______ 。
(1)基态硫原子的价层电子排布图是
(2)下列有关说法正确的是_______。
| A.同周期元素中,第一电离能大于硫元素的有3种 |
| B.SO2的VSEPR模型和空间结构均为V形 |
C.甲基磺酸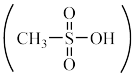 中S原子采取sp杂化 中S原子采取sp杂化 |
D. 的发射光谱不止1条谱线 的发射光谱不止1条谱线 |
(3)
 中的O-O比H2O2中的更
中的O-O比H2O2中的更(4)锌与硫形成的化合物晶体的晶胞如图所示。
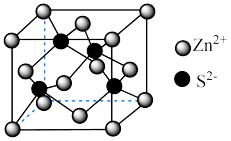
②设
 为阿伏加德罗常数的值,晶胞参数为anm,则该晶体的密度
为阿伏加德罗常数的值,晶胞参数为anm,则该晶体的密度
您最近一年使用:0次
解题方法
9 . 硼(B)和硅(Si)在周期表中处于一条对角线上,有许多相似的性质。请回答:
(1)基态B原子的价层电子轨道表示式是___________ 。
(2)硼与硅相似,也能与氢形成一类化合物——硼烷。常见的有乙硼烷( )、丁硼烷(
)、丁硼烷( )、己硼烷(
)、己硼烷(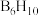 )等。
)等。
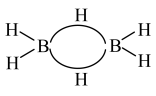
①乙硼烷( )分子中的B原子通过氢桥键(
)分子中的B原子通过氢桥键(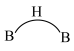 )形成一个四元环,结构式如下图。丁硼烷(
)形成一个四元环,结构式如下图。丁硼烷( )分子中存在4个氢桥键且有两个五元环,写出其结构式
)分子中存在4个氢桥键且有两个五元环,写出其结构式___________ 。
②下列说法不正确 的是___________ 。
A.在自然界中没有游离态的硼,它易与氧化合形成含氧矿物
B.上述硼烷的沸点:乙硼烷<丁硼烷<己硼烷
C. 与
与 中硼原子的杂化方式相同
中硼原子的杂化方式相同
D.硼烷的通式为
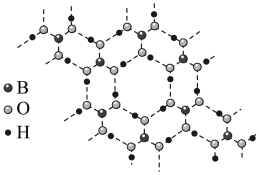
③乙硼烷水解生成硼酸( ),常温常压下硼酸晶体结构为层状,其二维平面结构如图,含
),常温常压下硼酸晶体结构为层状,其二维平面结构如图,含 的晶体中有
的晶体中有___________ mol氢键。
硼酸是一元弱酸,它本身不给出质子,但是溶于水后能给出 。请解释硼酸水溶液呈酸性的原因(用方程式表示)
。请解释硼酸水溶液呈酸性的原因(用方程式表示)___________ 。
(3)磷化硼(BP)是一种重要的半导体材料,在电子学、能源等领域有广泛应用。某种磷化硼晶体的晶胞如图。

①P原子的配位数(紧邻的B原子数)为___________ 。
②图中原子a的坐标为(0,0,1),则原子b的坐标为___________ 。
(1)基态B原子的价层电子轨道表示式是
(2)硼与硅相似,也能与氢形成一类化合物——硼烷。常见的有乙硼烷(
 )、丁硼烷(
)、丁硼烷( )、己硼烷(
)、己硼烷(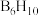 )等。
)等。①乙硼烷(
 )分子中的B原子通过氢桥键(
)分子中的B原子通过氢桥键( )形成一个四元环,结构式如下图。丁硼烷(
)形成一个四元环,结构式如下图。丁硼烷( )分子中存在4个氢桥键且有两个五元环,写出其结构式
)分子中存在4个氢桥键且有两个五元环,写出其结构式
②下列说法
A.在自然界中没有游离态的硼,它易与氧化合形成含氧矿物
B.上述硼烷的沸点:乙硼烷<丁硼烷<己硼烷
C.
 与
与 中硼原子的杂化方式相同
中硼原子的杂化方式相同D.硼烷的通式为

③乙硼烷水解生成硼酸(
 ),常温常压下硼酸晶体结构为层状,其二维平面结构如图,含
),常温常压下硼酸晶体结构为层状,其二维平面结构如图,含 的晶体中有
的晶体中有
硼酸是一元弱酸,它本身不给出质子,但是溶于水后能给出
 。请解释硼酸水溶液呈酸性的原因(用方程式表示)
。请解释硼酸水溶液呈酸性的原因(用方程式表示)(3)磷化硼(BP)是一种重要的半导体材料,在电子学、能源等领域有广泛应用。某种磷化硼晶体的晶胞如图。

①P原子的配位数(紧邻的B原子数)为
②图中原子a的坐标为(0,0,1),则原子b的坐标为
您最近一年使用:0次
解题方法
10 . 钴酸锂(LiCoO2)是常见的锂离子电池正极材料,其晶胞结构示意图如图。晶体中O围绕Co形成八面体,八面体共棱形成带负电的层状空间结构,与Li+层交替排列。在充放电过程中,Li+在层间脱出或嵌入。
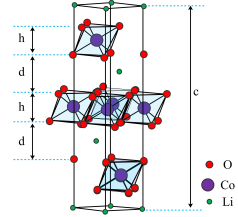
(1)下列Li原子电子排布图表示的状态中,能量最低的是______ 。
(2)Li+与H-具有相同的电子构型,离子半径r(Li+)小于r(H-)的主要原因是______ 。
(3)观察该晶胞图示,其中Li处于晶胞顶点或晶胞内部,Co处于晶胞内部或晶胞侧棱上,而O的位置不易观察。结合钴酸锂(LiCoO2)化学式,可推断该晶胞中O的个数为______ 。
(4)晶胞底面为菱形,晶胞高度为cnm,Co和O组成八面体层高度为hnm,计算两层间的距离d=______ nm。(列出计算式)
(5)Li+在______ (填“充电”或“放电”)过程中会从八面体层间脱出。该过程会导致晶胞高度c变大,解释原因:______ 。

(1)下列Li原子电子排布图表示的状态中,能量最低的是
A.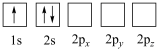 | B.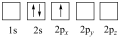 |
C.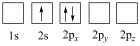 | D. |
(2)Li+与H-具有相同的电子构型,离子半径r(Li+)小于r(H-)的主要原因是
(3)观察该晶胞图示,其中Li处于晶胞顶点或晶胞内部,Co处于晶胞内部或晶胞侧棱上,而O的位置不易观察。结合钴酸锂(LiCoO2)化学式,可推断该晶胞中O的个数为
(4)晶胞底面为菱形,晶胞高度为cnm,Co和O组成八面体层高度为hnm,计算两层间的距离d=
(5)Li+在
您最近一年使用:0次








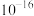
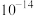
 /%
/% /%
/% /%
/%

